1 . 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如图:
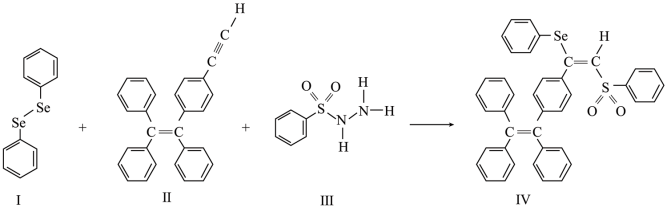
回答下列问题:
(1)Se与S同族,基态硒原子价电子排布式为_____ 。
(2)H2Se的沸点低于H2O,其原因是_____ 。
(3)关于I~Ⅲ三种反应物,下列说法正确的有_____ (填字母)。
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅲ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有_____ (填元素符号)。
(5)硒的两种含氧酸的酸性强弱为H2SeO4_____ H2SeO3(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒。SeO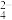 的立体构型为
的立体构型为_____ 。
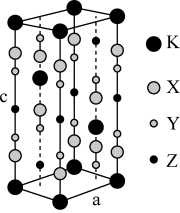
(6)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
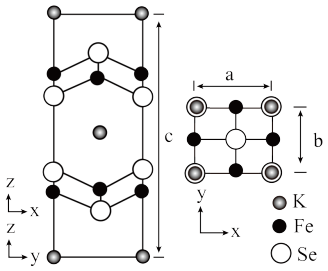
①该超导材料的最简化学式为_____ 。
②Fe原子的配位数为_____ 。
③该晶胞参数a=b=0.4nm、c=1.4nm。阿伏加德罗常数的值为NA,则该晶体的密度为_____ g•cm-3(列出计算式)。

回答下列问题:
(1)Se与S同族,基态硒原子价电子排布式为
(2)H2Se的沸点低于H2O,其原因是
(3)关于I~Ⅲ三种反应物,下列说法正确的有
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅲ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为H2SeO4
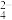 的立体构型为
的立体构型为(6)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:

①该超导材料的最简化学式为
②Fe原子的配位数为
③该晶胞参数a=b=0.4nm、c=1.4nm。阿伏加德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
2 . 光刻技术需要利用深紫激光,我国是唯掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一实用化的晶体是氟代硼铍酸钾晶体KBBF(KBe2BO3F2), 实验室可用BeO、KBF4 和B2O3在700°C左右灼烧获得氟代硼铍酸钾晶体(晶胞如下图所示,其中K原子已经给出,氧原子略去),并放出BF3气体。
回答下列问题:
(1)基态钾原子的核外电子排布式为___________ ,能量最高的电子的电子云轮廓图形状为___________________ 。
(2)BF3的中心原子的杂化方式为_____________ ,与其互为等电子体的阴离子为__________ (填一种即可)。
(3)氟代硼铍酸钾晶体KBBF(KBe2BO3F2)组成元素中电负性最大的元素和电负性最小的元素组成的物质为__________ 。
(4)KBF4的阴离子空间构型为_________ 。
(5)三卤化硼的性质如下:
BF3、BCl3、 BBr3、BI3的沸点逐渐升高的原因是:________________________________ 。
(6)指出图中代表硼原子的字母为_________ ,该KBBF晶体的晶胞参数分别为apm和cpm, α=β=γ=90°, 则晶体密度为___________ g·cm-3(M代表KBBF的摩尔质量,NA表示阿伏伽德罗常数的值,列出计算式)。

回答下列问题:
(1)基态钾原子的核外电子排布式为
(2)BF3的中心原子的杂化方式为
(3)氟代硼铍酸钾晶体KBBF(KBe2BO3F2)组成元素中电负性最大的元素和电负性最小的元素组成的物质为
(4)KBF4的阴离子空间构型为
(5)三卤化硼的性质如下:
BF3 | BCl3 | BBr3 | BI3 | |
熔点/°C | -127 | -107 | -46 | 49.9 |
沸点/°C | -99 | 12.5 | 91.3 | 210 |
(6)指出图中代表硼原子的字母为
您最近一年使用:0次
3 . 中国科学家在国际上首次实现了CO2到淀粉的合成,不依赖植物光合作用,原料只需CO2、H2和电,相关成果发表在《科学》上。回答下列问题:
(1)CO2的空间结构为_______ 。
(2)淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是_______ (用离子方程式表示)。
(3)淀粉在一定条件下可水解成葡萄糖(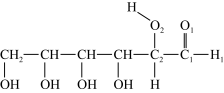 ),葡萄糖分子中键角∠H1C1O1
),葡萄糖分子中键角∠H1C1O1_______ ∠C1C2O2 (填“>”、“<”或“=”)。
(4)(CH3NH3)PbI3的晶胞结构如图所示,其中B代表Pb2+。
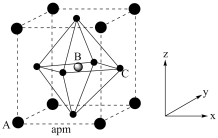
①Pb位于第六周期第IVA族,其基态原子的价电子排布图为_______ ,基态I原子核外电子占据最高能级的电子云轮廓图为_______ 。
②(CH3NH3)PbI3中涉及的短周期元素的电负性由大到小的顺序为_______ (用元素符号表示)。
③有机阳离子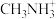 可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是
可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是_______ 、_______ 。
④_______ (填“A”或“C”)代表I-,原子分数坐标A为(0,0,0),B为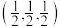 ,则C的原子分数坐标为
,则C的原子分数坐标为_______ 。NA为阿伏加德罗常数的值,则(CH3NH3)PbI3晶体的密度为_______ g∙cm-3。
(1)CO2的空间结构为
(2)淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是
(3)淀粉在一定条件下可水解成葡萄糖(
 ),葡萄糖分子中键角∠H1C1O1
),葡萄糖分子中键角∠H1C1O1(4)(CH3NH3)PbI3的晶胞结构如图所示,其中B代表Pb2+。

①Pb位于第六周期第IVA族,其基态原子的价电子排布图为
②(CH3NH3)PbI3中涉及的短周期元素的电负性由大到小的顺序为
③有机阳离子
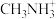 可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是
可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是④
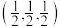 ,则C的原子分数坐标为
,则C的原子分数坐标为
您最近一年使用:0次
名校
解题方法
4 . 硼材料及含硼化合物的用途非常广泛,如B(C6F5)3可代品Cu催化重氮化合物对杂环分子的修饰、催化吲哚与苯乙炔的区域选择性加成等。回答下列问题:
(1)基态Cu原子的价电子排布式为___________ 。 是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过
是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过___________ 的方法区分晶体与准晶体。
(2)B、C、F的电负性由大到小的顺序为___________ ;Be、B、C是同周期相邻元素,第一电离能: ,这是因为
,这是因为___________ 。
(3)B(C6F5)3分子中所有原子___________ (填“能”或“不能”)处于同一平面。
(4)吲哚(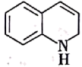 )的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是
)的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是_________ 。
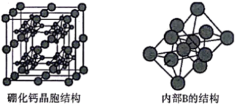
(5)硼化钙的晶胞结构如图所示,晶胞参数为apm,设 为阿伏加德罗常数的值。硼化钙的化学式为
为阿伏加德罗常数的值。硼化钙的化学式为___________ ,其晶体的密度为___________  (列出计算式)。
(列出计算式)。
(1)基态Cu原子的价电子排布式为
 是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过
是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过(2)B、C、F的电负性由大到小的顺序为
 ,这是因为
,这是因为(3)B(C6F5)3分子中所有原子
(4)吲哚(
 )的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是
)的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是(5)硼化钙的晶胞结构如图所示,晶胞参数为apm,设
 为阿伏加德罗常数的值。硼化钙的化学式为
为阿伏加德罗常数的值。硼化钙的化学式为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2021-11-23更新
|
194次组卷
|
3卷引用:陕西省榆林市第十中学2022届高三第五次模拟考试理综化学试题
5 . Fe—Cr—Si系合金是一种新型耐磨耐腐蚀的材料,具有较好的发展前景。按要求回答下列问题。
(1)基态Cr2+与Fe的未成对电子数之比为___ 。试从电子排布角度分析水溶液中Fe2+具有强还原性___ 。若是形成将其转化为(NH4)2Fe(SO4)2,在空气中相对稳定, 的空间构型为
的空间构型为___ 。
(2)由环戊二烯(C5H6,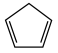 )与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知
)与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知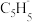 的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为
的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为___ ,结构中的大π键可用符号表示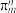 ,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为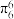 )。则
)。则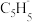 结构中含有的大π键可表示为
结构中含有的大π键可表示为___ 。
(3)某含铬配合物,[Cr3O(CH3COO)6(H2O)3]Cl·8H2O,指出其中Cr的化合价为___ 。几种Cr的卤化物的部分性质如表所示:
试预测CrBr3的熔点范围___ 。
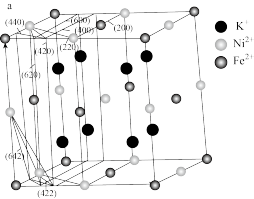
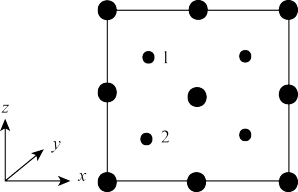
(4)某晶体中含有K+、Ni2+、Fe2+、CN-,其部分微粒在晶胞结构的位置如图所示。1个晶胞中含有CN-___ 个。该物质常用于吸附Cs+,将取代晶胞中的K+,取代后的物质的化学式为___ 。
(1)基态Cr2+与Fe的未成对电子数之比为
 的空间构型为
的空间构型为(2)由环戊二烯(C5H6,
 )与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知
)与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知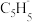 的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为
的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为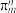 ,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为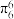 )。则
)。则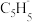 结构中含有的大π键可表示为
结构中含有的大π键可表示为(3)某含铬配合物,[Cr3O(CH3COO)6(H2O)3]Cl·8H2O,指出其中Cr的化合价为
| 卤化物 | CrCl3 | CrBr3 | CrI3 |
| 熔点/℃ | 1150 | 600 |
(4)某晶体中含有K+、Ni2+、Fe2+、CN-,其部分微粒在晶胞结构的位置如图所示。1个晶胞中含有CN-

您最近一年使用:0次
解题方法
6 . 金属钛被誉为“二十一世纪金属”,有“生物金属,海洋金属,太空金属”的美称,具有广泛的应用前景。回答下列问题:
(1)钛在周期表中的位置___________ , 钛原子核外有___________ 种空间运动状态不同的电子,Ti2+电子占据的最高能层的电子排布式为___________ 。
(2)磷酸钛铝锂可用作锂离子电池的正极材料,PO 的空间构型是
的空间构型是___________ ,第一电离能介于Al、P之间的第三周期元素为___________ (填元素符号)。
(3)Ti(BH4)2是一种储氢材料,其中所含元素的电负性由小到大排列顺序为___________ ,B原子的杂化方式是___________ ,其中的BH 可由BH3和H-结合而成。BH
可由BH3和H-结合而成。BH 含有
含有___________ (填序号)
①σ键 ②π键 ③氢键 ④配位键 ⑤离子键
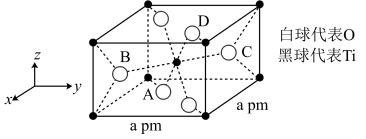
(4)TiO2的一种晶胞具有典型的四方晶系结构(如图所示),以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。晶胞中A、B的原子坐标为(0.31,0.31,0),(0.81,0.19,0.5)。已知晶胞含对称中心,则C、D原子坐标为___________ 、___________ 。该晶胞中B、C两个氧原子之间的核间距d=___________ pm。
(1)钛在周期表中的位置
(2)磷酸钛铝锂可用作锂离子电池的正极材料,PO
 的空间构型是
的空间构型是(3)Ti(BH4)2是一种储氢材料,其中所含元素的电负性由小到大排列顺序为
 可由BH3和H-结合而成。BH
可由BH3和H-结合而成。BH 含有
含有①σ键 ②π键 ③氢键 ④配位键 ⑤离子键
(4)TiO2的一种晶胞具有典型的四方晶系结构(如图所示),以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。晶胞中A、B的原子坐标为(0.31,0.31,0),(0.81,0.19,0.5)。已知晶胞含对称中心,则C、D原子坐标为

您最近一年使用:0次
2021-05-14更新
|
373次组卷
|
2卷引用:陕西省西安市长安区2021届高三5月第二次模拟考试理综化学试题
解题方法
7 . 磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(SARS-CoV-2)的感染。磷酸氯喹的结构如图所示,据此回答下列问题。
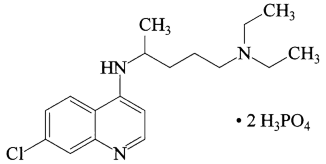
(1)基态P原子中,电子占据的最高能级符号为___ ,基态N原子核外有__ 种运动状态不同的电子。
(2)C、N、O三种元素电负性从大到小的顺序为___ ;第一电离能χ(P)__ χ(Cl)(填“>”或“<”)。
(3)磷酸氯喹中N原子的杂化方式为__ ,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是___ 。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体碳化硅类似,熔点如表所示,
①GaN、GaP、GaAs的熔点变化原因是___ 。
②砷化镓晶体中含有的化学键类型为___ (填选项字母)。
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置。称作原子分数坐标。如图为沿y轴投影的磷化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(0.25,0.25,0.75),则原子2的原子分数坐标为___ ;若磷化镓的晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为___ pm(用代数式表示)。

(1)基态P原子中,电子占据的最高能级符号为
(2)C、N、O三种元素电负性从大到小的顺序为
(3)磷酸氯喹中N原子的杂化方式为
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体碳化硅类似,熔点如表所示,
| GaN | GaP | GaAs | |
| 熔点/℃ | 1700 | 1480 | 1238 |
②砷化镓晶体中含有的化学键类型为
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置。称作原子分数坐标。如图为沿y轴投影的磷化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(0.25,0.25,0.75),则原子2的原子分数坐标为

您最近一年使用:0次
2021-05-03更新
|
224次组卷
|
2卷引用:陕西省宝鸡市陈仓区2022届高三上学期第一次教学质量检测化学试题
名校
解题方法
8 . 很多过渡金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Fe的基态原子价电子排布式为___________ 。
②Ti的基态原子共有___________ 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序是___________ (用元素符号表示)。
②CCl4和COCl2分子中所有原子均满足8电子构型,CCl4和COCl2分子中σ键的个数比为_______ ,COCl2分子的中心原子的杂化方式为_________ 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,从微观角度解释NiO的熔点高于FeO的原因为___________ 。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
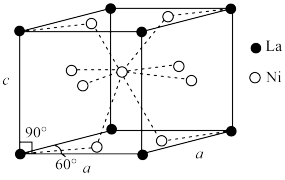
①该晶体的化学式为___________ 。
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3.设NA为阿伏加德罗常数的值,则该晶胞的体积是___________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9×10-5g·cm-3;储氢能力= 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为___________ 。(NA可近似取6×1023,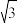 =1.7)
=1.7)
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Fe的基态原子价电子排布式为
②Ti的基态原子共有
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序是
②CCl4和COCl2分子中所有原子均满足8电子构型,CCl4和COCl2分子中σ键的个数比为
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,从微观角度解释NiO的熔点高于FeO的原因为
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3.设NA为阿伏加德罗常数的值,则该晶胞的体积是
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9×10-5g·cm-3;储氢能力=
 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为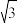 =1.7)
=1.7)
您最近一年使用:0次
2021-04-08更新
|
311次组卷
|
4卷引用:陕西省西安市长安区2021届高考第一次模拟考试理综化学试题
名校
解题方法
9 . 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________ 。
②Fe的基态原子共有________ 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是____________________ (用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________ ,中心原子的杂化方式为________ 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO________ (填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
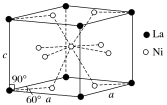
①该晶体的化学式为________________ 。
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511pm,c=397pm;标准状况下氢气的密度为8.98×10-5g·cm-3;储氢能力= 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________ 。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为
②Fe的基态原子共有
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511pm,c=397pm;标准状况下氢气的密度为8.98×10-5g·cm-3;储氢能力=
 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
您最近一年使用:0次
2020-11-12更新
|
346次组卷
|
13卷引用:陕西省师范大学附属中学2017届高三下学期第十一次模考理综化学试题
陕西省师范大学附属中学2017届高三下学期第十一次模考理综化学试题2016届安徽省安庆一中高三热身考试理综化学试卷2016届湖北省襄阳五中高三5月模拟三理综化学试卷四川省内江市2017届高三第五次模拟考试理综化学试题2016届河北省晋州一中高三上学期期末理综化学试卷2017届安徽省黄山市屯溪一中高三上月考二化学卷苏教版2017届高三单元精练检测十一化学试题湖北省孝感市八校2018届高三上学期期末考试理综化学试题(已下线)2018年6月1日 押高考化学第35题(2)——《每日一题》2018年高三化学四轮复习(已下线)解密21 物质的结构与性质(教师版)——备战2018年高考化学之高频考点解密(已下线)2019年5月31日《每日一题》四轮复习—— 押高考化学第35题(2)四川省成都附属实验中学2021届高三上学期11月月考理科综合化学试题(已下线)第三单元 物质的聚集状态性质与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)
名校
解题方法
10 . 铜是重要的过渡元素,其单质及化合物具有广泛用途。回答下列问题:
(1)铜元素基态原子的价电子排布式为________ 。
(2)铜元素能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。
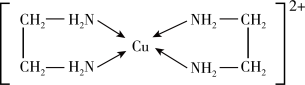
①Cu2+与乙二胺所形成的配离子内部粒子间的作用力类型有________ 。
A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
②乙二胺分子中氮原子的杂化轨道类型为________ ,C、N、H三种元素的电负性由大到小顺序是 ___ 。
③乙二胺和三甲胺 [N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是________ 。
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是______ 。
(4)Cu和S形成某种晶体的晶胞如图所示。
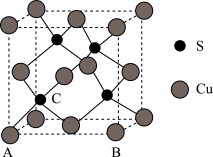
①该晶体的化学式为________ 。
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为________
③已知该晶体的密度为 dg•cm-3,Cu2+和S2-的半径分别为apm和bpm,阿伏加 德罗常数值为NA。列式表示该晶体中原子的空间利用率________ 。
(1)铜元素基态原子的价电子排布式为
(2)铜元素能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。

①Cu2+与乙二胺所形成的配离子内部粒子间的作用力类型有
A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
②乙二胺分子中氮原子的杂化轨道类型为
③乙二胺和三甲胺 [N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是
(4)Cu和S形成某种晶体的晶胞如图所示。

①该晶体的化学式为
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为
③已知该晶体的密度为 dg•cm-3,Cu2+和S2-的半径分别为apm和bpm,阿伏加 德罗常数值为NA。列式表示该晶体中原子的空间利用率
您最近一年使用:0次
2020-09-01更新
|
807次组卷
|
4卷引用:陕西省西安中学2020届高三第二次模拟考试化学试题



