名校
解题方法
1 . 学习化学一定要领悟好问题情景。
(1)①书写以下各微粒的电子式。
—OH___________ ,HBrO___________ ,CS2___________ ,NH4H___________ ;
②用电子式表示Na和S形成Na2S的过程___________ 。
(2)氮元素的化合物种类繁多,性质也各不相同。请回答下列问题:
已知:①N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1
③N2(g)+3H2(g)=2NH3(g)ΔH=-92.4kJ·mol-1
则反应:④4NH3(g)+5O2(g)=4NO(g)+6H2O(g)的ΔH=___________ kJ·mol-1。
(3)电负性与原子所处的具体的化学环境紧密相关。有机化合物CH3I和CF3I发生水解时的主要反应分别是:CH3I+H2O→CH3OH+HI和CF₃I+H₂O→CF3H+HIO。从电负性的角度分析,为什么CF3I水解的产物不是HI的原因___________ 。
(4)工业上用Na2SO3吸收尾气中SO2使之转化为NaHSO3,再以SO2为原料设计原电池,然后电解(惰性电极)NaHSO3制取H2SO4,装置如下:
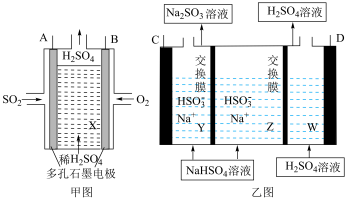
①甲图中A电极上的反应式为___________ 。
②甲图中B与乙图___________ (填“C”或“D”)极相连,进行电解时乙图Z中Na+向___________ (填“Y”或“W”)中移动。
③该电解池阴极的电极反应式为___________ ;
(5)Ni可活化C2H6放出CH4,其反应历程如下图所示:

下列关于活化历程的说法错误的是
(1)①书写以下各微粒的电子式。
—OH
②用电子式表示Na和S形成Na2S的过程
(2)氮元素的化合物种类繁多,性质也各不相同。请回答下列问题:
已知:①N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1
③N2(g)+3H2(g)=2NH3(g)ΔH=-92.4kJ·mol-1
则反应:④4NH3(g)+5O2(g)=4NO(g)+6H2O(g)的ΔH=
(3)电负性与原子所处的具体的化学环境紧密相关。有机化合物CH3I和CF3I发生水解时的主要反应分别是:CH3I+H2O→CH3OH+HI和CF₃I+H₂O→CF3H+HIO。从电负性的角度分析,为什么CF3I水解的产物不是HI的原因
(4)工业上用Na2SO3吸收尾气中SO2使之转化为NaHSO3,再以SO2为原料设计原电池,然后电解(惰性电极)NaHSO3制取H2SO4,装置如下:

①甲图中A电极上的反应式为
②甲图中B与乙图
③该电解池阴极的电极反应式为
(5)Ni可活化C2H6放出CH4,其反应历程如下图所示:

下列关于活化历程的说法错误的是
| A.活化能最大的步骤:中间体2→中间体3 |
| B.只涉及极性键的断裂和生成 |
| C.在此反应过程中Ni的成键数目发生变化 |
D.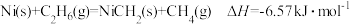 |
您最近一年使用:0次
解题方法
2 . 我国化学家研究发现,十八胺在较高温度下具有一定的还原性,由于不同的金属盐从十八胺中获得电子的能力不同,在十八胺体系中反应可以得到不同的产物:当以两种非贵金属盐为原料时得到混合金属氧化物(如 等),以
等),以 和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如
和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如 等),除
等),除 之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如
之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如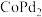 等)。
等)。
回答下列问题:
(1)十八胺中含有氮元素,含氮元素的三种离子 的键角由大到小的顺序是
的键角由大到小的顺序是___________ 。
(2) 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是___________ 。
(3)以 和钴盐为原料时得到的产物
和钴盐为原料时得到的产物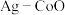 而非
而非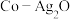 的原因是
的原因是___________ 。
(4)推测 盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为
盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为___________ 。
(5)一种含钴的离子结构如图所示: 的价电子轨道表示式是
的价电子轨道表示式是___________ 。已知磁矩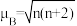 (n表示未成对电子数),则
(n表示未成对电子数),则 的磁矩
的磁矩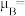
___________ 。
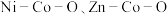 等),以
等),以 和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如
和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如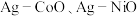 等),除
等),除 之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如
之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如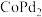 等)。
等)。
| 元素 |  |  |  |  |  |  |  |
| 电负性(鲍林标度) | 1.6 | 1.8 | 1.8 | 1.9 | 2.2 | 2.2 | 2.4 |
(1)十八胺中含有氮元素,含氮元素的三种离子
 的键角由大到小的顺序是
的键角由大到小的顺序是(2)
 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是(3)以
 和钴盐为原料时得到的产物
和钴盐为原料时得到的产物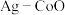 而非
而非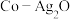 的原因是
的原因是(4)推测
 盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为
盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为(5)一种含钴的离子结构如图所示:
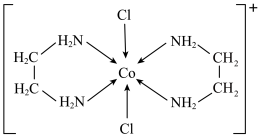
 的价电子轨道表示式是
的价电子轨道表示式是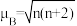 (n表示未成对电子数),则
(n表示未成对电子数),则 的磁矩
的磁矩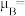
您最近一年使用:0次
名校
解题方法
3 . 我国是世界上最早制得和使用金属锌的国家,锌在人类生产生活中有重要应用。回答下列问题:
I. 一种 Zn2+配合物广泛应用于催化剂,光导体,光动力疗法,其结构如图所示:
(1)Zn2+价电子轨道表示式为__________ 。
(2)该配合物中电负性最大的元素是__________ 。
(3)下列状态的氮中,电离最外层一个电子所需能量最大的是__________。(填序号)
(4)该配合物中 C 的轨道杂化类型为__________ 。
(5)该配合物中 Zn2+的配位数为__________ 个。
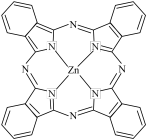
Ⅱ. ZnS 常用作分析试剂、荧光体、白色颜料等。
(6)ZnS 常见有 2 种晶胞结构如下图:立方晶胞(左图)和六方晶胞(右图)。
下列说法错误的是__________。(填序号)
(7)立方 ZnS 中,若 Zn2+与 S2-最短距离为 a nm,则晶胞密度ρ=__________ g·cm-3(列出计算式,阿伏加德罗常数的值为 NA)。
I. 一种 Zn2+配合物广泛应用于催化剂,光导体,光动力疗法,其结构如图所示:

(1)Zn2+价电子轨道表示式为
(2)该配合物中电负性最大的元素是
(3)下列状态的氮中,电离最外层一个电子所需能量最大的是__________。(填序号)
| A.[He]2s22p3 | B.[He]2s22p2 |
| C.[He]2s22p23s1 | D.[He]2s22p13s1 |
(5)该配合物中 Zn2+的配位数为
Ⅱ. ZnS 常用作分析试剂、荧光体、白色颜料等。
(6)ZnS 常见有 2 种晶胞结构如下图:立方晶胞(左图)和六方晶胞(右图)。

下列说法错误的是__________。(填序号)
| A.立方 ZnS 中与 S2—最近的 S2—有 12 个 | B.两种晶胞中 Zn2+的个数都为4 |
| C.立方 ZnS 中 S2—的配位数为 4 | D.可用 X—射线衍射实验鉴别六方 ZnS 是否属于晶体 |
您最近一年使用:0次
名校
解题方法
4 .  在催化剂作用下,与水反应生成
在催化剂作用下,与水反应生成 的前2步可能机理为:
的前2步可能机理为:
第1步: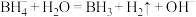
第2步:
……完成下列填空:
(1)已知电负性: 。
。 中B的化合价为
中B的化合价为_______ 。第1步反应的氧化产物是_______ ,(填化学式或离子符号)。
(2) 的分子空间构型是
的分子空间构型是_______ , 中B原子的杂化类型是
中B原子的杂化类型是_______ 。比较 与
与 的键角:
的键角:
_______ 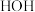 (填“>”、“<”或“=”),其原因是:
(填“>”、“<”或“=”),其原因是:_______ 。
(3)上述机理的第3、4步与第2步类似,最终生成 。用化学方程式表示第3步的机理:
。用化学方程式表示第3步的机理:_______ 。写出 的结构式:
的结构式:_______ 。根据上述机理, 与
与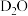 反应时,所得气体产物为
反应时,所得气体产物为_______ (填写化学式)。
(4) 分子中B原子与三个O原子构成平面三角形,则B原子的杂化类型是
分子中B原子与三个O原子构成平面三角形,则B原子的杂化类型是_______ 。
(5) 溶液中存在平衡:
溶液中存在平衡: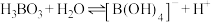 。下列叙述正确的是
。下列叙述正确的是
 在催化剂作用下,与水反应生成
在催化剂作用下,与水反应生成 的前2步可能机理为:
的前2步可能机理为:第1步:
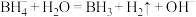
第2步:

……完成下列填空:
(1)已知电负性:
 。
。 中B的化合价为
中B的化合价为(2)
 的分子空间构型是
的分子空间构型是 中B原子的杂化类型是
中B原子的杂化类型是 与
与 的键角:
的键角:
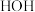 (填“>”、“<”或“=”),其原因是:
(填“>”、“<”或“=”),其原因是:(3)上述机理的第3、4步与第2步类似,最终生成
 。用化学方程式表示第3步的机理:
。用化学方程式表示第3步的机理: 的结构式:
的结构式: 与
与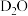 反应时,所得气体产物为
反应时,所得气体产物为(4)
 分子中B原子与三个O原子构成平面三角形,则B原子的杂化类型是
分子中B原子与三个O原子构成平面三角形,则B原子的杂化类型是(5)
 溶液中存在平衡:
溶液中存在平衡: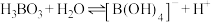 。下列叙述正确的是
。下列叙述正确的是A. 的水溶液显酸性 的水溶液显酸性 |
B.B原子杂化轨道中s轨道的成分: 大于 大于 |
| C.上述反应的2种反应物分子中,所有原子都达到8电子构型 |
D. 溶液中还可能存在 溶液中还可能存在 、 、 等系列微粒 等系列微粒 |
您最近一年使用:0次
名校
解题方法
5 . 生产、生活和科技发展离不开化学。请回答下列问题:
(1)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。
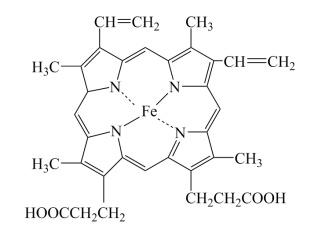
①基态Fe原子的价电子排布图为___________ ,Fe2+核外电子有___________ 种空间运动状态。
②血红素中各非金属元素的电负性由小到大的顺序为___________ 。
③Fe2+与邻二氮菲(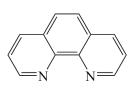 )等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:
)等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:___________ ;若OH-浓度高,OH-又会与Fe2+作用,同邻二氮菲形成竞争。
④卟琳是含有平面共轭大环结构的有机分子材料,具有独特的电子结构和光物理性质,卟琳分子结构如图,N原子的杂化轨道类型相同,采取___________ 杂化。
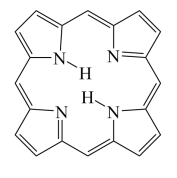
(2)立方砷化硼(BAs)在理论上具有比硅更好的导热性,以及更高的双极性迁移率,有潜力成为比硅更优良的半导体材料。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,立方砷化硼晶胞结构如图所示。As位于元素周期表的___________ 区,找出距离As(0.25,0.25,0.25)最近的As___________ (用分数坐标表示)。
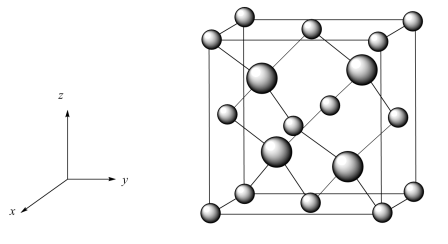
②已知晶体密度为ag·cm-3,As半径为bpm,假设As、B原子相切,则B原子的半径为___________ pm(列出计算式)。
(1)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。

①基态Fe原子的价电子排布图为
②血红素中各非金属元素的电负性由小到大的顺序为
③Fe2+与邻二氮菲(
 )等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:
)等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:④卟琳是含有平面共轭大环结构的有机分子材料,具有独特的电子结构和光物理性质,卟琳分子结构如图,N原子的杂化轨道类型相同,采取

(2)立方砷化硼(BAs)在理论上具有比硅更好的导热性,以及更高的双极性迁移率,有潜力成为比硅更优良的半导体材料。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,立方砷化硼晶胞结构如图所示。As位于元素周期表的

②已知晶体密度为ag·cm-3,As半径为bpm,假设As、B原子相切,则B原子的半径为
您最近一年使用:0次
2023-03-14更新
|
1068次组卷
|
2卷引用:四川省宜宾市第四中学校2022-2023学年高二下学期4月月考化学试题
解题方法
6 . 根据信息回答下列问题:
Ⅰ.元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出10种元素的电负性:
已知:两成键元素间电负性差值大于1.7时,形成离子键;两成键元素间电负性差值小于1.7时,形成共价键。
(1)通过分析电负性的变化规律,确定 元素电负性的最小范围
元素电负性的最小范围_______ 。
(2)判断下列物质是离子化合物还是共价化合物:
A. B.
B. C.
C. D.SiC
D.SiC
①属于共价化合物的是_______ (填字母)。
② 易与水反应生成生成一种刺激性气味的气体,写出反应的化学方程式
易与水反应生成生成一种刺激性气味的气体,写出反应的化学方程式_______ 。
(3) 溶液在实验室里可以用来制备
溶液在实验室里可以用来制备 ,写出制备
,写出制备 的离子方程式
的离子方程式_______ 。
Ⅱ.元素原子的第一电离能 随原子序数呈周期性变化,请回答:
随原子序数呈周期性变化,请回答:
(4) 的第一电离能小于
的第一电离能小于 ,从原子结构的角度解释其原因
,从原子结构的角度解释其原因_______ 。
(5)与 同一周期,第一电离能最大的元素是
同一周期,第一电离能最大的元素是_______ (写名称)。
Ⅰ.元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出10种元素的电负性:
| 元素 |  |  |  | C |  |  |  | N |  | O | H |
| 电负性 | 1.5 | 1.5 | 2.5 | 3.0 | 0.9 | 1.0 | 3.0 | 1.8 | 3.5 | 2.1 |
(1)通过分析电负性的变化规律,确定
 元素电负性的最小范围
元素电负性的最小范围(2)判断下列物质是离子化合物还是共价化合物:
A.
 B.
B. C.
C. D.SiC
D.SiC①属于共价化合物的是
②
 易与水反应生成生成一种刺激性气味的气体,写出反应的化学方程式
易与水反应生成生成一种刺激性气味的气体,写出反应的化学方程式(3)
 溶液在实验室里可以用来制备
溶液在实验室里可以用来制备 ,写出制备
,写出制备 的离子方程式
的离子方程式Ⅱ.元素原子的第一电离能
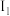 随原子序数呈周期性变化,请回答:
随原子序数呈周期性变化,请回答:(4)
 的第一电离能小于
的第一电离能小于 ,从原子结构的角度解释其原因
,从原子结构的角度解释其原因(5)与
 同一周期,第一电离能最大的元素是
同一周期,第一电离能最大的元素是
您最近一年使用:0次
解题方法
7 . 完成下列问题。
(1)基态铬的核外电子排布式是:_______ ,其在周期表中的位置是_______ 。
(2) 可以形成的一种配合物是
可以形成的一种配合物是 ,
,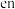 表示的是
表示的是 。其中
。其中 的VSEPR模型为
的VSEPR模型为_______ ,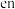 分子中,各元素的电负性由大到小的顺序为
分子中,各元素的电负性由大到小的顺序为_______ 。
(3)在极性分子中,正电荷重心和负电荷重心间的距离称为偶极长,用d表示。极性分子的极性强弱和偶极长,电荷重心的电量q有关,用偶极矩μ衡量,其定义为μ=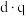 。
。
①请写出一种μ=0的分子_______ 。
②对硝基氯苯,邻硝基氯苯,间硝基氯苯三种分子的偶极矩由大到小的顺序为_______ 。
③治癌药物 有平面四边形结构,
有平面四边形结构, 位于四边形的中心,
位于四边形的中心, 和
和 位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为
位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为_______ 。
(4)铁有δ、γ、α三种晶体,以下为这三种晶体在不同温度下转化的图示。
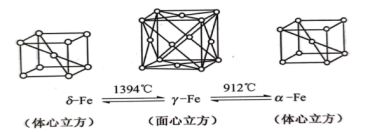
①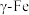 晶体中
晶体中 原子的配位数是
原子的配位数是_______ 。
②若 晶胞边长为a,
晶胞边长为a,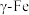 晶胞边长为b,则这两种晶体的密度比为
晶胞边长为b,则这两种晶体的密度比为_______ 。
(1)基态铬的核外电子排布式是:
(2)
 可以形成的一种配合物是
可以形成的一种配合物是 ,
,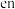 表示的是
表示的是 。其中
。其中 的VSEPR模型为
的VSEPR模型为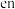 分子中,各元素的电负性由大到小的顺序为
分子中,各元素的电负性由大到小的顺序为(3)在极性分子中,正电荷重心和负电荷重心间的距离称为偶极长,用d表示。极性分子的极性强弱和偶极长,电荷重心的电量q有关,用偶极矩μ衡量,其定义为μ=
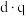 。
。①请写出一种μ=0的分子
②对硝基氯苯,邻硝基氯苯,间硝基氯苯三种分子的偶极矩由大到小的顺序为
③治癌药物
 有平面四边形结构,
有平面四边形结构, 位于四边形的中心,
位于四边形的中心, 和
和 位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为
位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为(4)铁有δ、γ、α三种晶体,以下为这三种晶体在不同温度下转化的图示。

①
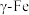 晶体中
晶体中 原子的配位数是
原子的配位数是②若
 晶胞边长为a,
晶胞边长为a,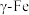 晶胞边长为b,则这两种晶体的密度比为
晶胞边长为b,则这两种晶体的密度比为
您最近一年使用:0次
解题方法
8 . 我国科学家及其合作团队研究发现,六方相(hcp)Fe—H、Fe—C和Fe—O合金在地球内核温压下转变成超离子态。该研究表明地球内核并非传统认知的固态,而是由固态铁和流动的轻元素组成的超离子态。请用所学知识回答下列问题:
(1)基态铁原子最外层电子所在能级的电子云轮廓图为_______ 形。
(2)H、C、O三种元素的电负性由大到小的排序为_______ (填元素符号)。
(3)锰和铁处于同一周期,锰、铁电离能数据如表所示:
请解释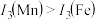 的主要原因:
的主要原因:_______ 。
(4)H、C,O三种元素可以组成很多种物质。
① 、
、 、
、 、
、 、
、 中属于非极性分子的有
中属于非极性分子的有_______ (填化学式),其中 的立体构型为
的立体构型为_______ 。
②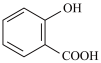 的沸点
的沸点_______ (填“大于”、“小于”或“等于”)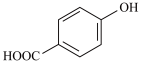 的沸点。
的沸点。
(5)用X射线衍射仪测定发现铁晶体有两种晶胞结构,如图1、图2所示。
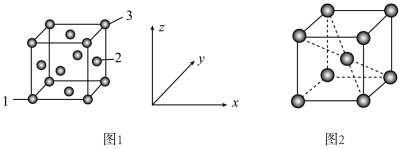
①原子坐标参数可以描述晶胞内部各微粒的相对位置。设图1中1号原子的坐标参数为(0,0,0),3号原子的坐标参数为(1,1,1),则2号原子的坐标参数为_______ 。
②若图2中晶胞参数为apm,设 为阿伏加德罗常数的值,则晶体的密度为
为阿伏加德罗常数的值,则晶体的密度为_______ (用含a、 的代数式表示)
的代数式表示) 。
。
(1)基态铁原子最外层电子所在能级的电子云轮廓图为
(2)H、C、O三种元素的电负性由大到小的排序为
(3)锰和铁处于同一周期,锰、铁电离能数据如表所示:
| 元素 | 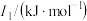 |  |  |
| Mn | 717.3 | 1509.9 | 3248 |
| Fe | 762.5 | 1561.9 | 2953 |
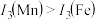 的主要原因:
的主要原因:(4)H、C,O三种元素可以组成很多种物质。
①
 、
、 、
、 、
、 、
、 中属于非极性分子的有
中属于非极性分子的有 的立体构型为
的立体构型为②
 的沸点
的沸点 的沸点。
的沸点。(5)用X射线衍射仪测定发现铁晶体有两种晶胞结构,如图1、图2所示。

①原子坐标参数可以描述晶胞内部各微粒的相对位置。设图1中1号原子的坐标参数为(0,0,0),3号原子的坐标参数为(1,1,1),则2号原子的坐标参数为
②若图2中晶胞参数为apm,设
 为阿伏加德罗常数的值,则晶体的密度为
为阿伏加德罗常数的值,则晶体的密度为 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
解题方法
9 . 我国科学家及其合作团队研究发现,六方相(hep)Fe—H、Fe—C和Fe—O合金在地球内核温压下转变成超离子态。该研究表明地球内核并非传统认知的固态,而是由固态铁和流动的轻元素组成的超离子态。请用所学知识回答下列问题:
(1)基态铁原子最外层电子所在能级的电子云轮廓图为_______ 形。
(2)H、C、O三种元素的电负性由大到小的排序为_______ (填元素符号)。
(3)锰和铁处于同一周期,锰、铁电离能数据如表所示:
请解释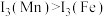 的主要原因:
的主要原因:_______ 。
(4)H、C、O三种元素可以组成很多种物质。
① 、
、 、
、 、
、 、
、 中属于非极性分子的有
中属于非极性分子的有_______ (填化学式)。
② 的沸点
的沸点_______ (填“大于”、“小于”或“等于”)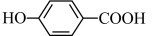 的沸点。
的沸点。
(5)用X射线衍射仪测定发现铁晶体有两种晶胞结构,如图1、图2所示。
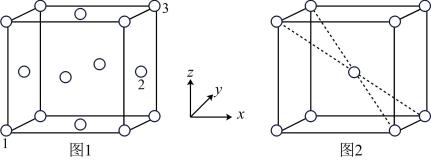
①原子坐标参数可以描述晶胞内部各微粒的相对位置。设图1中1号原子的坐标参数为(0,0,0),3号原子的坐标参数为(1,1,1),则2号原子的坐标参数为_______ 。
②若图2中晶胞参数为apm,则该晶胞的空间利用率(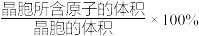 )为
)为_______ (用含π的式子表示)%。
(1)基态铁原子最外层电子所在能级的电子云轮廓图为
(2)H、C、O三种元素的电负性由大到小的排序为
(3)锰和铁处于同一周期,锰、铁电离能数据如表所示:
| 元素 | 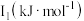 |  | 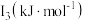 |
| Mn | 717.3 | 1509.9 | 3248 |
| Fe | 762.5 | 1561.9 | 2953 |
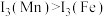 的主要原因:
的主要原因:(4)H、C、O三种元素可以组成很多种物质。
①
 、
、 、
、 、
、 、
、 中属于非极性分子的有
中属于非极性分子的有②
 的沸点
的沸点 的沸点。
的沸点。(5)用X射线衍射仪测定发现铁晶体有两种晶胞结构,如图1、图2所示。

①原子坐标参数可以描述晶胞内部各微粒的相对位置。设图1中1号原子的坐标参数为(0,0,0),3号原子的坐标参数为(1,1,1),则2号原子的坐标参数为
②若图2中晶胞参数为apm,则该晶胞的空间利用率(
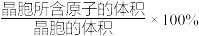 )为
)为
您最近一年使用:0次
2022-07-06更新
|
243次组卷
|
2卷引用:广东省清远市2021-2022学年高二下学期期末考试化学试题
2022高三·全国·专题练习
10 . 以 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
(1)基态O原子的电子排布式_______ ,其中未成对电子有_______ 个。
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是_______ 。
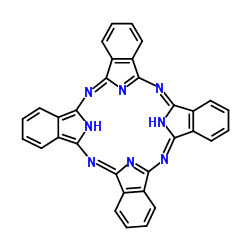
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。邻苯二甲酸酐( )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(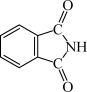 )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是_______ 。
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为_______ 。
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是_______ 。
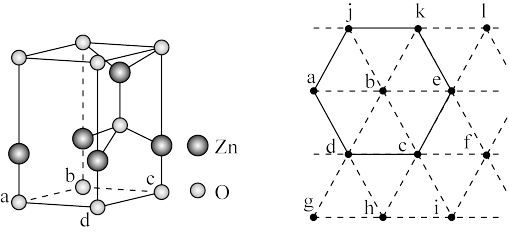
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面_______ 、_______ 。
 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:(1)基态O原子的电子排布式
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。
 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
您最近一年使用:0次
2022-07-04更新
|
9227次组卷
|
11卷引用:第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)
(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)【知识图鉴】单元讲练测选择性必修2第三章03单元测(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编2022年海南省高考真题化学试题(已下线)2022年海南省高考真题变式题15-19山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题(已下线)热点情景汇编-专题十四 结构性质中的新材料(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)



