名校
解题方法
1 . H、C、N、O、Na、Mg、Cl、Cu是8种中学化学中常见的元素。
(1)原子结构与元素性质
① 5种元素H、C、N、O、Na中,电负性最大的是___________ 。
② 3种元素Na、Mg、Cl中,原子半径最大的是___________ 。
③ 基态Cu的价电子排布式为___________ 。
(2)微粒间相互作用与物质性质
① 下列物质的分子中同时存在σ键和π键的是___________ (填字母)。
a.H2 b.N2 c.Cl2 d.NH3
② NH3分子与酸反应形成NH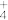 的原因是
的原因是___________ 。
③ 相同条件下,SO2在水中的溶解度大于CO2的,理由是___________ 。
(3)不同聚集状态的物质与性质___________ 。
②金属钠能导电的原因是___________ 。
③NaCl、NaBr、NaI中,熔点最高的是___________ 。
④ 金刚石和石墨是碳的两种常见单质,下列叙述正确的是___________ (填字母)。
a.金刚石和石墨都是共价晶体
b.晶体中共价键的键角:金刚石>石墨
c.金刚石中碳原子杂化类型为sp3杂化,石墨中碳原子杂化类型为sp2杂化
(1)原子结构与元素性质
① 5种元素H、C、N、O、Na中,电负性最大的是
② 3种元素Na、Mg、Cl中,原子半径最大的是
③ 基态Cu的价电子排布式为
(2)微粒间相互作用与物质性质
① 下列物质的分子中同时存在σ键和π键的是
a.H2 b.N2 c.Cl2 d.NH3
② NH3分子与酸反应形成NH
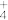 的原因是
的原因是③ 相同条件下,SO2在水中的溶解度大于CO2的,理由是
(3)不同聚集状态的物质与性质
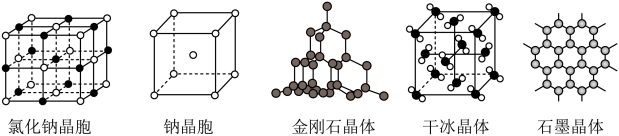
②金属钠能导电的原因是
③NaCl、NaBr、NaI中,熔点最高的是
④ 金刚石和石墨是碳的两种常见单质,下列叙述正确的是
a.金刚石和石墨都是共价晶体
b.晶体中共价键的键角:金刚石>石墨
c.金刚石中碳原子杂化类型为sp3杂化,石墨中碳原子杂化类型为sp2杂化
您最近一年使用:0次
名校
解题方法
2 . 乙酸苯酯是重要的药物中间体,它可以转化得到邻羟基苯乙酮和对羟基苯乙酮的混合物。一种制备乙酸苯酯的原理为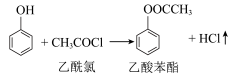 ,利用如图装置制备并提纯乙酸苯酯。
,利用如图装置制备并提纯乙酸苯酯。

已知所用试剂的部分物理性质如表所示:
| 物质 | 相对分子质量 | 部分物理性质 |
| 苯酚 | 94 | 常温下,纯净的苯酚是无色晶体,沸点为181.7℃,溶于水、乙醇,易溶于乙醚等有机溶剂 |
| 乙酰氯 | 78.5 | 常温下为无色发烟液体,沸点为52℃,溶于丙酮、乙醚等有机溶剂 |
| 乙酸苯酯 | 136 | 常温下为无色液体,沸点为195.5℃,微溶于水,可混溶于醇、氯仿、醚等有机溶剂 |
| 环己烷 | 84 | 常温下为无色有刺激性气味的液体,沸点为80.7℃,不溶于水,溶于乙醚、乙醇等有机溶剂 |
(1)仪器甲的名称为
(2)该原理制备乙酸苯酯的反应类型为
(3)其他条件相同,控制反应温度,不同温度下得到的乙酸苯酯的产率如表所示,选择表中
温度/℃ | 10 | 15 | 20 | 25 | 30 |
产率/% | 68.51 | 83.34 | 95.55 | 92.68 | 91.82 |
(4)实验结束后,进一步提纯乙酸苯酯的方法为
(5)在最佳温度下反应,最终得到乙酸苯酯的质量为
您最近一年使用:0次
昨日更新
|
9次组卷
|
2卷引用:河北省邢台市邢襄联盟2023-2024学年高二下学期5月第三次月考化学试题
3 . 铜、硫及其化合物在工业中用途广泛。请回答下列问题:
(1)基态铜原子的核外电子排布式为___________ 。
(2)硫酰氟 常温常压下为无色气体,固态
常温常压下为无色气体,固态 的晶体类型为
的晶体类型为___________ ,其F-S-F键角___________ (填“>”或“<”)硫酰氯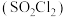 中的
中的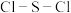 键角。
键角。
(3)硫酸四氨合铜晶体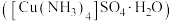 常用作杀虫剂、媒染剂。实验室制备
常用作杀虫剂、媒染剂。实验室制备 的流程如下:
的流程如下:
①写出过程 发生反应的离子方程式
发生反应的离子方程式___________ 。
②过程c加入 乙醇的作用是
乙醇的作用是___________ 。
③根据 的现象,写出
的现象,写出 与
与 结合由弱到强的顺序
结合由弱到强的顺序___________ 。
(4)硫化铜的立方晶胞结构如图所示,已知 与
与 的核间距最小为
的核间距最小为 ,则该晶胞的棱长=
,则该晶胞的棱长=___________  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态铜原子的核外电子排布式为
(2)硫酰氟
 常温常压下为无色气体,固态
常温常压下为无色气体,固态 的晶体类型为
的晶体类型为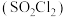 中的
中的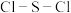 键角。
键角。(3)硫酸四氨合铜晶体
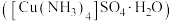 常用作杀虫剂、媒染剂。实验室制备
常用作杀虫剂、媒染剂。实验室制备 的流程如下:
的流程如下: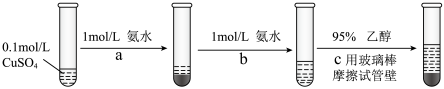
①写出过程
 发生反应的离子方程式
发生反应的离子方程式②过程c加入
 乙醇的作用是
乙醇的作用是③根据
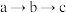 的现象,写出
的现象,写出 与
与 结合由弱到强的顺序
结合由弱到强的顺序(4)硫化铜的立方晶胞结构如图所示,已知
 与
与 的核间距最小为
的核间距最小为 ,则该晶胞的棱长=
,则该晶胞的棱长= (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
4 .  是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)Co位于元素周期表第___________ 周期第___________ 族,Co位于元素周期表___________ 区。
(2)烧渣是LiCl、 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因___________ 。
(3)鉴别洗净的“滤饼3”和固体 常用方法的名称是
常用方法的名称是___________ 。
(4)已知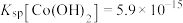 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为___________  。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为___________ 。
(5)导致 比
比 易水解的因素有
易水解的因素有___________ (填标号)。
a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)Co位于元素周期表第
(2)烧渣是LiCl、
 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因(3)鉴别洗净的“滤饼3”和固体
 常用方法的名称是
常用方法的名称是(4)已知
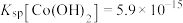 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为 。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为(5)导致
 比
比 易水解的因素有
易水解的因素有a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
您最近一年使用:0次
名校
解题方法
5 . 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(MgxFe2-xSiO4)。回答下列问题:
(1)基态Fe原子的价电子排布式为___________ 。橄榄石中,各元素电负性大小顺序为___________ ,铁的化合价为___________ 。
(2)已知一些物质的熔点数据如下表:
①Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4,原因是___________ 。
②分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因___________ 。
③SiCl4的空间结构为___________ ,其中Si的轨道杂化形式为___________ 。
(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,________ 个Mg,该物质化学式为_________ ,B-B最近距离为___________ 。
(1)基态Fe原子的价电子排布式为
(2)已知一些物质的熔点数据如下表:
| 物质 | NaCl | SiCl4 | GeCl4 | SnCl4 |
| 熔点/℃ | 800.7 | -68.8 | -51.5 | -34.1 |
②分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因
③SiCl4的空间结构为
(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,
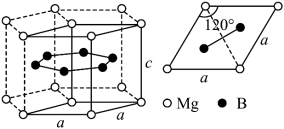
您最近一年使用:0次
名校
6 . 近日,科学家们开发了一类水溶性有机储能小分子(M),并提出在电池充放电过程中实现电化学碳捕获一体化,其反应装置与原理如图所示。
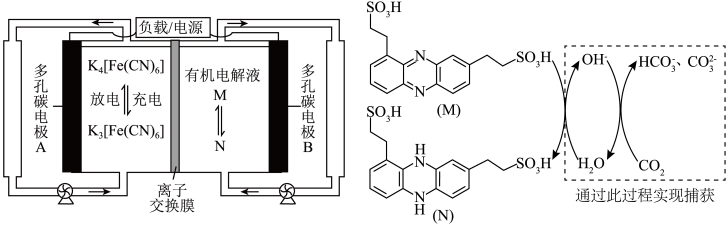
| A.放电时,A电极为负极 |
B.充电时电极B发生的反应为: |
| C.该电池应采用阴离子交换膜 |
D.充电时,外电路通过2mole-,理论上该电池最多能够捕获标况下 |
您最近一年使用:0次
7 . 恒容密闭容器中充入X,在催化剂作用下发生反应: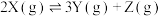 ,起始压强为p kPa,反应时间为t s,测得X的转化率随温度变化如图中实线所示,虚线表示X平衡转化率。下列说法正确的是
,起始压强为p kPa,反应时间为t s,测得X的转化率随温度变化如图中实线所示,虚线表示X平衡转化率。下列说法正确的是
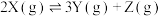 ,起始压强为p kPa,反应时间为t s,测得X的转化率随温度变化如图中实线所示,虚线表示X平衡转化率。下列说法正确的是
,起始压强为p kPa,反应时间为t s,测得X的转化率随温度变化如图中实线所示,虚线表示X平衡转化率。下列说法正确的是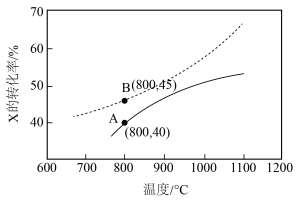
| A.该反应的ΔH<0 |
| B.催化剂可降低该反应的焓变,但不能提高平衡转化率 |
| C.通过延长反应时间,X的转化率能从A点交到B点 |
D.800℃时,A点物质X在0~t s内化学反应速率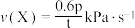 |
您最近一年使用:0次
8 . 下列比较中不正确的是
| A.键角:CH4>NH3>H2O |
| B.键的极性:N-H键<O-H键<F-H键 |
| C.酸性:CH2ClCOOH>CCl3COOH |
D.沸点: |
您最近一年使用:0次
9 . 硫酸铝是一种具有广泛用途的重要化工产品,以高岭土(含 、
、 、少量
、少量 等)为原料制备硫酸铝晶体[
等)为原料制备硫酸铝晶体[ ]的实验流程如图所示。
]的实验流程如图所示。
(1)为加快酸溶速率,可采取的措施_______ (写出一条,合理即可)。
(2)滤渣1经过处理可作为制备水玻璃( 水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式
水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式_______ 。
(3)加入试剂除铁前,滤液1中的阳离子除了 、
、 外还有的阳离子是
外还有的阳离子是_______ (填离子符号)。滤渣2主要成分为 ,由于条件控制不当,常使
,由于条件控制不当,常使 中混有
中混有 影响其回收利用,用离子方程式表示除去
影响其回收利用,用离子方程式表示除去 的原理
的原理_______ 。
(4)向滤液1中加入的试剂可以是 ,试结合平衡移动原理说明其原因
,试结合平衡移动原理说明其原因_______ 。
(5)已知常温时:Ksp[Fe(OH)3] =1×10-37.4、Kw=1×10-14;当溶液中Fe3+浓度低于10-5mol/L时即认为Fe3+沉淀完全,实验中为确保Fe3+完全沉淀需控制PH不低于_______ (保留小数点一位)。
(6)某兴趣小组为了测定晶体中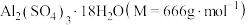 的质量分数,进行如下实验:
的质量分数,进行如下实验:
①准确称取1.00g晶体样品,溶于一定量水中;
②滴入 EDTA溶液,与
EDTA溶液,与 反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与
反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与 以物质的量之比1:1反应,假设杂质不与EDTA反应)。
以物质的量之比1:1反应,假设杂质不与EDTA反应)。
则晶体中 的质量分数是
的质量分数是_______ 。
 、
、 、少量
、少量 等)为原料制备硫酸铝晶体[
等)为原料制备硫酸铝晶体[ ]的实验流程如图所示。
]的实验流程如图所示。
(1)为加快酸溶速率,可采取的措施
(2)滤渣1经过处理可作为制备水玻璃(
 水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式
水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式(3)加入试剂除铁前,滤液1中的阳离子除了
 、
、 外还有的阳离子是
外还有的阳离子是 ,由于条件控制不当,常使
,由于条件控制不当,常使 中混有
中混有 影响其回收利用,用离子方程式表示除去
影响其回收利用,用离子方程式表示除去 的原理
的原理(4)向滤液1中加入的试剂可以是
 ,试结合平衡移动原理说明其原因
,试结合平衡移动原理说明其原因(5)已知常温时:Ksp[Fe(OH)3] =1×10-37.4、Kw=1×10-14;当溶液中Fe3+浓度低于10-5mol/L时即认为Fe3+沉淀完全,实验中为确保Fe3+完全沉淀需控制PH不低于
(6)某兴趣小组为了测定晶体中
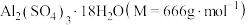 的质量分数,进行如下实验:
的质量分数,进行如下实验:①准确称取1.00g晶体样品,溶于一定量水中;
②滴入
 EDTA溶液,与
EDTA溶液,与 反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与
反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与 以物质的量之比1:1反应,假设杂质不与EDTA反应)。
以物质的量之比1:1反应,假设杂质不与EDTA反应)。则晶体中
 的质量分数是
的质量分数是
您最近一年使用:0次
名校
解题方法
10 . 设NA阿伏加德罗常数的值下列说法正确 的是
A.常温下,1mol硝酸铵溶于稀氨水使溶液呈中性,则NH 数目为NA 数目为NA |
| B.在过氧化钠与水的反应中,每生成0.1mol O2,转移电子的数目为0.4NA |
| C.1mol乙二酸(H2C2O4)分子中π键的数目为3NA |
| D.室温下,pH=12的Na2CO3溶液中,由水电离出的OH-数目为0.01NA |
您最近一年使用:0次



