名校
1 . 下列说法正确的是
| A.元素C、N、O的第一电离能由大到小的顺序为O>N>C |
B. 中电负性最小的元素是N 中电负性最小的元素是N |
C.基态 的价电子排布式为 的价电子排布式为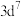 |
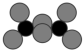
D. 的键角为120°, 的键角为120°, 的键角为120° 的键角为120° |
您最近一年使用:0次
2 . 氮、氧、磷、砷及其化合物在工农业生产等方面有着重要应用。请按要求回答下列问题。
(1)电负性P_______ As(填“>”或“<”或“=”)。
(2)尿素(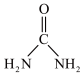 )中碳原子杂化类型
)中碳原子杂化类型_______ ; 离子的立体构型名称(即空间构型)为
离子的立体构型名称(即空间构型)为_______ 。
(3)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是_______ 。
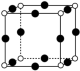
(4)我国的“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。已知砷化镓的熔点为1238℃,GaAs的晶胞结构如图所示。_______ ,As与Ga之间存在的化学键有_______ (填字母)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
②1号镓原子的坐标为_______ 。晶胞密度为dg∙cm-3,摩尔质量为Mg∙mol-1 ,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为_______ nm(列式表示)。
(1)电负性P
(2)尿素(
 )中碳原子杂化类型
)中碳原子杂化类型 离子的立体构型名称(即空间构型)为
离子的立体构型名称(即空间构型)为(3)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是
(4)我国的“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。已知砷化镓的熔点为1238℃,GaAs的晶胞结构如图所示。
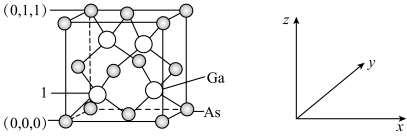
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
②1号镓原子的坐标为
您最近一年使用:0次
名校
解题方法
3 . 铜是常见的、用途广泛的金属元素之一、
(1)基态Cu原子核外未成对电子所在的原子轨道是_______ 。
(2)一价铜离子某配合物的结构如图所示:_______ 。
②上述配合物中所含元素电负性由大到小的顺序为_______ (用元素符号表示)。
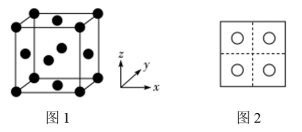
(3)常见的铜的氧化物有CuO和 两种。已知:CuO晶胞中
两种。已知:CuO晶胞中 的位置如图1所示;两种晶胞中
的位置如图1所示;两种晶胞中 和
和 的位置相同,其在晶胞侧视图中的位置相同(如图2),假设两种晶胞的参数相同,CuO晶体的密度是
的位置相同,其在晶胞侧视图中的位置相同(如图2),假设两种晶胞的参数相同,CuO晶体的密度是 。
。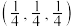 、
、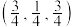 、
、_______ 和_______ 。
② 晶体的密度是
晶体的密度是_______  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态Cu原子核外未成对电子所在的原子轨道是
(2)一价铜离子某配合物的结构如图所示:

②上述配合物中所含元素电负性由大到小的顺序为
(3)常见的铜的氧化物有CuO和
 两种。已知:CuO晶胞中
两种。已知:CuO晶胞中 的位置如图1所示;两种晶胞中
的位置如图1所示;两种晶胞中 和
和 的位置相同,其在晶胞侧视图中的位置相同(如图2),假设两种晶胞的参数相同,CuO晶体的密度是
的位置相同,其在晶胞侧视图中的位置相同(如图2),假设两种晶胞的参数相同,CuO晶体的密度是 。
。
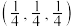 、
、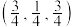 、
、②
 晶体的密度是
晶体的密度是 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
4 . 含硒(Se)化合物在材料药物领域有重要应用。
(1)Se与S同族,基态Se原子的简化电子排布式为___________ ,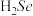 的沸点高于
的沸点高于 ,原因是
,原因是___________ 。
(2)一种含硒的新型 (聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(3)硒的两种含氧酸的酸性强弱为
___________  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠 可减轻重金属铊(
可减轻重金属铊( )引起的中毒,
)引起的中毒, 的空间结构为
的空间结构为___________ 。
(4)铊( )与
)与 同族,第一电离能
同族,第一电离能
___________  (填“>”或“<”)。
(填“>”或“<”)。
(5)根据下表中元素的电负性数值判断, 为
为___________ (填“离子化合物”或“共价化合物”,下同), 为
为___________ 。
(6)气态 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中
的形式存在,其空间结构如图a所示,二聚体中 的轨道杂化类型为
的轨道杂化类型为___________ 。 结构如图b所示,若晶胞参数(立方体棱长)为
结构如图b所示,若晶胞参数(立方体棱长)为 ,则晶体密度
,则晶体密度
___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Se与S同族,基态Se原子的简化电子排布式为
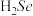 的沸点高于
的沸点高于 ,原因是
,原因是(2)一种含硒的新型
 (聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。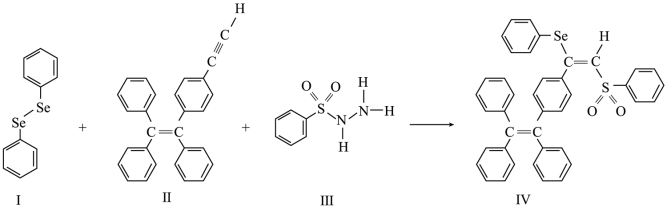
A.Ⅰ中含有两种元素, 键为非极性键 键为非极性键 |
B.Ⅱ中C原子的杂化轨道类型有 与 与 |
| C.Ⅲ中含有的元素中,O的电负性最大 |
D.Ⅳ中 原子的杂化轨道类型为 原子的杂化轨道类型为 |
(3)硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠 可减轻重金属铊(
可减轻重金属铊( )引起的中毒,
)引起的中毒, 的空间结构为
的空间结构为(4)铊(
 )与
)与 同族,第一电离能
同族,第一电离能
 (填“>”或“<”)。
(填“>”或“<”)。(5)根据下表中元素的电负性数值判断,
 为
为 为
为| 元素 | F |  |  |
| 电负性 | 4.0 | 1.5 | 3.0 |
(6)气态
 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中
的形式存在,其空间结构如图a所示,二聚体中 的轨道杂化类型为
的轨道杂化类型为 结构如图b所示,若晶胞参数(立方体棱长)为
结构如图b所示,若晶胞参数(立方体棱长)为 ,则晶体密度
,则晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
|
|
| 图a | 图b |
您最近一年使用:0次
名校
解题方法
5 . X、Y、Z、M、Q、R是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如表所示:
回答下列问题。
(1)X与Q的电负性大小顺序为___________ (用元素符号表示)。
(2)Y元素基态原子的简化电子排布式为___________ ;R元素基态原子的价层电子轨道表示式为___________ 。
(3)R元素可形成 和
和 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是___________ 。
(4)Y、Z的电负性较大的是___________ (填元素符号)。
(5)与M元素成对角线规则关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物对应的水化物反应的离子方程式:___________ 。
| 元素 | 相关信息 |
| X | 原子核外有6种不同运动状态的电子 |
| Y | 基态原子中s电子总数与p电子总数相等 |
| Z | 原子半径在同周期主族元素中最大 |
| M | 逐级电离能(单位: )依次为578、1817、2745、11575、14830、18376、23293 )依次为578、1817、2745、11575、14830、18376、23293 |
| Q | 基态原子的核外电子占据5个能级,且最外层p轨道上有2个电子的自旋方向与其他电子的自旋方向相反 |
| R | 基态原子3d能级上有6个电子 |
(1)X与Q的电负性大小顺序为
(2)Y元素基态原子的简化电子排布式为
(3)R元素可形成
 和
和 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是(4)Y、Z的电负性较大的是
(5)与M元素成对角线规则关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物对应的水化物反应的离子方程式:
您最近一年使用:0次
名校
解题方法
6 . 学习化学一定要领悟好问题情景。
(1)①书写以下各微粒的电子式。
—OH___________ ,HBrO___________ ,CS2___________ ,NH4H___________ ;
②用电子式表示Na和S形成Na2S的过程___________ 。
(2)氮元素的化合物种类繁多,性质也各不相同。请回答下列问题:
已知:①N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1
③N2(g)+3H2(g)=2NH3(g)ΔH=-92.4kJ·mol-1
则反应:④4NH3(g)+5O2(g)=4NO(g)+6H2O(g)的ΔH=___________ kJ·mol-1。
(3)电负性与原子所处的具体的化学环境紧密相关。有机化合物CH3I和CF3I发生水解时的主要反应分别是:CH3I+H2O→CH3OH+HI和CF₃I+H₂O→CF3H+HIO。从电负性的角度分析,为什么CF3I水解的产物不是HI的原因___________ 。
(4)工业上用Na2SO3吸收尾气中SO2使之转化为NaHSO3,再以SO2为原料设计原电池,然后电解(惰性电极)NaHSO3制取H2SO4,装置如下:
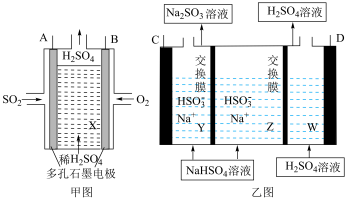
①甲图中A电极上的反应式为___________ 。
②甲图中B与乙图___________ (填“C”或“D”)极相连,进行电解时乙图Z中Na+向___________ (填“Y”或“W”)中移动。
③该电解池阴极的电极反应式为___________ ;
(5)Ni可活化C2H6放出CH4,其反应历程如下图所示:

下列关于活化历程的说法错误的是
(1)①书写以下各微粒的电子式。
—OH
②用电子式表示Na和S形成Na2S的过程
(2)氮元素的化合物种类繁多,性质也各不相同。请回答下列问题:
已知:①N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1
③N2(g)+3H2(g)=2NH3(g)ΔH=-92.4kJ·mol-1
则反应:④4NH3(g)+5O2(g)=4NO(g)+6H2O(g)的ΔH=
(3)电负性与原子所处的具体的化学环境紧密相关。有机化合物CH3I和CF3I发生水解时的主要反应分别是:CH3I+H2O→CH3OH+HI和CF₃I+H₂O→CF3H+HIO。从电负性的角度分析,为什么CF3I水解的产物不是HI的原因
(4)工业上用Na2SO3吸收尾气中SO2使之转化为NaHSO3,再以SO2为原料设计原电池,然后电解(惰性电极)NaHSO3制取H2SO4,装置如下:

①甲图中A电极上的反应式为
②甲图中B与乙图
③该电解池阴极的电极反应式为
(5)Ni可活化C2H6放出CH4,其反应历程如下图所示:

下列关于活化历程的说法错误的是
| A.活化能最大的步骤:中间体2→中间体3 |
| B.只涉及极性键的断裂和生成 |
| C.在此反应过程中Ni的成键数目发生变化 |
D.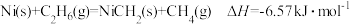 |
您最近一年使用:0次
解题方法
7 . 我国化学家研究发现,十八胺在较高温度下具有一定的还原性,由于不同的金属盐从十八胺中获得电子的能力不同,在十八胺体系中反应可以得到不同的产物:当以两种非贵金属盐为原料时得到混合金属氧化物(如 等),以
等),以 和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如
和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如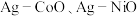 等),除
等),除 之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如
之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如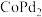 等)。
等)。
回答下列问题:
(1)十八胺中含有氮元素,含氮元素的三种离子 的键角由大到小的顺序是
的键角由大到小的顺序是___________ 。
(2) 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是___________ 。
(3)以 和钴盐为原料时得到的产物
和钴盐为原料时得到的产物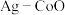 而非
而非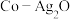 的原因是
的原因是___________ 。
(4)推测 盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为
盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为___________ 。
(5)一种含钴的离子结构如图所示: 的价电子轨道表示式是
的价电子轨道表示式是___________ 。已知磁矩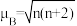 (n表示未成对电子数),则
(n表示未成对电子数),则 的磁矩
的磁矩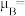
___________ 。
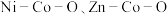 等),以
等),以 和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如
和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如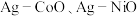 等),除
等),除 之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如
之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如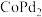 等)。
等)。
| 元素 |  |  |  |  |  |  |  |
| 电负性(鲍林标度) | 1.6 | 1.8 | 1.8 | 1.9 | 2.2 | 2.2 | 2.4 |
(1)十八胺中含有氮元素,含氮元素的三种离子
 的键角由大到小的顺序是
的键角由大到小的顺序是(2)
 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是(3)以
 和钴盐为原料时得到的产物
和钴盐为原料时得到的产物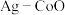 而非
而非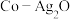 的原因是
的原因是(4)推测
 盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为
盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为(5)一种含钴的离子结构如图所示:
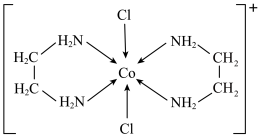
 的价电子轨道表示式是
的价电子轨道表示式是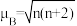 (n表示未成对电子数),则
(n表示未成对电子数),则 的磁矩
的磁矩
您最近一年使用:0次
名校
解题方法
8 . 我国是世界上最早制得和使用金属锌的国家,锌在人类生产生活中有重要应用。回答下列问题:
I. 一种 Zn2+配合物广泛应用于催化剂,光导体,光动力疗法,其结构如图所示:
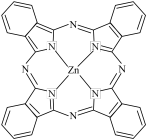
(1)Zn2+价电子轨道表示式为__________ 。
(2)该配合物中电负性最大的元素是__________ 。
(3)下列状态的氮中,电离最外层一个电子所需能量最大的是__________。(填序号)
(4)该配合物中 C 的轨道杂化类型为__________ 。
(5)该配合物中 Zn2+的配位数为__________ 个。
Ⅱ. ZnS 常用作分析试剂、荧光体、白色颜料等。
(6)ZnS 常见有 2 种晶胞结构如下图:立方晶胞(左图)和六方晶胞(右图)。
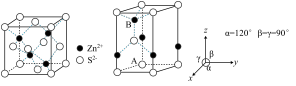
下列说法错误的是__________。(填序号)
(7)立方 ZnS 中,若 Zn2+与 S2-最短距离为 a nm,则晶胞密度ρ=__________ g·cm-3(列出计算式,阿伏加德罗常数的值为 NA)。
I. 一种 Zn2+配合物广泛应用于催化剂,光导体,光动力疗法,其结构如图所示:

(1)Zn2+价电子轨道表示式为
(2)该配合物中电负性最大的元素是
(3)下列状态的氮中,电离最外层一个电子所需能量最大的是__________。(填序号)
| A.[He]2s22p3 | B.[He]2s22p2 |
| C.[He]2s22p23s1 | D.[He]2s22p13s1 |
(5)该配合物中 Zn2+的配位数为
Ⅱ. ZnS 常用作分析试剂、荧光体、白色颜料等。
(6)ZnS 常见有 2 种晶胞结构如下图:立方晶胞(左图)和六方晶胞(右图)。

下列说法错误的是__________。(填序号)
| A.立方 ZnS 中与 S2—最近的 S2—有 12 个 | B.两种晶胞中 Zn2+的个数都为4 |
| C.立方 ZnS 中 S2—的配位数为 4 | D.可用 X—射线衍射实验鉴别六方 ZnS 是否属于晶体 |
您最近一年使用:0次
名校
解题方法
9 .  在催化剂作用下,与水反应生成
在催化剂作用下,与水反应生成 的前2步可能机理为:
的前2步可能机理为:
第1步: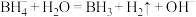
第2步:
……完成下列填空:
(1)已知电负性: 。
。 中B的化合价为
中B的化合价为_______ 。第1步反应的氧化产物是_______ ,(填化学式或离子符号)。
(2) 的分子空间构型是
的分子空间构型是_______ , 中B原子的杂化类型是
中B原子的杂化类型是_______ 。比较 与
与 的键角:
的键角:
_______ 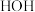 (填“>”、“<”或“=”),其原因是:
(填“>”、“<”或“=”),其原因是:_______ 。
(3)上述机理的第3、4步与第2步类似,最终生成 。用化学方程式表示第3步的机理:
。用化学方程式表示第3步的机理:_______ 。写出 的结构式:
的结构式:_______ 。根据上述机理, 与
与 反应时,所得气体产物为
反应时,所得气体产物为_______ (填写化学式)。
(4) 分子中B原子与三个O原子构成平面三角形,则B原子的杂化类型是
分子中B原子与三个O原子构成平面三角形,则B原子的杂化类型是_______ 。
(5) 溶液中存在平衡:
溶液中存在平衡: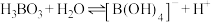 。下列叙述正确的是
。下列叙述正确的是
 在催化剂作用下,与水反应生成
在催化剂作用下,与水反应生成 的前2步可能机理为:
的前2步可能机理为:第1步:
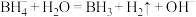
第2步:

……完成下列填空:
(1)已知电负性:
 。
。 中B的化合价为
中B的化合价为(2)
 的分子空间构型是
的分子空间构型是 中B原子的杂化类型是
中B原子的杂化类型是 与
与 的键角:
的键角:
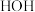 (填“>”、“<”或“=”),其原因是:
(填“>”、“<”或“=”),其原因是:(3)上述机理的第3、4步与第2步类似,最终生成
 。用化学方程式表示第3步的机理:
。用化学方程式表示第3步的机理: 的结构式:
的结构式: 与
与 反应时,所得气体产物为
反应时,所得气体产物为(4)
 分子中B原子与三个O原子构成平面三角形,则B原子的杂化类型是
分子中B原子与三个O原子构成平面三角形,则B原子的杂化类型是(5)
 溶液中存在平衡:
溶液中存在平衡: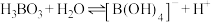 。下列叙述正确的是
。下列叙述正确的是A. 的水溶液显酸性 的水溶液显酸性 |
B.B原子杂化轨道中s轨道的成分: 大于 大于 |
| C.上述反应的2种反应物分子中,所有原子都达到8电子构型 |
D. 溶液中还可能存在 溶液中还可能存在 、 、 等系列微粒 等系列微粒 |
您最近一年使用:0次
名校
解题方法
10 . 生产、生活和科技发展离不开化学。请回答下列问题:
(1)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。
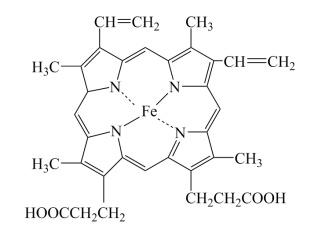
①基态Fe原子的价电子排布图为___________ ,Fe2+核外电子有___________ 种空间运动状态。
②血红素中各非金属元素的电负性由小到大的顺序为___________ 。
③Fe2+与邻二氮菲(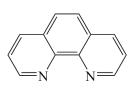 )等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:
)等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:___________ ;若OH-浓度高,OH-又会与Fe2+作用,同邻二氮菲形成竞争。
④卟琳是含有平面共轭大环结构的有机分子材料,具有独特的电子结构和光物理性质,卟琳分子结构如图,N原子的杂化轨道类型相同,采取___________ 杂化。
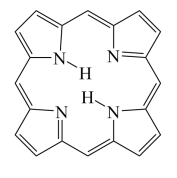
(2)立方砷化硼(BAs)在理论上具有比硅更好的导热性,以及更高的双极性迁移率,有潜力成为比硅更优良的半导体材料。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,立方砷化硼晶胞结构如图所示。As位于元素周期表的___________ 区,找出距离As(0.25,0.25,0.25)最近的As___________ (用分数坐标表示)。
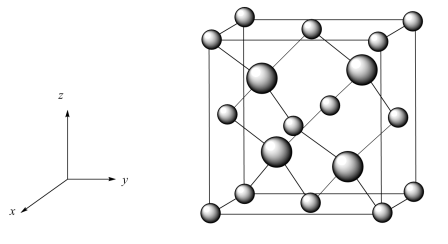
②已知晶体密度为ag·cm-3,As半径为bpm,假设As、B原子相切,则B原子的半径为___________ pm(列出计算式)。
(1)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。

①基态Fe原子的价电子排布图为
②血红素中各非金属元素的电负性由小到大的顺序为
③Fe2+与邻二氮菲(
 )等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:
)等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:④卟琳是含有平面共轭大环结构的有机分子材料,具有独特的电子结构和光物理性质,卟琳分子结构如图,N原子的杂化轨道类型相同,采取

(2)立方砷化硼(BAs)在理论上具有比硅更好的导热性,以及更高的双极性迁移率,有潜力成为比硅更优良的半导体材料。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,立方砷化硼晶胞结构如图所示。As位于元素周期表的

②已知晶体密度为ag·cm-3,As半径为bpm,假设As、B原子相切,则B原子的半径为
您最近一年使用:0次
2023-03-14更新
|
1048次组卷
|
2卷引用:四川省宜宾市第四中学校2022-2023学年高二下学期4月月考化学试题