名校
解题方法
1 .  (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度( 350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、
350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、 与
与 进行合成。
进行合成。
1.上述涉及的元素H、B、C、N、O原子半径最大的是___________ ,电负性最大的是___________ 。
2.键角:
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”),原因是
”),原因是___________ 。
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度( 350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、
350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、 与
与 进行合成。
进行合成。1.上述涉及的元素H、B、C、N、O原子半径最大的是
2.键角:

 (填“
(填“ ”“
”“ ”或“
”或“ ”),原因是
”),原因是
您最近一年使用:0次
2 . 第ⅣA族元素及其化合物在生产、生活中应用广泛。回答下列问题:
(1)基态锗原子的价层电子轨道表示式为______ ,第ⅣA族元素位于______ 区。
(2) 的电负性比
的电负性比 大,其主要原因是
大,其主要原因是_________________ 。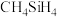 、
、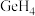 的稳定性依次减弱,其主要原因是
的稳定性依次减弱,其主要原因是______________________ 。
(3) 的VSEPR模型名称为
的VSEPR模型名称为________________________________ 。
(4)碳化硅( )熔点为2700°C,常作砂轮磨料,用于切割金属。由此推知,碳化硅晶体类型为
)熔点为2700°C,常作砂轮磨料,用于切割金属。由此推知,碳化硅晶体类型为______ 。
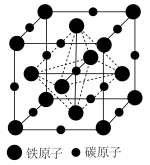
(5)铁和碳能形成如图所示的晶胞。它可以看成是铁晶胞中插入若干个碳原子,晶胞体积不变。铁碳晶体的化学式为______ ,铁晶体转化为铁碳晶体时晶体密度净增______ %(结果保留3位有效数字)。
(1)基态锗原子的价层电子轨道表示式为
(2)
 的电负性比
的电负性比 大,其主要原因是
大,其主要原因是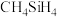 、
、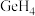 的稳定性依次减弱,其主要原因是
的稳定性依次减弱,其主要原因是(3)
 的VSEPR模型名称为
的VSEPR模型名称为(4)碳化硅(
 )熔点为2700°C,常作砂轮磨料,用于切割金属。由此推知,碳化硅晶体类型为
)熔点为2700°C,常作砂轮磨料,用于切割金属。由此推知,碳化硅晶体类型为(5)铁和碳能形成如图所示的晶胞。它可以看成是铁晶胞中插入若干个碳原子,晶胞体积不变。铁碳晶体的化学式为
您最近一年使用:0次
名校
3 . 用化学知识解答问题:
(1)铜器在潮湿的空气中,表面会慢慢地生成一层铜锈(碱式碳酸铜),该反应的化学方程式为___________ 。
(2)在日常生活中常用一些铝制器皿,在清洗铝制器皿表面的污垢时,不能使用热的碱性溶液的原因时(用化学方程式解释)___________ 。
(3)发射卫星的火箭用联氨( )作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,该反应的化学方程式为
)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,该反应的化学方程式为___________ 。
(4)比较甲酸、乙酸、丙酸的酸性大小,并解释原因___________
(5)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
比较两元素的 、
、 可知,气态
可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,对此你的解释是
再失去1个电子难,对此你的解释是___________ 。
(1)铜器在潮湿的空气中,表面会慢慢地生成一层铜锈(碱式碳酸铜),该反应的化学方程式为
(2)在日常生活中常用一些铝制器皿,在清洗铝制器皿表面的污垢时,不能使用热的碱性溶液的原因时(用化学方程式解释)
(3)发射卫星的火箭用联氨(
 )作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,该反应的化学方程式为
)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,该反应的化学方程式为(4)比较甲酸、乙酸、丙酸的酸性大小,并解释原因
(5)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
| 元素 | Mn | Fe | |
电离能/ |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 | |
 、
、 可知,气态
可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,对此你的解释是
再失去1个电子难,对此你的解释是
您最近一年使用:0次
2023-08-19更新
|
126次组卷
|
2卷引用:河北省昌黎第一中学2023届高三下学期第五次调研考试化学试题
名校
解题方法
4 . 材料的发展水平始终是时代进步和人类文明的标志。当前含铁的磁性材料在国防、电子信息等领域中具有广泛应用。请回答下列问题:
(1)基态铁原子的价电子排布图为_______ ,基态铁原子核外电子的空间运动状态有_______ 种, 其处在最高能层的电子的电子云形状为_______ 。
(2)一种新研发出的铁磁性材料M的分子结构如图1所示。
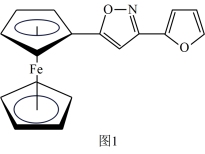
①M分子中C、N、O三种元素的电负性由大到小的顺序为_______ 。
②M分子中的Fe2+与上下两个五元碳环通过配位键相连且Fe2+共提供了6个杂化轨道,则铁原子最可能的杂化方式为_______ (填序号)。
A. sp2 B. sp3 C. dsp2 D.d2sp3
③分子中的大π键可用符号π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ), 则M分子中由碳、氧组成的五元环中的大π键应表示为
), 则M分子中由碳、氧组成的五元环中的大π键应表示为_______ 。
(3)铁氮化合物因其特殊的组成和结构而具有优异的铁磁性能,某铁氮化合物的立方晶胞结构如图2所示。

①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为_______ 。
②该化合物的化学式为_______ ,若晶胞中距离最近的铁原子和氮原子的距离为apm,阿伏加德罗常数的值为NA,则该晶胞的密度为_______ g·cm-3 (列出计算式即可)。
(1)基态铁原子的价电子排布图为
(2)一种新研发出的铁磁性材料M的分子结构如图1所示。

①M分子中C、N、O三种元素的电负性由大到小的顺序为
②M分子中的Fe2+与上下两个五元碳环通过配位键相连且Fe2+共提供了6个杂化轨道,则铁原子最可能的杂化方式为
A. sp2 B. sp3 C. dsp2 D.d2sp3
③分子中的大π键可用符号π
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ), 则M分子中由碳、氧组成的五元环中的大π键应表示为
), 则M分子中由碳、氧组成的五元环中的大π键应表示为(3)铁氮化合物因其特殊的组成和结构而具有优异的铁磁性能,某铁氮化合物的立方晶胞结构如图2所示。

①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为
②该化合物的化学式为
您最近一年使用:0次
2022-05-31更新
|
918次组卷
|
5卷引用:内蒙古自治区赤峰市2022届高三下学期4月模拟考试理综合化学试题
内蒙古自治区赤峰市2022届高三下学期4月模拟考试理综合化学试题(已下线)易错点13 原子结构与核外电子排布-备战2023年高考化学考试易错题(已下线)第十二章 物质结构与性质(测)-2023年高考化学一轮复习讲练测(全国通用)河南省郑州市六校联盟2022-2023学年高二下学期4月期中考试化学试题湖北省武汉市武钢三中2023-2024学年高二下学期3月月考化学试题
5 . 三草酸合铁酸钾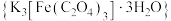 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解:
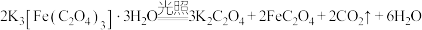 。回答下列问题:
。回答下列问题:
(1)基态 原子的电子排布式为
原子的电子排布式为___________ ,基态 与
与 中未成对电子的数目之比为
中未成对电子的数目之比为___________ 。
(2)三草酸合铁酸钾所含元素中,第一电离能最大的是___________ (填元素符号,下同),电负性最大的是___________ 。
(3)1个 与1个
与1个 分子中
分子中 键数目之比为
键数目之比为___________ , 分子的立体构型为
分子的立体构型为___________ 。
(4)金刚石的晶胞结构如图所示,碳原子分别位于顶点、面心和体内。

若图中原子1的坐标为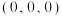 ,则原子2的坐标为
,则原子2的坐标为___________ 。
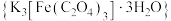 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解: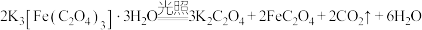 。回答下列问题:
。回答下列问题:(1)基态
 原子的电子排布式为
原子的电子排布式为 与
与 中未成对电子的数目之比为
中未成对电子的数目之比为(2)三草酸合铁酸钾所含元素中,第一电离能最大的是
(3)1个
 与1个
与1个 分子中
分子中 键数目之比为
键数目之比为 分子的立体构型为
分子的立体构型为(4)金刚石的晶胞结构如图所示,碳原子分别位于顶点、面心和体内。

若图中原子1的坐标为
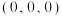 ,则原子2的坐标为
,则原子2的坐标为
您最近一年使用:0次
2022-05-09更新
|
515次组卷
|
3卷引用:福建省莆田市2022届高三下学期第三次质量检测化学试题
福建省莆田市2022届高三下学期第三次质量检测化学试题山西省怀仁市大地中学高中部2021-2022学年高二下学期第三次月考化学试题(已下线)第十二章 物质结构与性质(测)-2023年高考化学一轮复习讲练测(全国通用)
6 . 研究K、Ca、Fe、As、T等第四周期元素对生产、生活有重要意义。回答下列问题:
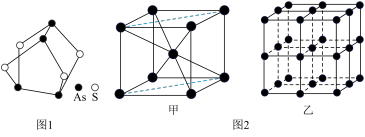
(1)我国中医把雄黄作为解毒剂,用来治疗癣疥、中风等。雄黄的结构如图1.雄黄分子中孤电子对数与成键电子对数之比为___ ,砷酸常用于制备颜料、砷酸盐、杀虫剂等,则AsO 的空间构型是
的空间构型是___ 。
(2)已知KCl、MgO、CaO、TiN的晶体于NaCl的晶体结构相似,且三种离子晶体的晶格能数据如表所示。
①Ti3+的电子排布式为___ 。
②KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为___ ,原因是___ 。
(3)Fe的一种晶体结构如图2甲、乙所示,若按甲虚线方向切割乙,得到的截面图中正确的是___ 。(填字母标号)假设铁原子的半径是rcm,铁的相对原子质量为M,则该晶体的密度为___ g/cm3。(列式即可,设阿伏加 德罗常数的值为NA)


(1)我国中医把雄黄作为解毒剂,用来治疗癣疥、中风等。雄黄的结构如图1.雄黄分子中孤电子对数与成键电子对数之比为
 的空间构型是
的空间构型是(2)已知KCl、MgO、CaO、TiN的晶体于NaCl的晶体结构相似,且三种离子晶体的晶格能数据如表所示。
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
①Ti3+的电子排布式为
②KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为
(3)Fe的一种晶体结构如图2甲、乙所示,若按甲虚线方向切割乙,得到的截面图中正确的是

您最近一年使用:0次
名校
解题方法
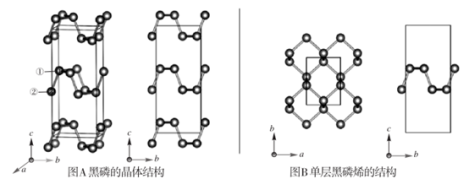
7 . 黑磷是磷的一种稳定的同素异形体,黑磷具有正交晶系的晶体结构(图A),晶胞参数a=3.310A,b=4.380A,c=10.500A。黑磷烯是二维的单层黑磷(图B),黑磷烯与石墨烯结构相似,P的配位数为3。与石墨烯相比,黑磷烯具有半导体性质,更适合于制作电子器件。已知黑磷结构中只有一种等效的三配位P,所有P原子的成键环境一样,图A中编号为①的P原子的晶胞内坐标为(0.50,0.090,0.598)。请回答下列问题:
(1)写出P原子的价电子排布:___ 。
(2)P和F的电负性大小顺序是X(P)___ X(F)。(填“<”“=”或“>”)P和F形成的分子PF3和PF5,它们的几何构型分别为__ 、__ 。
(3)①黑磷中P原子杂化类型是__ 。黑磷中不存在__ (选填字母序号)。
A.共价键 B.σ键 C.π键 D.范德华力
②红磷、白磷与黑磷熔点从高到低的顺序为__ ,原因是__ 。
(4)图A中编号为②的P原子的晶胞内坐标为__ ,黑磷的晶胞中含有__ 个P原子。

(1)写出P原子的价电子排布:
(2)P和F的电负性大小顺序是X(P)
(3)①黑磷中P原子杂化类型是
A.共价键 B.σ键 C.π键 D.范德华力
②红磷、白磷与黑磷熔点从高到低的顺序为
(4)图A中编号为②的P原子的晶胞内坐标为
您最近一年使用:0次
2020-07-13更新
|
233次组卷
|
2卷引用:江西省吉安、抚州、赣州市2020届高三一模理科综合化学试题
8 . 铁及其化合物在生产、生活中有广泛应用。
(1)铁原子核外有__________ 种运动状态不同的电子,Fe3+基态核外电子排布式为_______________ 。
(2)实验室常用K3[Fe(CN)6]检验Fe2+,[Fe(CN)6]3-中三种元素电负性由大到小的顺序为________ (用元素符号表示),CN-中σ键与π键的数目比n(σ)∶n(π)=__________ ;HCN中C原子轨道的杂化类型为__________ 。HCN的沸点为25.7℃,既远大于N2的沸点(-195.8℃)也大于HCl的沸点(-85℃)的原因是__________ 。
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(Fe2Cl6)存在,该双聚分子的结构式为________ ,其中Fe的配位数为_____________ 。
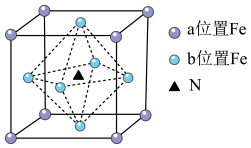
(4)铁氮化合物(Fe4N)在磁记录材料领域有着广泛的应用前景,其晶胞如上图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中b位置Fe原子的坐标为(0, ,
, )、(
)、( ,0,
,0, )和(
)和( ,
, ,0),则a位置Fe原子和N原子的坐标分别为
,0),则a位置Fe原子和N原子的坐标分别为__________ 、__________ 。N与Fe原子之间最短距离a pm。设阿伏加 德罗常数的值为NA,则该铁氮化合物的密度是__________ g·cm-3(列出计算表达式)。
(1)铁原子核外有
(2)实验室常用K3[Fe(CN)6]检验Fe2+,[Fe(CN)6]3-中三种元素电负性由大到小的顺序为
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(Fe2Cl6)存在,该双聚分子的结构式为

(4)铁氮化合物(Fe4N)在磁记录材料领域有着广泛的应用前景,其晶胞如上图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中b位置Fe原子的坐标为(0,
 ,
, )、(
)、( ,0,
,0, )和(
)和( ,
, ,0),则a位置Fe原子和N原子的坐标分别为
,0),则a位置Fe原子和N原子的坐标分别为
您最近一年使用:0次
名校
解题方法
9 . 铬、钼 、钨
、钨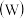 都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
 铬元素的最高化合价为
铬元素的最高化合价为________ ;基态钼原子的核外电子排布类似于基态铬原子,其原子核外有________ 个未成对电子。
 钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
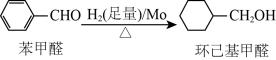
 环己基甲醇分子中采取
环己基甲醇分子中采取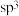 杂化的原子是
杂化的原子是________  写元素符号
写元素符号 。
。
 环己基甲醇的沸点高于苯甲醛,其原因是
环己基甲醇的沸点高于苯甲醛,其原因是________ 。
 铬离子
铬离子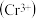 能形成多种配合物,例如
能形成多种配合物,例如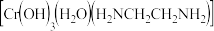 。
。
 已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,
已知配合物的中心粒子的配位数指配位原子总数。上述配合物中, 的配位数为
的配位数为________ 。
 上述配合物中的非金属元素按电负性由小到大的顺序排列为
上述配合物中的非金属元素按电负性由小到大的顺序排列为________ 。
 铬的一种氧化物的晶胞结构如图所示。
铬的一种氧化物的晶胞结构如图所示。
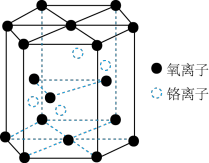
 该氧化物的化学式为
该氧化物的化学式为________ 。
 已知晶胞底面的边长为acm,晶胞的高为bcm,
已知晶胞底面的边长为acm,晶胞的高为bcm, 代表阿伏加 德罗常数的值,该铬的氧化物的摩尔质量为
代表阿伏加 德罗常数的值,该铬的氧化物的摩尔质量为 。该晶体的密度为
。该晶体的密度为________  用含a、b、
用含a、b、 和M的代数式表示
和M的代数式表示 。
。
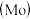 、钨
、钨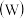 都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。 铬元素的最高化合价为
铬元素的最高化合价为 钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
 环己基甲醇分子中采取
环己基甲醇分子中采取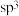 杂化的原子是
杂化的原子是 写元素符号
写元素符号 。
。 环己基甲醇的沸点高于苯甲醛,其原因是
环己基甲醇的沸点高于苯甲醛,其原因是 铬离子
铬离子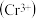 能形成多种配合物,例如
能形成多种配合物,例如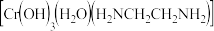 。
。 已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,
已知配合物的中心粒子的配位数指配位原子总数。上述配合物中, 的配位数为
的配位数为 上述配合物中的非金属元素按电负性由小到大的顺序排列为
上述配合物中的非金属元素按电负性由小到大的顺序排列为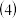 铬的一种氧化物的晶胞结构如图所示。
铬的一种氧化物的晶胞结构如图所示。
 该氧化物的化学式为
该氧化物的化学式为 已知晶胞底面的边长为acm,晶胞的高为bcm,
已知晶胞底面的边长为acm,晶胞的高为bcm, 代表阿伏加 德罗常数的值,该铬的氧化物的摩尔质量为
代表阿伏加 德罗常数的值,该铬的氧化物的摩尔质量为 。该晶体的密度为
。该晶体的密度为 用含a、b、
用含a、b、 和M的代数式表示
和M的代数式表示 。
。
您最近一年使用:0次
2020-02-03更新
|
740次组卷
|
5卷引用:2020届全国II卷高考化学模拟卷(三)
10 . [化学——选修3:物质结构与性质]
技术人员晒制蓝图时,用K3Fe(C2O4)3]·H2O(三草酸合铁酸钾)作感光剂,再以K3[Fe(CN)6]氰合铁酸钾)溶液作显影剂。请回答以下问题:
(1)铁元素在周期表中位置为___________ ,Fe3+的基态价电子排布图为___________ 。
(2)在上述两种钾盐中第一电离能最大的元素为___________ ,电负性最小的元素为___________ 。
(3)H2C2O4分子中碳原子的杂化类型是___________ ,与C2O42-互为等电子体的分子的化学式为___________ (写一种)。
(4)在分析化学中F-常用于Fe3+的掩蔽剂,因为生成的FeF63-十分稳定,但Fe3+却不能与I-形成配合物,其原因是______________________ (用离子方程式来表示)。
(5)已知C60分子结构和C60晶胞如右图所示:
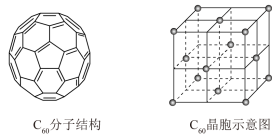
①1个C60分子中含有π键的数目为___________ 。
②晶胞中C60的配位数为___________ 。
③已知C60晶胞参数为apm,则该晶胞密度的表达式是___________ g·cm-3(NA代表阿伏伽德罗常数)。
技术人员晒制蓝图时,用K3Fe(C2O4)3]·H2O(三草酸合铁酸钾)作感光剂,再以K3[Fe(CN)6]氰合铁酸钾)溶液作显影剂。请回答以下问题:
(1)铁元素在周期表中位置为
(2)在上述两种钾盐中第一电离能最大的元素为
(3)H2C2O4分子中碳原子的杂化类型是
(4)在分析化学中F-常用于Fe3+的掩蔽剂,因为生成的FeF63-十分稳定,但Fe3+却不能与I-形成配合物,其原因是
(5)已知C60分子结构和C60晶胞如右图所示:

①1个C60分子中含有π键的数目为
②晶胞中C60的配位数为
③已知C60晶胞参数为apm,则该晶胞密度的表达式是
您最近一年使用:0次
2019-02-17更新
|
1202次组卷
|
2卷引用:【校级联考】安徽省合肥一中、马鞍山二中等六校教育研究会2019届高三下学期第二次联考理科综合化学试题



