名校
解题方法
1 . 如图为周期表的一小部分,A、B、C、D、E的位置关系如图所示。其中B元素最高化合价是最低化合价绝对值的3倍,它的最高价氧化物中含氧60%。下列说法正确的是( )
| A | ||
| D | B | E |
| C |
| A.D、B、E三种元素的第一电离能逐渐减小 |
| B.电负性:E>C |
| C.D、B、E三种元素形成的简单离子的半径逐渐增大 |
| D.气态氢化物的稳定性顺序:D>B>E |
您最近一年使用:0次
2020-06-09更新
|
342次组卷
|
9卷引用:陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题
陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题天津市耀华中学2022-2023学年高二上学期期末考试化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 B素养拓展区四川省西充中学 2021-2022 学年高二上学期期中考试化学试题专题2 原子结构与元素性质 第二单元 元素性质的递变规律 第2课时 元素第一电离能和电负性的周期性变化福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(1卷)试题2.2.2元素第一电离能和电负性的周期性变化 课后湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题
名校
2 . 下列说法正确的是( )
| A.原子半径:P<S<Cl |
| B.电负性:C<N<O |
| C.热稳定性:HF<HCl<HBr |
| D.第一电离能:Na<Mg<Al |
您最近一年使用:0次
2020-05-19更新
|
413次组卷
|
6卷引用:天津市红桥区2020届高三下学期居家学习线上检测第一次模拟化学试题
解题方法
3 . 已知M、N两种元素分别位于s区、p区,下列说法中错误 的是
| A.基态时,N原子的最外电子层上的电子数一定比M原子的多 |
| B.N元素的电负性不一定比M元素的大 |
| C.由M、N两种元素所形成的化合物中,N一定显负价 |
| D.若M、N原子的电子层数相同,则原子半径:M > N |
您最近一年使用:0次
4 . 下列说法正确的是
| A.化学键既存在于相邻原子之间,又存在于相邻分子之间 |
| B.HF、HCl、HBr、HI的热稳定性依次减弱 |
| C.电负性越大,非金属性越强,第一电离能也越大 |
| D.碳碳双键的键能是碳碳单键键能的2倍 |
您最近一年使用:0次
2020-05-11更新
|
112次组卷
|
2卷引用:天津市河北区2020届高三总复习质量检测(一)(一模)化学试题
名校
5 . 如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
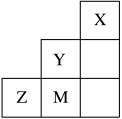

| A.电负性:Z>M>Y |
| B.离子半径:M->Z2->Y- |
| C.ZM2分子中各原子的最外层均满足8电子稳定结构 |
D.Z元素基态原子最外层电子轨道表示式为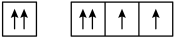 |
您最近一年使用:0次
2020-05-06更新
|
414次组卷
|
9卷引用:天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题
天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题2014-2015宁夏回族自治区银川一中高二上学期期末考试化学试卷人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质2四川省蓬溪县蓬南中学2019-2020学年高二上学期第四次月考化学试题云南省普洱市墨江县民族学校2019—2020学年高二上学期期末考试化学试题2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择提升专练】四川省成都外国语学校2019-2020学年高二下学期开学考试化学试题四川省邛崃市高埂中学2019-2020学年度高二下学期期中考试化学试题广西蒙山县第一中学2018-2019学年高二下学期第二次月考化学试题
6 . 氢、氮、氯、铜是元素周期表中前四周期元素。回答下列问题:
(1)铜在元素周期表中的位置__ ,写出NH3的电子式__ 。
(2)氯与硫相比,非金属性较强的是__ (用元素符号表示),下列事实能证明这一结论的是__ 。(填序号)。
a.常温下氯的单质呈气态,硫的单质呈固态
b.稳定性:HCl>H2S
c.酸性:HClO4>H2SO4
d.氯的电负性大于硫的电负性
(3)含氮化合物(CH3)3N与盐酸反应,离子方程式为:(CH3)3N+H+=[(CH3)3NH]+,该反应过程中新生成的化学键为___ (填序号)。
a.离子键 b.配位键 c.氢键 d.非极性共价键
若化合物(CH3)3N能溶于水,其可能的原因是___ 。
(4)Cu与H元素形成某种晶体的结构如图所示,则该晶体的化学式为__ ,若该晶体的密度为ρ g•cm-3,阿伏加 德罗常数的值为NA,则该晶胞的棱长为__ nm(用含ρ和NA的式子表示,已知1nm=10-7cm)。

(1)铜在元素周期表中的位置
(2)氯与硫相比,非金属性较强的是
a.常温下氯的单质呈气态,硫的单质呈固态
b.稳定性:HCl>H2S
c.酸性:HClO4>H2SO4
d.氯的电负性大于硫的电负性
(3)含氮化合物(CH3)3N与盐酸反应,离子方程式为:(CH3)3N+H+=[(CH3)3NH]+,该反应过程中新生成的化学键为
a.离子键 b.配位键 c.氢键 d.非极性共价键
若化合物(CH3)3N能溶于水,其可能的原因是
(4)Cu与H元素形成某种晶体的结构如图所示,则该晶体的化学式为

您最近一年使用:0次
名校
解题方法
7 . 氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。
(1)砷(As)在元素周期表中的位置为____________________ ,磷的基态原子的价电子排布式为__________ ,六种元素中电负性最大的是__________ (填元素符号)。
(2)N2分子中σ键和π键的数目比N(σ): N(π)=__________ 。NH3的分子构型为__________ ,中心原子的杂化方式为__________ 。
(3)热稳定性:NH3_____ PH3(填“>”或“<”),沸点:N2H4______ P2H4(填“>”或“<”)。
(4)已知:P(s,白磷)=P(s,黑磷)ΔH=-39.3kJ·mol-1;P(s,白磷)=P(s,红磷)ΔH=-17.6kJ·mol-1
由此推知,其中最稳定的磷单质是__________ 。
(5)SbCl3能发生较强烈的水解,生成难溶的SbOCl,因此配制SbCl3溶液应加入__________ 。
(1)砷(As)在元素周期表中的位置为
(2)N2分子中σ键和π键的数目比N(σ): N(π)=
(3)热稳定性:NH3
(4)已知:P(s,白磷)=P(s,黑磷)ΔH=-39.3kJ·mol-1;P(s,白磷)=P(s,红磷)ΔH=-17.6kJ·mol-1
由此推知,其中最稳定的磷单质是
(5)SbCl3能发生较强烈的水解,生成难溶的SbOCl,因此配制SbCl3溶液应加入
您最近一年使用:0次
名校
8 . 关于如图结构的说法不正确的是( )
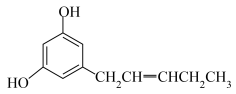

A.分子中既有 键又有π键 键又有π键 |
| B.碳原子有sp、sp2、sp3三种杂化方式 |
| C.O—H键的极性强于C-H键的极性 |
| D.羟基中氧原子采取sp3杂化,VSEPR模型为四面体形 |
您最近一年使用:0次
2019-06-26更新
|
696次组卷
|
8卷引用:天津市耀华中学2021届高三上学期第一次月考化学试题
名校
9 . 下列各组元素性质的递变情况错误的是
| A.Li、Be、B原子的最外层电子数依次增多 |
| B.P、S、Cl元素的最高化合价依次升高 |
| C.N、O、F电负性依次增大 |
| D.Na、K、Rb第一电离能逐渐增大 |
您最近一年使用:0次
2018-02-10更新
|
682次组卷
|
12卷引用:人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质2
人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质2河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:1.2 原子结构与元素的性质 第2课时(已下线)2018年11月26日 《每日一题》一轮复习-元素性质的递变规律河北省邢台市第八中学2018-2019学年高二下学期期末考试化学试题福建省平和县第一中学2018-2019学年高二下学期期末考试化学试题(已下线)2019年11月25日 《每日一题》2020年高考化学一轮复习——元素性质的递变规律(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(选择题1-4)陕西省宝鸡市金台区2020-2021学年高二下学期期中考试化学试题陕西省宝鸡市渭滨区2020-2021学年高二下学期期末考试化学试题河南省南阳市六校2021-2022学年高二下学期第一次联考化学试题(B)广东省广州市真光中学2021-2022学年高二下学期3月月考化学试题河北省保定市崇德实验中学2020-2021学年度高二下学期期中考试化学试题
名校
解题方法
10 . 图表法是常用的科学研究方法,下表列出了同周期的四种短周期元素的部分性质(“电负性”即元素对应原子吸引电子能力的标度):
请回答下列问题:
(1)写出E元素的离子结构示意图______________________ ;
(2)X的值应为___________ (填字母);
A.3.6 B.3.1 C.2.1 D.1.4
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系_______________ ;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:__________ (用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:_____________
(6)D、E最高价氧化物对应水化物相互反应的离子方程式:_____________
| 元素编号 | A | B | C | D | E |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 原子半径(单位nm) | 0.099 | 0.102 | 0.110 | 0.143 | 0.186 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
(1)写出E元素的离子结构示意图
(2)X的值应为
A.3.6 B.3.1 C.2.1 D.1.4
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:
(6)D、E最高价氧化物对应水化物相互反应的离子方程式:
您最近一年使用:0次
2016-12-09更新
|
513次组卷
|
5卷引用:2014-2015河南省实验中学高一下学期期中考试化学试卷
2014-2015河南省实验中学高一下学期期中考试化学试卷2016-2017学年山西省太原市外国语学校高一下学期第一次月考化学试卷(已下线)第04章 物质结构 元素周期律(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)天津市耀华中学2022-2023学年高一上学期期末考试化学试题天津市耀华中学2022-2023学年高一上学期期末考试化学试题



