名校
解题方法
1 . 以下有关元素性质的说法正确的是
A.具有下列电子排布式的原子中,① ;② ;②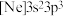 ;③ ;③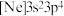 ;④ ;④ ,原子半径最大的是④ ,原子半径最大的是④ |
B.具有下列价电子排布式的原子中,①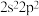 ;② ;②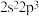 ;③ ;③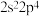 ,第一电离能最大的是① ,第一电离能最大的是① |
| C.①Na、K、Rb;②N、P、As;③O、S、Se;④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ |
D.元素X气态基态原子的逐级电离能(kJ∙mol-1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是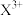 |
您最近一年使用:0次
2022-04-22更新
|
121次组卷
|
2卷引用:陕西省陕西师范大学附属中学2020-2021学年高二下学期期中考试化学试题
名校
解题方法
2 . 下列有关描述正确的是
A.原子半径: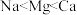 |
B.无机含氧酸的酸性: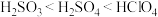 |
C.电负性: |
D.沸点: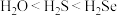 |
您最近一年使用:0次
13-14高二上·江苏泰州·期中
名校
解题方法
3 . 已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10电子分子,B、C处于同一周期,两者可以形成许多种共价化合物,C、F处于同一主族,B原子最外电子层的p能级处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。回答下列问题:
(1)E元素基态原子的电子排布式为____ 。
(2)用电子排布图表示F元素原子的价电子排布:____ 。
(3)F、G元素对应的最高价含氧酸中酸性较强的是____ (填化学式)。
(4)离子半径:D+____ (填“<”“>”或“=”,下同)B3-,第一电离能:B____ C,电负性:C____ F。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为____ 。试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:____ 。
(6)写出E的单质与D的最高价氧化物对应的水化物反应的化学方程式:____ 。
(1)E元素基态原子的电子排布式为
(2)用电子排布图表示F元素原子的价电子排布:
(3)F、G元素对应的最高价含氧酸中酸性较强的是
(4)离子半径:D+
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为
(6)写出E的单质与D的最高价氧化物对应的水化物反应的化学方程式:
您最近一年使用:0次
2022-04-03更新
|
385次组卷
|
11卷引用:陕西省榆林市第十二中学2020-2021学年高二下学期第一次月考化学试题
陕西省榆林市第十二中学2020-2021学年高二下学期第一次月考化学试题陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题(已下线)模块同步卷03 第一章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)(已下线)2013-2014学年江苏省泰州市姜堰区高二上学期期中考试化学试卷人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质1新疆昌吉回族自治州第二中学2019-2020学年高二下学期期中考试化学试题云南省景东彝族自治县第一中学2021-2022学年高二下学期开学考试化学试题云南省曲靖市宣威市第七中学2021-2022学年高二下学期2月考试化学试题云南省玉溪市江川区第一中学2021-2022学年高二下学期3月月考化学试题江苏省苏州市相城区陆慕高级中学2021-2022学年高二下学期第一次月考化学试题广东省四会市四会中学、广信中学2021-2022学年高二下学期第二次考试化学试题
名校
解题方法
4 . W、X、Y、Z、R是五种短周期主族元素,原子序数依次增大。W元素的一种离子与 具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为
具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为 ,X与Z同主族,Z的价电子排布式为3s23p4,下列说法不正确的是
,X与Z同主族,Z的价电子排布式为3s23p4,下列说法不正确的是
 具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为
具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为 ,X与Z同主族,Z的价电子排布式为3s23p4,下列说法不正确的是
,X与Z同主族,Z的价电子排布式为3s23p4,下列说法不正确的是| A.与W生成的气态化合物的热稳定性:Z>Y |
B.W与 的原子半径:W<Li 的原子半径:W<Li |
| C.X和Y的第一电离能:X>Y |
D.X、Z、R的电负性: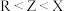 |
您最近一年使用:0次
2022-03-19更新
|
781次组卷
|
11卷引用:陕西省咸阳市实验中学2021-2022学年高二上学期第一次月考化学试题
陕西省咸阳市实验中学2021-2022学年高二上学期第一次月考化学试题山东省泰安市2020-2021学年高二上学期期末考试化学试题(已下线)专题二 原子结构与元素的性质-2020-2021学年高二《新题速递·化学》(人教版选修3)2月刊 (同步课堂必刷题)(已下线)专题二 原子结构与元素的性质-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修2)2月刊 (同步课堂必刷题)辽宁省凤城市第一中学2021-2022学年高二上学期12月月考化学试题(已下线)化学-2022年高考押题预测卷01(江苏卷)第一章原子结构与性质(基础卷) 山东省菏泽第一中学2022-2023学年高二上学期期末考试化学试题江西省宜春市宜丰中学2023-2024学年高二上学期12月月考化学试题广东省江门市广雅中学2023-2024学年高二下学期3月月考化学试题A卷辽宁省七校2023-2024学年高二下学期期初考试化学试卷
名校
5 . 2020年12月17日嫦娥五号返回器带回月球土壤样品。研究发现,月球土壤样品中存在铁、金、银、铅、锌、铜等矿物颗粒。请回答下列问题:
(1)基态Fe原子核外填充有电子的原子轨道数目为___________ ,基态 与
与 中未成对电子数之比为
中未成对电子数之比为___________ 。邻二氮菲(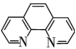 )中N原子可与
)中N原子可与 通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定
通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定 浓度,该反应的适宜pH范围为2~9,试解释若pH<2会产生什么影响
浓度,该反应的适宜pH范围为2~9,试解释若pH<2会产生什么影响___________ 。
(2)Zn在元素周期表中的位置为___________ ,其基态原子的M电子层中电子占据的最高能级是___________ 。
(3)我国科学家研究发现,十八胺在较高温度下具有一定的还原性,由于从十八胺中获得电子的能力不同,不同的金属盐在十八胺体系中反应可以得到不同的产物:
已知元素的电负性数据:
据此推测单一的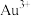 盐在十八胺体系中反应的产物为
盐在十八胺体系中反应的产物为___________ (写化学式)。
(1)基态Fe原子核外填充有电子的原子轨道数目为
 与
与 中未成对电子数之比为
中未成对电子数之比为 )中N原子可与
)中N原子可与 通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定
通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定 浓度,该反应的适宜pH范围为2~9,试解释若pH<2会产生什么影响
浓度,该反应的适宜pH范围为2~9,试解释若pH<2会产生什么影响(2)Zn在元素周期表中的位置为
(3)我国科学家研究发现,十八胺在较高温度下具有一定的还原性,由于从十八胺中获得电子的能力不同,不同的金属盐在十八胺体系中反应可以得到不同的产物:
| 单一金属盐 |  |  |
| 在十八胺体系中的产物 | ZnO | Ag |
| 元素 | Zn | Ag | Au |
| 电负性(鲍林标度) | 1.6 | 1.9 | 2.4 |
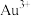 盐在十八胺体系中反应的产物为
盐在十八胺体系中反应的产物为
您最近一年使用:0次
名校
6 . A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型:C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是___________ (填元素符号)
(2)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为___________ ,中心原子的杂化轨道类型为___________ 。
(3)单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为___________ 。
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为___________ ;晶胞中A原子的配位数为___________ ;列式计算晶体F的密度(g·cm-3)___________ 。

(1)四种元素中电负性最大的是
(2)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为
(3)单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为

您最近一年使用:0次
名校
解题方法
7 . 硼材料及含硼化合物的用途非常广泛,如B(C6F5)3可代品Cu催化重氮化合物对杂环分子的修饰、催化吲哚与苯乙炔的区域选择性加成等。回答下列问题:
(1)基态Cu原子的价电子排布式为___________ 。 是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过
是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过___________ 的方法区分晶体与准晶体。
(2)B、C、F的电负性由大到小的顺序为___________ ;Be、B、C是同周期相邻元素,第一电离能: ,这是因为
,这是因为___________ 。
(3)B(C6F5)3分子中所有原子___________ (填“能”或“不能”)处于同一平面。
(4)吲哚(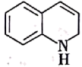 )的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是
)的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是_________ 。
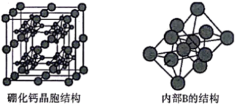
(5)硼化钙的晶胞结构如图所示,晶胞参数为apm,设 为阿伏加德罗常数的值。硼化钙的化学式为
为阿伏加德罗常数的值。硼化钙的化学式为___________ ,其晶体的密度为___________  (列出计算式)。
(列出计算式)。
(1)基态Cu原子的价电子排布式为
 是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过
是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过(2)B、C、F的电负性由大到小的顺序为
 ,这是因为
,这是因为(3)B(C6F5)3分子中所有原子
(4)吲哚(
 )的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是
)的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是(5)硼化钙的晶胞结构如图所示,晶胞参数为apm,设
 为阿伏加德罗常数的值。硼化钙的化学式为
为阿伏加德罗常数的值。硼化钙的化学式为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2021-11-23更新
|
196次组卷
|
3卷引用:陕西省汉中市2021-2022学年高三上学期第三次校级联考(11月)化学试题
名校
解题方法
8 . 臭氧( )在
)在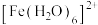 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, ,也可在其他条件下被还原为
,也可在其他条件下被还原为 。
。
(1) 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为___________ ; 的空间构型为
的空间构型为___________ (用文字描述)。
(2)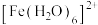 的配位数是
的配位数是___________ 。
(3) 分子中σ键与π键的数目比n(σ):n(π)=
分子中σ键与π键的数目比n(σ):n(π)=___________ 。
(4) 中所含三种元素的第一电离能从大到小的顺序为
中所含三种元素的第一电离能从大到小的顺序为___________ (用元素符号表示,下同),电负性从大到小的顺序为___________ 。
(5)与 分子互为等电子体的一种阴离子为
分子互为等电子体的一种阴离子为___________ (填化学式)。
 )在
)在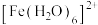 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, ,也可在其他条件下被还原为
,也可在其他条件下被还原为 。
。(1)
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间构型为
的空间构型为(2)
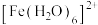 的配位数是
的配位数是(3)
 分子中σ键与π键的数目比n(σ):n(π)=
分子中σ键与π键的数目比n(σ):n(π)=(4)
 中所含三种元素的第一电离能从大到小的顺序为
中所含三种元素的第一电离能从大到小的顺序为(5)与
 分子互为等电子体的一种阴离子为
分子互为等电子体的一种阴离子为
您最近一年使用:0次
9 . 五种前四周期元素X、Y、Z、W、R在周期表中的位置如图所示。下列叙述正确的是


| A.简单氢化物的沸点:W<X |
| B.五种元素均在元素周期表的s区 |
| C.电负性:Y>W>X |
| D.五种元素所形成单质的晶体类型不同 |
您最近一年使用:0次
10 . Fe—Cr—Si系合金是一种新型耐磨耐腐蚀的材料,具有较好的发展前景。按要求回答下列问题。
(1)基态Cr2+与Fe的未成对电子数之比为___ 。试从电子排布角度分析水溶液中Fe2+具有强还原性___ 。若是形成将其转化为(NH4)2Fe(SO4)2,在空气中相对稳定, 的空间构型为
的空间构型为___ 。
(2)由环戊二烯(C5H6,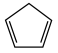 )与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知
)与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知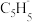 的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为
的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为___ ,结构中的大π键可用符号表示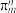 ,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为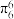 )。则
)。则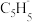 结构中含有的大π键可表示为
结构中含有的大π键可表示为___ 。
(3)某含铬配合物,[Cr3O(CH3COO)6(H2O)3]Cl·8H2O,指出其中Cr的化合价为___ 。几种Cr的卤化物的部分性质如表所示:
试预测CrBr3的熔点范围___ 。
(4)某晶体中含有K+、Ni2+、Fe2+、CN-,其部分微粒在晶胞结构的位置如图所示。1个晶胞中含有CN-___ 个。该物质常用于吸附Cs+,将取代晶胞中的K+,取代后的物质的化学式为___ 。
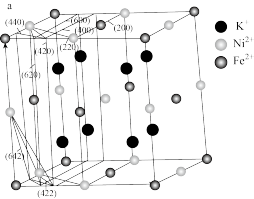
(1)基态Cr2+与Fe的未成对电子数之比为
 的空间构型为
的空间构型为(2)由环戊二烯(C5H6,
 )与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知
)与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知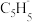 的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为
的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为 ,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。则
)。则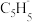 结构中含有的大π键可表示为
结构中含有的大π键可表示为(3)某含铬配合物,[Cr3O(CH3COO)6(H2O)3]Cl·8H2O,指出其中Cr的化合价为
| 卤化物 | CrCl3 | CrBr3 | CrI3 |
| 熔点/℃ | 1150 | 600 |
(4)某晶体中含有K+、Ni2+、Fe2+、CN-,其部分微粒在晶胞结构的位置如图所示。1个晶胞中含有CN-

您最近一年使用:0次



