解题方法
1 . 锂离子电池常用的电极材料是LiCoO2和石墨。
(1)画出基态Co2+离子的价电子排布图________ 。
(2)Co2+与CN-结合形成配合物[Co(CN)6]4-,其中与Co2+结合的C原子的杂化方式是_____ 。
(3)NH3分子与Co2+结合成配合物[Co(NH3)6]2+,与游离的氨分子相比,其键角∠HNH__ (填“较大”,“较小”或“相同”),解释原因______ 。
(4)Li2O的熔点为1570℃,CoO的熔点为1935℃,解释后者熔点更高的主要原因是__ 。
(5)石墨的晶胞为六方晶胞,部分晶胞参数如下图所示。若石墨的密度为d g·cm-3,以NA代表阿伏加 德罗常数的数值,则石墨中的C-C键长为____ pm。
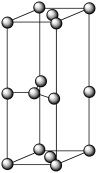
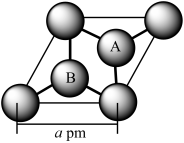
侧视图 俯视图
(1)画出基态Co2+离子的价电子排布图
(2)Co2+与CN-结合形成配合物[Co(CN)6]4-,其中与Co2+结合的C原子的杂化方式是
(3)NH3分子与Co2+结合成配合物[Co(NH3)6]2+,与游离的氨分子相比,其键角∠HNH
(4)Li2O的熔点为1570℃,CoO的熔点为1935℃,解释后者熔点更高的主要原因是
(5)石墨的晶胞为六方晶胞,部分晶胞参数如下图所示。若石墨的密度为d g·cm-3,以NA代表阿伏加 德罗常数的数值,则石墨中的C-C键长为


侧视图 俯视图
您最近一年使用:0次
2020-03-19更新
|
70次组卷
|
2卷引用:陕西省商南县鹿城中学2020届高三第二次模拟考试化学试题
11-12高一下·湖南湘潭·期中
名校
2 . 下列分子中所有原子均满足最外层8电子结构的是( )
| A.LiCl | B.BF3 | C.PCl5 | D.NCl3 |
您最近一年使用:0次
2020-03-17更新
|
119次组卷
|
7卷引用:陕西省渭南市韩城市象山中学2019-2020学年高一下学期第一次月考化学试题
解题方法
3 . 下列说法正确的是( )
| A.HF、HCl、HBr、HI的熔沸点依次升高 |
| B.CH4、XC14都是含有极性键的非极性分子 |
| C.H2O、CO2都是直线形分子 |
| D.氯的各种含氧酸的酸性由强到弱排列为:HClO>HClO2>HClO3>HClO4 |
您最近一年使用:0次
2020-02-12更新
|
153次组卷
|
2卷引用:河南省洛阳市2019-2020学年高二上学期期末考试化学试题
13-14高二下·宁夏银川·期末
4 . 下列有关说法不正确的是
| A.C3H8中碳原子都采用的是sp3杂化 |
| B.O2、CO2、N2都是非极性分子 |
| C.酸性:H2CO3<H3PO4<H2SO4<HClO |
D.CO的一种等电子体为NO+,它的电子式为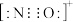 |
您最近一年使用:0次
2020-02-12更新
|
349次组卷
|
14卷引用:2014-2015学年陕西省宝鸡中学高二下学期期末化学试卷A
2014-2015学年陕西省宝鸡中学高二下学期期末化学试卷A(已下线)2013-2014宁夏银川一中高二下学期期末考试化学试卷2014-2015学年宁夏宁大附中高二上学期期中考试化学试卷2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷2015-2016学年贵州省思南中学高二下期中化学试卷2017届湖北省松滋市第一中学高三上学期9月月考化学试卷河北省邢台三中2017-2018学年高二下学期3月月考化学试题2019-2020学年人教版高中化学高考基础复习专题12《物质结构与性质》测试卷2020届高三化学二轮物质结构题型专攻——分子的性质【选择基础专练】山东省聊城市2019-2020学年高三化学一轮复习《物质结构与性质(》模拟测试湖北省利川市第五中学2019年-2020学年高二下学期期末考试化学试题河南省宏力学校2018-2019学年高二下学期期中考试化学试题(已下线)第31讲 分子结构与性质(练) — 2022年高考化学一轮复习讲练测(新教材新高考)新疆乌鲁木齐市第四中学2021-2022学年高二下学期期末考试化学试题
13-14高二下·江苏南通·期中
名校
解题方法
5 . 固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法,不正确的是( )
| A.NH5中既有离子键又有共价键 | B.NH5的熔沸点高于NH3 |
| C.1mol NH5中含有5mol N—H键 | D.NH5固体投入少量水中,可产生两种气体 |
您最近一年使用:0次
2020-02-06更新
|
332次组卷
|
30卷引用:2014-2015学年陕西西北大学附中高二下期末化学试卷
2014-2015学年陕西西北大学附中高二下期末化学试卷(已下线)2014届江苏省启东中学第二学期期中考试高二化学试卷2014-2015学年吉林省松原市扶余县第一中学高二下期末考试化学试卷2015-2016学年浙江省宁波市北仑中学高二下学期期中考试化学试卷2016-2017学年山西省大同市第一中学高二3月月考化学试卷2016-2017学年宁夏育才中学孔德校区高二下学期第一次(3月)月考化学试卷甘肃省兰州市第一中学2016-2017学年高一下学期期末考试化学试题湖南省长郡中学2018届高三第三次月考化学试题四川省资阳中学2017-2018学年高一下学期3月月考化学试题山西省祁县中学2017-2018学年高二4月月考化学试题【全国百强校】四川省棠湖中学2017-2018学年高一下学期期末模拟化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【押题专练】贵州省毕节市黔西县第一中学2018-2019学年高二上学期12月份考试化学试题贵州省织金县第一中学2018-2019学年高二上学期期中考试化学试题云南省巧家县四中2018-2019学年高二上学期12月份考试化学试题云南省彝良县民族中学2018-2019学年高二上学期12月份考试化学试题云南省昭通水田新区中学2018-2019学年高二上学期12月月考化学试题【全国百强校】河北省冀州市中学2018-2019学年高二上学期第六次月考化学试题河南省开封市兰考县第一高级中学2018-2019学年高二下学期3月月考化学试题甘肃省武威第十八中学2018-2019学年高二下学期第一次月考化学试题江西省宜春市宜丰中学2020届高三上学期第一次月考化学试题云南省元阳县第三中学2019-2020学年高二上学期期末考试化学试题云南省普洱市墨江县民族学校2019—2020学年高二上学期期末考试化学试题内蒙古自治区包头市北方重工业集团有限公司第三中学2019-2020学年高二下学期期中考试化学试题四川省遂宁中学校2019-2020学年高二下学期期中考试化学试题黑龙江省齐齐哈尔市第一中学2020-2021学年高二下学期4月月考化学试题吉林省长春市实验中学2020-2021学年度高二下学期阶段考试化学试题四川省达州市宣汉县土黄中学2021-2022学年高一下学期期中考试化学试题江苏省盐城市东台创新高级中学2021-2022学年高一4月份月检测化学试题安徽省蚌埠市蚌埠铁路中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
6 . 深井岩盐的主要配料为:精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6·3H2O]。其中亚铁氰化钾的无水盐在高温下会发生分解:3K4[Fe(CN)6] 2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
(1)①基态Fe原子价电子排布图(轨道表示式)为_________________________
②C、N和O三种元素的第一电离能的大小顺序为_____________ ,原因是__________ 。
③IO3-的中心原子的杂化方式为______ 。一种与CN-互为等电子体的分子的电子式为_______ 。
④1molFe(CN)63−中含有σ键的数目为____ mol。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___ 。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__________ (填晶体类型)。
(3)如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,该立方体中三价铁离子处于氧离子围成的________ (填空间结构)空隙。
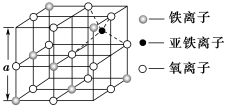
(4)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71g•cm﹣3,晶胞边长为4.28×10﹣10 m,则FexO中x=____ 。(用代数式表示,不要求算出具体结果)。
 2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:(1)①基态Fe原子价电子排布图(轨道表示式)为
②C、N和O三种元素的第一电离能的大小顺序为
③IO3-的中心原子的杂化方式为
④1molFe(CN)63−中含有σ键的数目为
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=
(3)如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,该立方体中三价铁离子处于氧离子围成的

(4)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71g•cm﹣3,晶胞边长为4.28×10﹣10 m,则FexO中x=
您最近一年使用:0次
2020-01-14更新
|
172次组卷
|
3卷引用:2019年陕西省渭南市高三第一次教学质量检测化学试题
2019年陕西省渭南市高三第一次教学质量检测化学试题(已下线)2020届高三《新题速递·化学》2月第01期(考点13-14)新疆克孜勒苏柯尔克孜自治州阿克陶县2022-2023学年高三上学期11月期中考试化学试题
名校
解题方法
7 . 镍及其化合物是重要的合金材料和催化剂。请回答下列问题:
(1)基态镍原子的价电子排布式为___________ ,排布时最高能层的电子所占的原子轨道有__________ 个伸展方向。
(2)镍能形成多种配合物如正四面体形的Ni(CO)4和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法不正确的有_________ 。
A.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2
B.NH3的空间构型为平面三角形
C.Ni2+在形成配合物时,其配位数可能为是4或6
D.Ni(CO)4中,镍元素是sp3杂化
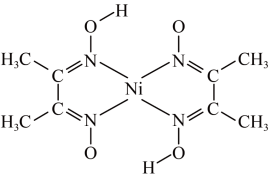
(3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“•••”表示出氢键。_____
(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
NiO晶胞中Ni2+的配位数为_______ ,NiO熔点比NaCl高的原因是_______________________ 。
(5)研究发现镧镍合金LaNix是一种良好的储氢材料。合金LaNix晶体属六方晶系如图a所示,其晶胞如图a中实线所示,如图b所示(其中小圆圈代表La,小黑点代表Ni)。储氢位置有两种,分别是八面体空隙(“ ”)和四面体空隙(“
”)和四面体空隙(“ ”),见图c、d,这些就是氢原子存储处。
”),见图c、d,这些就是氢原子存储处。
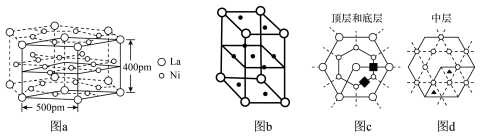
①LaNix合金中x的值为_____ ;
②LaNix晶胞的密度是________ g/cm-3(阿伏加 德罗常数用NA表示,LaNix的摩尔质量用M表示 )
③晶胞中和“ ”同类的八面体空隙有
”同类的八面体空隙有______ 个。
(1)基态镍原子的价电子排布式为
(2)镍能形成多种配合物如正四面体形的Ni(CO)4和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法不正确的有
A.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2
B.NH3的空间构型为平面三角形
C.Ni2+在形成配合物时,其配位数可能为是4或6
D.Ni(CO)4中,镍元素是sp3杂化
(3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“•••”表示出氢键。

(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
| Na+ | 102pm | Cr | 181pm |
| Ni2+ | 69pm | O2- | 140pm |
NiO晶胞中Ni2+的配位数为
(5)研究发现镧镍合金LaNix是一种良好的储氢材料。合金LaNix晶体属六方晶系如图a所示,其晶胞如图a中实线所示,如图b所示(其中小圆圈代表La,小黑点代表Ni)。储氢位置有两种,分别是八面体空隙(“
 ”)和四面体空隙(“
”)和四面体空隙(“ ”),见图c、d,这些就是氢原子存储处。
”),见图c、d,这些就是氢原子存储处。
①LaNix合金中x的值为
②LaNix晶胞的密度是
③晶胞中和“
 ”同类的八面体空隙有
”同类的八面体空隙有
您最近一年使用:0次
8 . 合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应方程式如下: CH3COO[Cu(NH3)2]+CO+NH3=CH3COO[Cu(NH3)3CO]。
(1)Cu+基态核外电子排布式为_____________________ 。
(2)C、N、O元素的第一电离能由大到小的顺序为_____________________ 。
(3)1mol[Cu(NH3)2]+中含有σ键的数目为___________ ,CH3COO[Cu(NH3)2]中C原子轨道的杂化类型是_______________ 。
(4)与NH3分子互为等电子体的阴离子为______________ 。
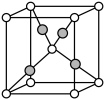
(5)Cu2O的晶胞结构如图所示,其中O2-的配位数是______________ 。
(1)Cu+基态核外电子排布式为
(2)C、N、O元素的第一电离能由大到小的顺序为
(3)1mol[Cu(NH3)2]+中含有σ键的数目为
(4)与NH3分子互为等电子体的阴离子为
(5)Cu2O的晶胞结构如图所示,其中O2-的配位数是

您最近一年使用:0次
2019-12-06更新
|
192次组卷
|
4卷引用:陕西省咸阳市武功县2020届高三上学期第一次模拟考试化学试题
名校
解题方法
9 . 下列叙述中正确的个数有( )
①氧原子的电子排布图: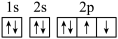 最外层违背了泡利原理
最外层违背了泡利原理
②处于最低能量状态原子叫基态原子,1s22s22px1→1s22s22py1过程中形成的是发射光谱
③所有元素中,氟的第一电离能最大
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
⑥金属元素的电负性均小于1.8
⑦主族元素的电负性越大,其元素原子的第一电离能一定越大
⑧在任何情况下,都是σ键比π键强度大
①氧原子的电子排布图:
 最外层违背了泡利原理
最外层违背了泡利原理②处于最低能量状态原子叫基态原子,1s22s22px1→1s22s22py1过程中形成的是发射光谱
③所有元素中,氟的第一电离能最大
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
⑥金属元素的电负性均小于1.8
⑦主族元素的电负性越大,其元素原子的第一电离能一定越大
⑧在任何情况下,都是σ键比π键强度大
| A.0个 | B.1个 | C.2个 | D.3个 |
您最近一年使用:0次
2019-11-27更新
|
1600次组卷
|
9卷引用:安徽省毛坦厂中学2019-2020学年高二上学期期中考试化学试题
安徽省毛坦厂中学2019-2020学年高二上学期期中考试化学试题陕西省西安市陕西师范大学附属中学渭北中学2022-2023学年高二下学期5月月考化学试题(人教版2019)选择性必修2 阶段性综合评估测试卷(一)重庆市实验中学校2021-2022学年高二下学期第一次月考化学试题重庆市南华中学校2021-2022学年高二3月月考化学试题重庆实验外国语学校2021-2022学年高二下学期6月月考化学试题海南热带海洋学院附属中学2021-2022学年高二下学期第一次月考化学试题湖南省永州市祁阳县第四中学2022-2023学年高二下学期第一次段考化学试题黑龙江省齐齐哈尔市第八中学校2022-2023学年高二下学期期中考试化学试题
12-13高二上·四川成都·期中
名校
解题方法
10 . 下列关于丙烯(CH3—CH=CH2)的说法正确的是( )
| A.丙烯分子中3个碳原子都是sp3杂化 |
| B.丙烯分子有7个σ键,1个π键 |
| C.丙烯分子存在非极性键 |
| D.丙烯分子中3个碳原子在同一直线上 |
您最近一年使用:0次
2019-11-15更新
|
173次组卷
|
7卷引用:陕西省西安中学2018-2019学年高二下学期期末考试化学试题
陕西省西安中学2018-2019学年高二下学期期末考试化学试题(已下线)2011--2012学年四川省成都二十中高二上学期期中考试化学试卷(已下线)2011-2012学年山西省临汾一中高二下学期期中考试化学试卷2016-2017学年四川省三台中学校高二上月考化学试卷宁夏回族自治区石嘴山市平罗中学2019-2020学年高二上学期期中考试化学试题宁夏育才中学2019-2020学年高二下学期开学检测化学试题吉林省辽源市东辽县第一高级中学2019-2020高二5月月考化学试题



