名校
1 . 二氯化一氯五氨合钴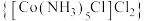 可用作聚氯乙烯的染色剂和稳定剂。已知:
可用作聚氯乙烯的染色剂和稳定剂。已知: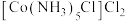 不溶于水和乙醇;
不溶于水和乙醇; 是粉红色不溶于水的固体;
是粉红色不溶于水的固体;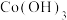 是棕褐色不溶于水的固体。
是棕褐色不溶于水的固体。
Ⅰ.制备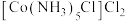
某实验小组利用以下装置和流程制备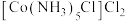 。
。
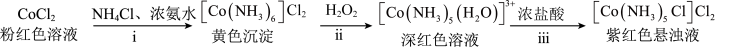
(1)步骤ⅱ,滴入 5%
5% ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
(2)步骤ⅲ,待溶液中停止产生气泡后,缓慢加入 浓盐酸,在85℃水浴中加热
浓盐酸,在85℃水浴中加热 ,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。洗涤过程需要用到冰水和无水乙醇,使用无水乙醇的原因
,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。洗涤过程需要用到冰水和无水乙醇,使用无水乙醇的原因___________ 。
Ⅱ.产品结构分析
(3)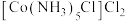 中存在的化学键有
中存在的化学键有___________ (填标号)。
a.离子键 b.范德华力 c.非极性共价键 d.极性共价键 e.配位键 f.氢键
(4) 中含
中含 键的数目为
键的数目为___________ 。
Ⅲ.实验探究
(5)实验小组在制备过程中发现 溶液中直接加入
溶液中直接加入 ,
, 不被氧化,据此认为加入浓氨水和氯化铵对
不被氧化,据此认为加入浓氨水和氯化铵对 的氧化产生了影响,提出以下猜想并设计实验验证。
的氧化产生了影响,提出以下猜想并设计实验验证。
猜想1:加入氯化铵溶液,增强了 的氧化性。
的氧化性。
猜想2:加入浓氨水形成配合物,增强了 离子的还原性。
离子的还原性。
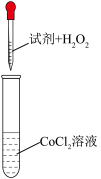
实验结论:猜想1不合理,猜想2合理。
①a是___________ ,b是___________ 。
②步骤ⅰ中氯化铵的作用是___________ 。
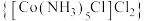 可用作聚氯乙烯的染色剂和稳定剂。已知:
可用作聚氯乙烯的染色剂和稳定剂。已知: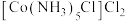 不溶于水和乙醇;
不溶于水和乙醇; 是粉红色不溶于水的固体;
是粉红色不溶于水的固体;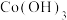 是棕褐色不溶于水的固体。
是棕褐色不溶于水的固体。Ⅰ.制备
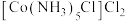
某实验小组利用以下装置和流程制备
 。
。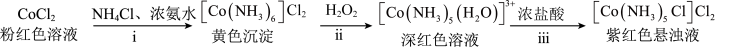
(1)步骤ⅱ,滴入
 5%
5% ,发生反应的离子方程式为
,发生反应的离子方程式为(2)步骤ⅲ,待溶液中停止产生气泡后,缓慢加入
 浓盐酸,在85℃水浴中加热
浓盐酸,在85℃水浴中加热 ,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。洗涤过程需要用到冰水和无水乙醇,使用无水乙醇的原因
,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。洗涤过程需要用到冰水和无水乙醇,使用无水乙醇的原因Ⅱ.产品结构分析
(3)
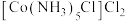 中存在的化学键有
中存在的化学键有a.离子键 b.范德华力 c.非极性共价键 d.极性共价键 e.配位键 f.氢键
(4)
 中含
中含 键的数目为
键的数目为Ⅲ.实验探究
(5)实验小组在制备过程中发现
 溶液中直接加入
溶液中直接加入 ,
, 不被氧化,据此认为加入浓氨水和氯化铵对
不被氧化,据此认为加入浓氨水和氯化铵对 的氧化产生了影响,提出以下猜想并设计实验验证。
的氧化产生了影响,提出以下猜想并设计实验验证。猜想1:加入氯化铵溶液,增强了
 的氧化性。
的氧化性。猜想2:加入浓氨水形成配合物,增强了
 离子的还原性。
离子的还原性。
| 实验编号 | 试剂 | 现象 |
| 1 |  水 水 | 无明显变化 |
| 2 | a | 无明显变化 |
| 3 | b | 溶液变为深红色,且出现棕褐色沉淀 |
①a是
②步骤ⅰ中氯化铵的作用是
您最近一年使用:0次
2023-12-12更新
|
435次组卷
|
3卷引用:重庆市万州第二高级中学2023-2024学年高二下学期3月月考化学试题
重庆市万州第二高级中学2023-2024学年高二下学期3月月考化学试题海南省海南中学2023-2024学年高三上学期第三次月考化学试题(已下线)题型17 化学实验综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
名校
解题方法
2 . 三氯化硼( )是一种重要的化工原料,可用来制造氮化硼及硼烷化合物等。查阅资料可知:
)是一种重要的化工原料,可用来制造氮化硼及硼烷化合物等。查阅资料可知:
① 的熔点为
的熔点为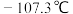 ,沸点为12.5℃,与水(包括水蒸气)能剧烈反应生成硼酸(
,沸点为12.5℃,与水(包括水蒸气)能剧烈反应生成硼酸( ),同时有白雾出现。
),同时有白雾出现。
②硼与铝的性质相似。硼与强酸或强碱溶液均能反应,与HCl气体反应生成 。
。
据此,某实验小组利用下列装置制备 (原理为
(原理为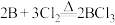 )。
)。
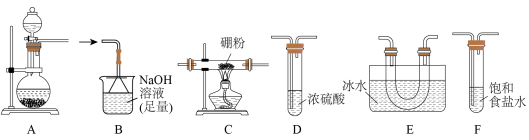
回答下列问题:
(1) 分子的空间结构为
分子的空间结构为__________ 。
(2)装置F的作用为__________ ,装置E的作用为____________________ 。
(3)实验装置合理的连接顺序为_______ →D→B。(装置可重复使用)
(4)连接好仪器,装入药品前,应进行的操作是_________ 。
(5)写出装置A中发生反应的化学方程式:____________________________ 。
(6)测定 产品中氯元素的含量。
产品中氯元素的含量。
称取a g样品置于蒸馏水中完全水解,并配制成100mL溶液,取出25mL于锥形瓶中,再加入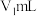
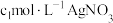 溶液使
溶液使 充分沉淀,然后加入3mL硝基苯(常温常压下,密度为
充分沉淀,然后加入3mL硝基苯(常温常压下,密度为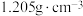 ),振荡、静置,再向锥形瓶中滴加3滴
),振荡、静置,再向锥形瓶中滴加3滴 溶液作指示剂,用
溶液作指示剂,用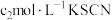 标准溶液滴定
标准溶液滴定 (发生反应
(发生反应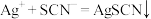 ),达到滴定终点时,消耗标准溶液
),达到滴定终点时,消耗标准溶液 。已知:
。已知: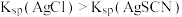 ;该实验条件下,硼酸不与
;该实验条件下,硼酸不与 反应。
反应。
①达到滴定终点时的现象为_________ 。
②样品中氯元素的质量分数为_______ %。若其他操作都正确,仅滴定管没有用KSCN标准溶液润洗,则测得产品中 的质量分数
的质量分数_______ (填“偏高”“偏低”或“无影响”)。
 )是一种重要的化工原料,可用来制造氮化硼及硼烷化合物等。查阅资料可知:
)是一种重要的化工原料,可用来制造氮化硼及硼烷化合物等。查阅资料可知:①
 的熔点为
的熔点为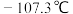 ,沸点为12.5℃,与水(包括水蒸气)能剧烈反应生成硼酸(
,沸点为12.5℃,与水(包括水蒸气)能剧烈反应生成硼酸( ),同时有白雾出现。
),同时有白雾出现。②硼与铝的性质相似。硼与强酸或强碱溶液均能反应,与HCl气体反应生成
 。
。据此,某实验小组利用下列装置制备
 (原理为
(原理为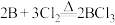 )。
)。
回答下列问题:
(1)
 分子的空间结构为
分子的空间结构为(2)装置F的作用为
(3)实验装置合理的连接顺序为
(4)连接好仪器,装入药品前,应进行的操作是
(5)写出装置A中发生反应的化学方程式:
(6)测定
 产品中氯元素的含量。
产品中氯元素的含量。称取a g样品置于蒸馏水中完全水解,并配制成100mL溶液,取出25mL于锥形瓶中,再加入
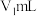
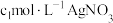 溶液使
溶液使 充分沉淀,然后加入3mL硝基苯(常温常压下,密度为
充分沉淀,然后加入3mL硝基苯(常温常压下,密度为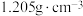 ),振荡、静置,再向锥形瓶中滴加3滴
),振荡、静置,再向锥形瓶中滴加3滴 溶液作指示剂,用
溶液作指示剂,用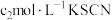 标准溶液滴定
标准溶液滴定 (发生反应
(发生反应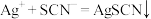 ),达到滴定终点时,消耗标准溶液
),达到滴定终点时,消耗标准溶液 。已知:
。已知: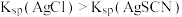 ;该实验条件下,硼酸不与
;该实验条件下,硼酸不与 反应。
反应。①达到滴定终点时的现象为
②样品中氯元素的质量分数为
 的质量分数
的质量分数
您最近一年使用:0次
2024-04-01更新
|
256次组卷
|
2卷引用:重庆市璧山来凤中学等多校联考2023-2024学年高三下学期3月月考化学试题
名校
3 . 三聚氯氰是重要的精细化工产品,具有广泛的用途,其生产通常是由氯化氰制备和氯化氰聚合两个过程组成。
I.氯化氰制备
已知:氯化氰为无色液体,熔点-6.5℃,沸点12.5℃。可溶于水、乙醇、乙醚等,遇水缓慢水解为氰酸和盐酸。现用氰化钠和氯气在四氯化碳中反应制备氯化氰,反应式:NaCN+Cl2=NaCl+CNCl。反应装置如图所示,在三口烧瓶上装有温度计、搅拌器、进气管、出气管,据图回答下列问题:
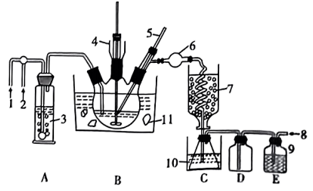
(1)CNCl的结构式为______ ;其中C原子的杂化类型为______ 。
(2)在氯化氰的制备装置中,装置3、装置9中的试剂为______ 。在反应前需要先向装置内通入约3分钟干燥氮气,目的是_____ 。
(3)该制备分为两个阶段。
阶段一:将40g氰化钠粉末及140mL四氯化碳装入烧瓶中,缓慢送入氯气并搅拌使得氯气与NaCN充分反应。此阶段装置7、装置10、装置11作用相同,为______ ;当D中出现______ 现象时,说明阶段一结束。
阶段二:将______ (填“装置7”“装置10”或“装置11”)的温度调整至60℃,将_____ (填“装置7”“装置10”或“装置11”)的温度调整至-40℃并缓慢通入氮气直至阶段二结束。阶段二结束之后产品将被集中在_____ 中(填字母)。
II.氯化氰聚合
(4)氯化氰干燥后,在聚合塔中加热至400℃后便能得到氯化氰三聚物,请画出氯化氰三聚物的结构式:______ 。
I.氯化氰制备
已知:氯化氰为无色液体,熔点-6.5℃,沸点12.5℃。可溶于水、乙醇、乙醚等,遇水缓慢水解为氰酸和盐酸。现用氰化钠和氯气在四氯化碳中反应制备氯化氰,反应式:NaCN+Cl2=NaCl+CNCl。反应装置如图所示,在三口烧瓶上装有温度计、搅拌器、进气管、出气管,据图回答下列问题:

(1)CNCl的结构式为
(2)在氯化氰的制备装置中,装置3、装置9中的试剂为
(3)该制备分为两个阶段。
阶段一:将40g氰化钠粉末及140mL四氯化碳装入烧瓶中,缓慢送入氯气并搅拌使得氯气与NaCN充分反应。此阶段装置7、装置10、装置11作用相同,为
阶段二:将
II.氯化氰聚合
(4)氯化氰干燥后,在聚合塔中加热至400℃后便能得到氯化氰三聚物,请画出氯化氰三聚物的结构式:
您最近一年使用:0次
2023-03-20更新
|
304次组卷
|
2卷引用:重庆市巴蜀中学校2023届高三适应性月考卷(七)化学试题
名校
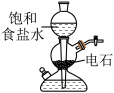
4 . 下列实验装置或操作能够达到实验目的的是
|
|
| A.实验室制乙炔 | B.验证羟基活化苯环 |
|
|
C.验证牺牲 保护 保护 | D.制备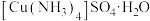 晶体 晶体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-05-16更新
|
171次组卷
|
2卷引用:2024届重庆市南开中学校高三下学期5月月考化学试题
名校
解题方法
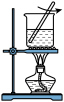
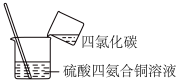
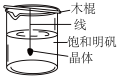
5 . 下列实验不能达到实验目的的是
A | B | C | D |
|
|
|
|
加热融化硫固体 | 减缓水体中钢铁设施的腐蚀 | 制备硫酸四氨合铜晶体 | 制备明矾晶体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
6 . 二氯化二硫(S2Cl2)在工业上常用作橡胶的低温硫化剂。某小组利用单质S与少量Cl2在110-140℃条件下反应合成S2Cl2,查阅有关资料后,得到如下信息:
设计如图所示实验装置(部分夹持装置、加热装置均已略去):
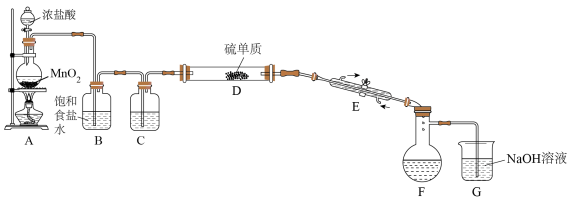
回答下列问题:
(1)仪器E的名称为___________
(2)实验过程中,需要控制装置D的温度,温度不宜过高的原因是___________
判断反应已进行完全的实验现象是___________
(3)S2Cl2与H2O2结构相似,推测S2Cl2为___________ 分子(填“极性”“非极性”),S的杂化类型为___________
(4)有同学认为该装置存在一定的缺陷,指出存在的问题并提出改进方案:___________
(5)取F中黄色液体mg于锥形瓶,加水至反应完全(假设杂质均不与水反应),向所得液中加入过量的c1mol/L的AgNO3溶液V1mL,再向锥形瓶中加入硝基苯,将生成的沉淀覆盖,加入适量Fe(NO3)3作指示剂,用c2mol/LNaSCN溶液滴定至终点,消耗NaSCN溶液V2mL(滴定过程发生反应:Ag++SCN-=AgSCN↓)
①S2Cl2遇水反应,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原色,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式:___________
②滴定终点的现象为___________
③S2Cl2的纯度为___________ (写出表达式),滴定过程中加入硝基苯将生成的沉淀覆盖,这样操作的目的是___________ 。
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 113 | 445 | ___________ |
| S2Cl2 | -80 | 138 | ①常温下,为黄红色液体,能与水反应 ②300℃以上完全分解 ③在加热条件下会被Cl2氧化成+2价硫 |

回答下列问题:
(1)仪器E的名称为
(2)实验过程中,需要控制装置D的温度,温度不宜过高的原因是
判断反应已进行完全的实验现象是
(3)S2Cl2与H2O2结构相似,推测S2Cl2为
(4)有同学认为该装置存在一定的缺陷,指出存在的问题并提出改进方案:
(5)取F中黄色液体mg于锥形瓶,加水至反应完全(假设杂质均不与水反应),向所得液中加入过量的c1mol/L的AgNO3溶液V1mL,再向锥形瓶中加入硝基苯,将生成的沉淀覆盖,加入适量Fe(NO3)3作指示剂,用c2mol/LNaSCN溶液滴定至终点,消耗NaSCN溶液V2mL(滴定过程发生反应:Ag++SCN-=AgSCN↓)
①S2Cl2遇水反应,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原色,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式:
②滴定终点的现象为
③S2Cl2的纯度为
您最近一年使用:0次
解题方法
7 . 二氯异氰尿酸钠(结构为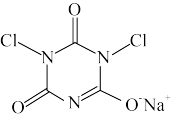 )是一种非常高效的强氧化性消毒剂。常温下是白色固体,难溶于冷水;合成二氯异氰尿酸钠的反应为
)是一种非常高效的强氧化性消毒剂。常温下是白色固体,难溶于冷水;合成二氯异氰尿酸钠的反应为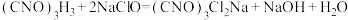 。某同学在实验室用如下装置制取二氯异氰尿酸钠(部分夹持装置已略)。
。某同学在实验室用如下装置制取二氯异氰尿酸钠(部分夹持装置已略)。
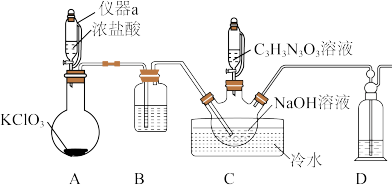
请回答下列问题:
(1)二氯异氰尿酸钠中N原子的杂化类型是_______ 。
(2)仪器a的名称是_______ ;仪器D中的试剂是_______ 。
(3)A中烧瓶内发生反应的化学方程式为_______ 。
(4)装置B的作用是_______ ;如果没有B装置,会产生的不良结果是_______ 。
(5)待装置C_______ 时(填实验现象),再滴加 溶液,反应过程中需要不断通入
溶液,反应过程中需要不断通入 的目的是
的目的是_______ 。
(6)实验室测定二氯异氰尿酸钠样品中有效氯的原理如下:
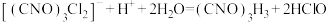
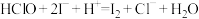
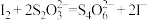
准确称取m g样品,配成100mL溶液,取20.00mL所配溶液于碘量瓶中,加入稀 和过量KI溶液,充分反应后,加入淀粉溶液,用c
和过量KI溶液,充分反应后,加入淀粉溶液,用c
 标准溶液滴定,滴到终点时,消耗
标准溶液滴定,滴到终点时,消耗 标准溶液的体积为V mL,则样品有效氯含量为
标准溶液的体积为V mL,则样品有效氯含量为_______ %(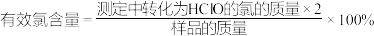 )
)
 )是一种非常高效的强氧化性消毒剂。常温下是白色固体,难溶于冷水;合成二氯异氰尿酸钠的反应为
)是一种非常高效的强氧化性消毒剂。常温下是白色固体,难溶于冷水;合成二氯异氰尿酸钠的反应为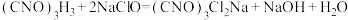 。某同学在实验室用如下装置制取二氯异氰尿酸钠(部分夹持装置已略)。
。某同学在实验室用如下装置制取二氯异氰尿酸钠(部分夹持装置已略)。
请回答下列问题:
(1)二氯异氰尿酸钠中N原子的杂化类型是
(2)仪器a的名称是
(3)A中烧瓶内发生反应的化学方程式为
(4)装置B的作用是
(5)待装置C
 溶液,反应过程中需要不断通入
溶液,反应过程中需要不断通入 的目的是
的目的是(6)实验室测定二氯异氰尿酸钠样品中有效氯的原理如下:
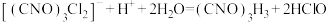
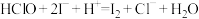
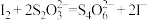
准确称取m g样品,配成100mL溶液,取20.00mL所配溶液于碘量瓶中,加入稀
 和过量KI溶液,充分反应后,加入淀粉溶液,用c
和过量KI溶液,充分反应后,加入淀粉溶液,用c
 标准溶液滴定,滴到终点时,消耗
标准溶液滴定,滴到终点时,消耗 标准溶液的体积为V mL,则样品有效氯含量为
标准溶液的体积为V mL,则样品有效氯含量为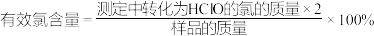 )
)
您最近一年使用:0次
名校
8 . 过硫酸钠(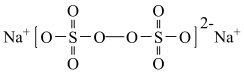 ),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对
),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对 制备和性质及用途进行探究。
制备和性质及用途进行探究。

工业制备过硫酸钠的反应原理:
主反应:

副反应:

实验室设计如图实验装置:
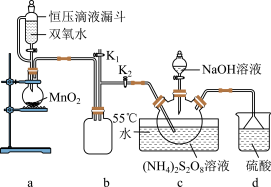
(2)装置b的作用是
(3)上述反应过程中,d装置中主要发生的化学反应方程式为
Ⅱ.探究
 的性质与用途
的性质与用途(4)
 用于废水中苯酚的降解
用于废水中苯酚的降解已知:a.
 具有强氧化性,
具有强氧化性, 浓度较高时会导致
浓度较高时会导致 淬灭。
淬灭。b.
 可将苯酚氧化,但反应速率较慢,加入
可将苯酚氧化,但反应速率较慢,加入 可加快反应。
可加快反应。过程为ⅰ.

ⅱ.
 将苯酚氧化为
将苯酚氧化为 气体
气体①
 氧化苯酚的离子方程式是
氧化苯酚的离子方程式是②将含
 的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。
的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。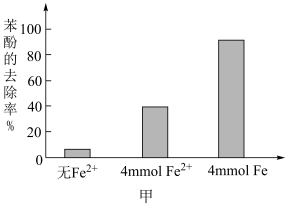
 ,可明显提高苯酚的降解率,主要原因是
,可明显提高苯酚的降解率,主要原因是(5)工业上利用
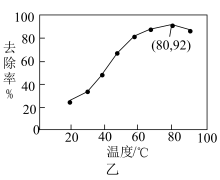
 能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含
能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含 的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为
的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为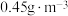 ,
,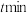 达到最大去除率,NO去除的平均反应速率:
达到最大去除率,NO去除的平均反应速率: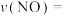
 。
。
您最近一年使用:0次
名校
9 . TiCl4是制备金属钛的重要中间体。某小组同学利用如图装置在实验室制备(夹持装置略去)。
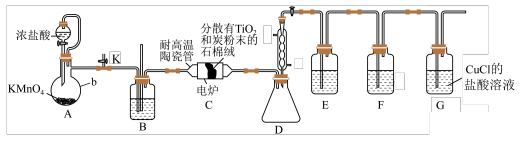
已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如表所示:
回答下列问题:
(1)装置B中的试剂是___________ (填试剂名称)。
(2)装置D的作用是___________ ,装置C中除生成 外,还生成CO,该反应的化学方程式为
外,还生成CO,该反应的化学方程式为___________ 。
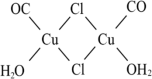
(3)利用G装置可以将CO吸收得到氯化羰基亚铜[Cu2Cl2(CO)2•2H2O],其结构如图所示。试从结构角度分析,CuCl的盐酸溶液可以吸收CO的原因是___________ 。
(4)可以选用下面的一套装置___________(填标号)替换掉装置E和F。
(5)利用如图装置测定所得TiCl4的纯度:取2.0g产品加入烧瓶中,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴0.1mol•L-1K2CrO4溶液作指示剂,用1.00mol•L-1AgNO3标准溶液滴定至终点,消耗标准溶液40.00mL。已知:常温下Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,Ag2CrO4呈砖红色,TiCl4+(2+n)H2O=TiO2•nH2O↓+4HCl。
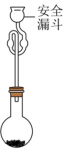
①安全漏斗中的水在本实验中的作用除与TiCl4反应外,还有________ 。
②滴定终点的判断方法是_________ 。
③已知TiCl4的摩尔质量是190g/mol,则产品的纯度为______ (保留两位有效数字)。

已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如表所示:
| 熔点/℃ | 沸点/℃ | 密度/(g•cm-3) | 水溶性 | |
| TiCl4 | -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
(1)装置B中的试剂是
(2)装置D的作用是
 外,还生成CO,该反应的化学方程式为
外,还生成CO,该反应的化学方程式为(3)利用G装置可以将CO吸收得到氯化羰基亚铜[Cu2Cl2(CO)2•2H2O],其结构如图所示。试从结构角度分析,CuCl的盐酸溶液可以吸收CO的原因是

(4)可以选用下面的一套装置___________(填标号)替换掉装置E和F。
A. | B. | C. | D. |

①安全漏斗中的水在本实验中的作用除与TiCl4反应外,还有
②滴定终点的判断方法是
③已知TiCl4的摩尔质量是190g/mol,则产品的纯度为
您最近一年使用:0次
名校
10 . 硫代硫酸钠(Na2S2O3)是硫酸钠中一个氧原子被硫原子取代的产物。硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g⋅mol−1)易溶于水,难溶于乙醇,在酸性环境中易分解。
Ⅰ.制备a2S2O3·5H2O
方法一:亚硫酸钠法。反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3固体于烧杯中,溶于煮沸过的蒸馏水。另取过量的硫粉,加入少量乙醇充分搅拌后,加到上述Na2SO3溶液中。水浴加热,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶析出Na2S2O3·5H2O晶体。
(1) 中心硫原子的杂化方式为
中心硫原子的杂化方式为___________ 。
(2)使用煮沸过的蒸馏水配制Na2SO3溶液的目的是___________ 。
方法二:硫化碱法。装置如图所示。
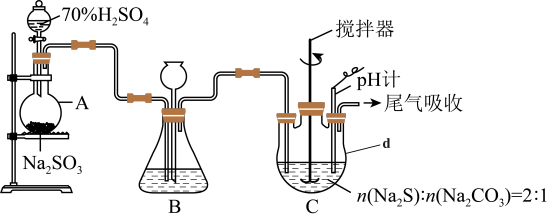
(3)①仪器d的名称为___________ 。
②装置A中发生反应的化学方程式为___________ 。
③装置C中,将Na2S和Na2CO3以2:1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2.该反应的化学方程式为___________ 。
④实验过程中,为了保证Na2S2O3·5H2O的产量,实验中通入的SO2不能过量,原因是_________ 。
Ⅱ.Na2S2O3的应用
(4)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.0000g样品溶于水,配成100mL溶液。
步骤2:准确称取0.294gK2Cr2O7固体于碘量瓶中,加入20mL蒸馏水溶解,再加入10mL2mol⋅L−1H2SO4和20mL10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL某溶液作指示剂,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2 =2I−+
=2I−+ )
)
①步骤3中向碘量瓶中加入的指示剂是___________ 。
②由计算可得Na2S2O3·5H2O的纯度为___________ 。
Ⅰ.制备a2S2O3·5H2O
方法一:亚硫酸钠法。反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3固体于烧杯中,溶于煮沸过的蒸馏水。另取过量的硫粉,加入少量乙醇充分搅拌后,加到上述Na2SO3溶液中。水浴加热,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶析出Na2S2O3·5H2O晶体。
(1)
 中心硫原子的杂化方式为
中心硫原子的杂化方式为(2)使用煮沸过的蒸馏水配制Na2SO3溶液的目的是
方法二:硫化碱法。装置如图所示。

(3)①仪器d的名称为
②装置A中发生反应的化学方程式为
③装置C中,将Na2S和Na2CO3以2:1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2.该反应的化学方程式为
④实验过程中,为了保证Na2S2O3·5H2O的产量,实验中通入的SO2不能过量,原因是
Ⅱ.Na2S2O3的应用
(4)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.0000g样品溶于水,配成100mL溶液。
步骤2:准确称取0.294gK2Cr2O7固体于碘量瓶中,加入20mL蒸馏水溶解,再加入10mL2mol⋅L−1H2SO4和20mL10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL某溶液作指示剂,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2
 =2I−+
=2I−+ )
)①步骤3中向碘量瓶中加入的指示剂是
②由计算可得Na2S2O3·5H2O的纯度为
您最近一年使用:0次