1 . 钒、钨、锌在工业上用途广泛。
(1)基态钒(V)元素在周期表中的位置为_______ ,其最高化合价为_______ ,与其同周期且未成对电子数相同的元素符号为_______ ;
(2)钒能形成多种配合物。钒的两种配合物X、Y化学式均为V(NH3)3ClSO4,取X、Y的溶液进行如下实验(已知配体难电离出来),所用试剂及所得现象如表所示:
则X的配离子为_______ ,Y的配体为_______ 。
(3)NaxWO3是一类色彩丰富的非整比化合物,其晶体结构如图2所示,若Na+无空缺,化学式为NaWO3,完全空缺则为WO3,每填入1个Na+,相应有1个W6+还原为W5+。NaxWO3的颜色与x值的对应关系如图1所示,已知NaxWO3晶体中n(W6+):n(W5+)=2:3,则其颜色为_______ 色。

(4)如图3是金属钨晶体中的一个晶胞的结构模型(原子间实际是相互接触的)。其中心的原子位于立方体的体心。实验测得金属钨的半径为rcm,假定金属钨为等直径的刚性球,请回答以下各题:

①每一个晶胞中分摊到_______ 个钨原子。
②计算晶胞的空间利用率_______ (写出表达式,不计算具体数值)。
(1)基态钒(V)元素在周期表中的位置为
(2)钒能形成多种配合物。钒的两种配合物X、Y化学式均为V(NH3)3ClSO4,取X、Y的溶液进行如下实验(已知配体难电离出来),所用试剂及所得现象如表所示:
| 原溶液 | X溶液 | X溶液 | Y溶液 | Y溶液 |
| 所加试剂 | BaCl2溶液 | AgNO3溶液 | BaCl2溶液 | AgNO3溶液 |
| 现象 | 白色沉淀 | 无明显变化 | 无明显变化 | 白色沉淀 |
则X的配离子为
(3)NaxWO3是一类色彩丰富的非整比化合物,其晶体结构如图2所示,若Na+无空缺,化学式为NaWO3,完全空缺则为WO3,每填入1个Na+,相应有1个W6+还原为W5+。NaxWO3的颜色与x值的对应关系如图1所示,已知NaxWO3晶体中n(W6+):n(W5+)=2:3,则其颜色为

(4)如图3是金属钨晶体中的一个晶胞的结构模型(原子间实际是相互接触的)。其中心的原子位于立方体的体心。实验测得金属钨的半径为rcm,假定金属钨为等直径的刚性球,请回答以下各题:

①每一个晶胞中分摊到
②计算晶胞的空间利用率
您最近一年使用:0次
名校
2 . 过硫酸钠(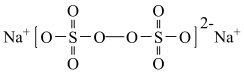 ),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对
),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对 制备和性质及用途进行探究。
制备和性质及用途进行探究。

工业制备过硫酸钠的反应原理:
主反应:

副反应:

实验室设计如图实验装置:
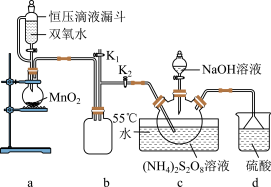
(2)装置b的作用是
(3)上述反应过程中,d装置中主要发生的化学反应方程式为
Ⅱ.探究
 的性质与用途
的性质与用途(4)
 用于废水中苯酚的降解
用于废水中苯酚的降解已知:a.
 具有强氧化性,
具有强氧化性, 浓度较高时会导致
浓度较高时会导致 淬灭。
淬灭。b.
 可将苯酚氧化,但反应速率较慢,加入
可将苯酚氧化,但反应速率较慢,加入 可加快反应。
可加快反应。过程为ⅰ.

ⅱ.
 将苯酚氧化为
将苯酚氧化为 气体
气体①
 氧化苯酚的离子方程式是
氧化苯酚的离子方程式是②将含
 的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。
的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。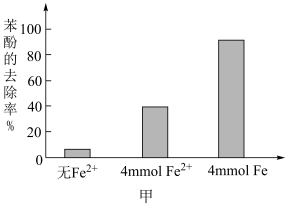
 ,可明显提高苯酚的降解率,主要原因是
,可明显提高苯酚的降解率,主要原因是(5)工业上利用
 能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含
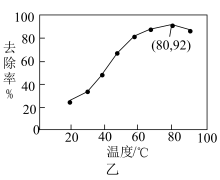
能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含 的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为
的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为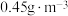 ,
, 达到最大去除率,NO去除的平均反应速率:
达到最大去除率,NO去除的平均反应速率: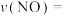
 。
。
您最近一年使用:0次
解题方法
3 . 钛、铬、铁、镍、铜、硼等元素及其化合物在工业上有重要用途。
(1)钛铁合金是铁系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为___________ 。
②Fe的基态原子共有___________ 种不同能级的电子。
③ 也是一种储氢材料,可由
也是一种储氢材料,可由 和
和 反应制得。
反应制得。 由
由 和
和 构成,
构成, 的立体结构是
的立体结构是___________ 。
(2)制备 的反应为
的反应为 。
。
①上述化学方程式中非金属元素电负性由大到小的顺序是___________ (用元素符号表示)。
②分子中所有原子均满足8电子构型, 的电子式为
的电子式为___________ ,分子中 键和
键和 键的个数比为
键的个数比为___________ ,中心原子的杂化方式为___________ 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中 和
和 的离子半径分别为
的离子半径分别为 和
和 。则熔点:NiO
。则熔点:NiO___________ FeO(填“>”、“<”或“=”)。
(4)某铜镍合金的立方晶胞结构如图所示。
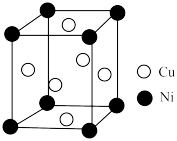
①该晶体的化学式为___________ 。
②已知该晶胞的摩尔质量为 ,密度为
,密度为 。设
。设 为阿伏加德罗常数的值,则该晶胞的棱长是
为阿伏加德罗常数的值,则该晶胞的棱长是___________ cm。(用含M、d、 的代数式表示)
的代数式表示)
(1)钛铁合金是铁系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为
②Fe的基态原子共有
③
 也是一种储氢材料,可由
也是一种储氢材料,可由 和
和 反应制得。
反应制得。 由
由 和
和 构成,
构成, 的立体结构是
的立体结构是(2)制备
 的反应为
的反应为 。
。①上述化学方程式中非金属元素电负性由大到小的顺序是
②分子中所有原子均满足8电子构型,
 的电子式为
的电子式为 键和
键和 键的个数比为
键的个数比为(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中
 和
和 的离子半径分别为
的离子半径分别为 和
和 。则熔点:NiO
。则熔点:NiO(4)某铜镍合金的立方晶胞结构如图所示。

①该晶体的化学式为
②已知该晶胞的摩尔质量为
 ,密度为
,密度为 。设
。设 为阿伏加德罗常数的值,则该晶胞的棱长是
为阿伏加德罗常数的值,则该晶胞的棱长是 的代数式表示)
的代数式表示)
您最近一年使用:0次
名校
解题方法
4 . 钴及钴的化合物在喷气发动机、火箭发动机、导弹的部件、化工设备中各种高负荷的耐热部件以及原子能工业等有着重要的用途。
(1)钴与 、
、 易形成配合物
易形成配合物 和
和 。
。
①写出钴的价层电子排布图___________ 。
②C、N、O第一电离能由小到大的顺序是___________ 。
③已知 的几何构型为正八面体形,推测
的几何构型为正八面体形,推测 的空间构型有
的空间构型有___________ 种。
(2)以粗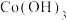 渣(含
渣(含 、CaO、
、CaO、 等杂质)为原料提取钴的工艺流程如下图所示:
等杂质)为原料提取钴的工艺流程如下图所示:

①滤渣1的主要成分有________ 。
②加入 的作用是
的作用是________ 。
③生成 的离子方程式为
的离子方程式为___________ 。
④ 的步骤为:
的步骤为: 。
。 在空气中分解时,不同温度范围所得固体产物不同,将
在空气中分解时,不同温度范围所得固体产物不同,将 在290℃~320℃温度范围内加热分解,得到一种质量为4.82g固体氧化物和
在290℃~320℃温度范围内加热分解,得到一种质量为4.82g固体氧化物和 ,则该固体氧化物的化学式为
,则该固体氧化物的化学式为___________ 。
(1)钴与
 、
、 易形成配合物
易形成配合物 和
和 。
。①写出钴的价层电子排布图
②C、N、O第一电离能由小到大的顺序是
③已知
 的几何构型为正八面体形,推测
的几何构型为正八面体形,推测 的空间构型有
的空间构型有(2)以粗
 渣(含
渣(含 、CaO、
、CaO、 等杂质)为原料提取钴的工艺流程如下图所示:
等杂质)为原料提取钴的工艺流程如下图所示:
①滤渣1的主要成分有
②加入
 的作用是
的作用是③生成
 的离子方程式为
的离子方程式为④
 的步骤为:
的步骤为: 。
。 在空气中分解时,不同温度范围所得固体产物不同,将
在空气中分解时,不同温度范围所得固体产物不同,将 在290℃~320℃温度范围内加热分解,得到一种质量为4.82g固体氧化物和
在290℃~320℃温度范围内加热分解,得到一种质量为4.82g固体氧化物和 ,则该固体氧化物的化学式为
,则该固体氧化物的化学式为
您最近一年使用:0次
名校
5 . 钛、钒、铬、铁、镍、铜等过渡金属及其化合物在工业上有重要用途。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①基态 原子价层电子排布式为
原子价层电子排布式为_______ 。
② 元素在元素周期表中的位置是
元素在元素周期表中的位置是_______ 。
(2)制备 的反应为
的反应为 。
。
①上述化学方程式中非金属元素电负性由小到大的顺序为_______ (用元素符号表示)。
② 分子中所有原子均满足8电子稳定结构,
分子中所有原子均满足8电子稳定结构, 分子中
分子中 键和
键和 键的个数比为
键的个数比为_______ ,中心原子的杂化方式为_______ 。
(3)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如图所示:

①该钒的硫化物的化学式是_______ 。
②该钒的硫化物的晶体中,与每V原子最近且等距S原子的个数是_______ 。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①基态
 原子价层电子排布式为
原子价层电子排布式为②
 元素在元素周期表中的位置是
元素在元素周期表中的位置是(2)制备
 的反应为
的反应为 。
。①上述化学方程式中非金属元素电负性由小到大的顺序为
②
 分子中所有原子均满足8电子稳定结构,
分子中所有原子均满足8电子稳定结构, 分子中
分子中 键和
键和 键的个数比为
键的个数比为(3)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如图所示:

①该钒的硫化物的化学式是
②该钒的硫化物的晶体中,与每V原子最近且等距S原子的个数是
您最近一年使用:0次
解题方法
6 . 碳是地球上组成生命的最基本元素之一、不仅能形成丰富多彩的有机化合物,还能形成多种无机化合物,碳及其化合物的用途广泛。根据要求回答下列问题:
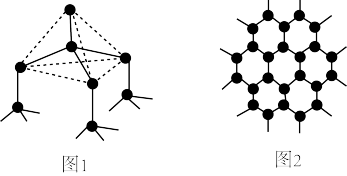
(1)下图中分别代表了碳单质的两种常见晶体,图1晶体中C原子的杂化方式为___________ ,图2晶体中,每个六元环占有___________ 个C原子。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为___________ 。
(3)丙炔( )分子中π键、σ键数目之比为
)分子中π键、σ键数目之比为___________ 。
(4)碳和氢形成的最简单碳正离子CH 的空间构型为
的空间构型为___________ 。
(5)双烯合成即狄尔斯-阿尔德反应(Diels—Alder反应),由共轭双烯与烯烃或炔烃反应生成六元环的反应,是有机化学合成反应中非常重要的碳碳键形成的手段之一、例如: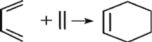 。现用2—甲基—1,3—丁二烯(
。现用2—甲基—1,3—丁二烯(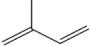 )通过狄尔斯-阿尔德反应合成A(
)通过狄尔斯-阿尔德反应合成A(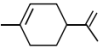 ),在合成A的过程中还可以生成A的多种同分异构体,写出其中一种同分异构体的结构简式
),在合成A的过程中还可以生成A的多种同分异构体,写出其中一种同分异构体的结构简式___________ 。
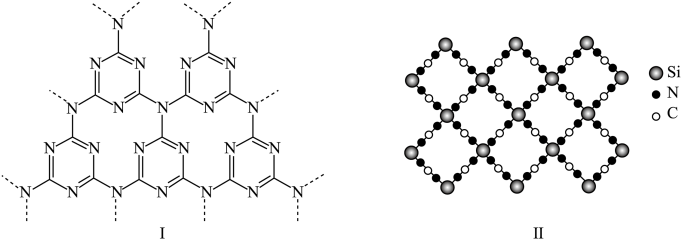
(6)g-C3N4具有和石墨相似的层状结构,其中一种二维平面结构如下图(I)所示,用硅原子替换氮化碳的部分碳原子可形成具有相似性质的化合物如下图(II)所示,该化合物的化学式为___________ ,该化合物中所有元素的电负性由大到小的顺序为___________ 。
(1)下图中分别代表了碳单质的两种常见晶体,图1晶体中C原子的杂化方式为

(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为(3)丙炔(
 )分子中π键、σ键数目之比为
)分子中π键、σ键数目之比为(4)碳和氢形成的最简单碳正离子CH
 的空间构型为
的空间构型为(5)双烯合成即狄尔斯-阿尔德反应(Diels—Alder反应),由共轭双烯与烯烃或炔烃反应生成六元环的反应,是有机化学合成反应中非常重要的碳碳键形成的手段之一、例如:
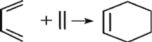 。现用2—甲基—1,3—丁二烯(
。现用2—甲基—1,3—丁二烯( )通过狄尔斯-阿尔德反应合成A(
)通过狄尔斯-阿尔德反应合成A( ),在合成A的过程中还可以生成A的多种同分异构体,写出其中一种同分异构体的结构简式
),在合成A的过程中还可以生成A的多种同分异构体,写出其中一种同分异构体的结构简式(6)g-C3N4具有和石墨相似的层状结构,其中一种二维平面结构如下图(I)所示,用硅原子替换氮化碳的部分碳原子可形成具有相似性质的化合物如下图(II)所示,该化合物的化学式为

您最近一年使用:0次
名校
7 . 氮元素在农药生产及工业制造业等领域用途非常广泛。回答下列问题:
(1)NH3是重要的配体,其中H—N—H的键角为107.3°。
①NH3分子的VSEPR模型为___________ 。
②[Cu(NH3)4]2+中H—N—H的键角_____ 107.3°(填“大于”“小于”或“等于”)。
③甲基胺离子(CH3NH3+)的电子式为______________ 。
(2)已知氨在一定条件下可形成一种立方晶系,其立方晶胞沿x、y或z轴投影图均如图所示。已知晶胞的棱长为a pm,则该晶体的密度为______ g/cm3。(写出数学表达式,设NA为阿伏加德罗常数的值)。

(3)CO和H2可以合成简单有机物,已知CO、H2合成CH3OH、HCOOCH3的能量变化如图所示,计算:2CH3OH(g) HCOOCH3(g)+2H2(g) △H=
HCOOCH3(g)+2H2(g) △H=_____ 。

已知键能数据如下表,则C≡O的键能为__________ kJ•mol-1。
(4)利用电解原理,可将氨气转化为高纯氢气,其装置如图所示。
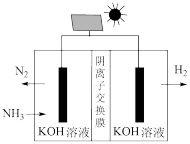
电解过程中OH—的移动方向为____ (填“从左往右”或“从右往左”);阳极的电极反应式为______________ 。
(1)NH3是重要的配体,其中H—N—H的键角为107.3°。
①NH3分子的VSEPR模型为
②[Cu(NH3)4]2+中H—N—H的键角
③甲基胺离子(CH3NH3+)的电子式为
(2)已知氨在一定条件下可形成一种立方晶系,其立方晶胞沿x、y或z轴投影图均如图所示。已知晶胞的棱长为a pm,则该晶体的密度为

(3)CO和H2可以合成简单有机物,已知CO、H2合成CH3OH、HCOOCH3的能量变化如图所示,计算:2CH3OH(g)
 HCOOCH3(g)+2H2(g) △H=
HCOOCH3(g)+2H2(g) △H=
已知键能数据如下表,则C≡O的键能为
化学键 | H-H | C-O | C≡O | H-O | C-H |
键能/(kJ•mol-1) | 436 | 326 | A | 464 | 414 |

电解过程中OH—的移动方向为
您最近一年使用:0次
名校
8 . 三聚氯氰是重要的精细化工产品,具有广泛的用途,其生产通常是由氯化氰制备和氯化氰聚合两个过程组成。
I.氯化氰制备
已知:氯化氰为无色液体,熔点-6.5℃,沸点12.5℃。可溶于水、乙醇、乙醚等,遇水缓慢水解为氰酸和盐酸。现用氰化钠和氯气在四氯化碳中反应制备氯化氰,反应式:NaCN+Cl2=NaCl+CNCl。反应装置如图所示,在三口烧瓶上装有温度计、搅拌器、进气管、出气管,据图回答下列问题:
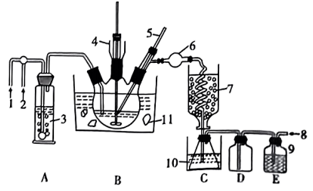
(1)CNCl的结构式为______ ;其中C原子的杂化类型为______ 。
(2)在氯化氰的制备装置中,装置3、装置9中的试剂为______ 。在反应前需要先向装置内通入约3分钟干燥氮气,目的是_____ 。
(3)该制备分为两个阶段。
阶段一:将40g氰化钠粉末及140mL四氯化碳装入烧瓶中,缓慢送入氯气并搅拌使得氯气与NaCN充分反应。此阶段装置7、装置10、装置11作用相同,为______ ;当D中出现______ 现象时,说明阶段一结束。
阶段二:将______ (填“装置7”“装置10”或“装置11”)的温度调整至60℃,将_____ (填“装置7”“装置10”或“装置11”)的温度调整至-40℃并缓慢通入氮气直至阶段二结束。阶段二结束之后产品将被集中在_____ 中(填字母)。
II.氯化氰聚合
(4)氯化氰干燥后,在聚合塔中加热至400℃后便能得到氯化氰三聚物,请画出氯化氰三聚物的结构式:______ 。
I.氯化氰制备
已知:氯化氰为无色液体,熔点-6.5℃,沸点12.5℃。可溶于水、乙醇、乙醚等,遇水缓慢水解为氰酸和盐酸。现用氰化钠和氯气在四氯化碳中反应制备氯化氰,反应式:NaCN+Cl2=NaCl+CNCl。反应装置如图所示,在三口烧瓶上装有温度计、搅拌器、进气管、出气管,据图回答下列问题:

(1)CNCl的结构式为
(2)在氯化氰的制备装置中,装置3、装置9中的试剂为
(3)该制备分为两个阶段。
阶段一:将40g氰化钠粉末及140mL四氯化碳装入烧瓶中,缓慢送入氯气并搅拌使得氯气与NaCN充分反应。此阶段装置7、装置10、装置11作用相同,为
阶段二:将
II.氯化氰聚合
(4)氯化氰干燥后,在聚合塔中加热至400℃后便能得到氯化氰三聚物,请画出氯化氰三聚物的结构式:
您最近一年使用:0次
2023-03-20更新
|
304次组卷
|
2卷引用:重庆市巴蜀中学校2023届高三适应性月考卷(七)化学试题
名校
9 . 锑白( ,性质类似
,性质类似 )可用作白色颜料和阻燃剂。一种从含锑工业废渣(主要成分是
)可用作白色颜料和阻燃剂。一种从含锑工业废渣(主要成分是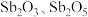 ,含有CuO、
,含有CuO、 和
和 等杂质)中制取
等杂质)中制取 的工业流程如下图所示:
的工业流程如下图所示:
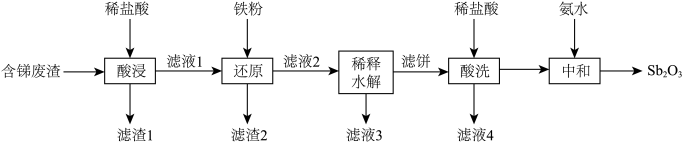
回答下列问题:
(1)锑元素原子序数为51,基态锑原子的价电子轨道表示式为___________ 。
(2)“还原”加入过量铁粉的目的是___________ (填序号)。
a.将 转化为
转化为 b.将
b.将 转化为
转化为 c.将铜离子转化为铜单质
c.将铜离子转化为铜单质
(3)“滤饼”的成分是SbOCl,“稀释水解”主要反应的离子方程式为___________ ;该操作中需要搅拌的原因是___________ 。
(4)“酸洗”后检验沉淀是否洗净的试剂是___________ (填名称)。
(5)“中和”时生成 的化学方程式为
的化学方程式为___________ ,“中和”时不宜将氨水换成氢氧化钠溶液,原因是___________ 。
(6)我国锑的蕴藏量占世界第一位,而锑的化合物也用途广泛。
氟锑酸化学式为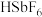 ,酸性比纯硫酸强
,酸性比纯硫酸强 倍,称为超强酸,其与HF作用生成
倍,称为超强酸,其与HF作用生成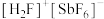 ,则其阳离子的空间结构为
,则其阳离子的空间结构为___________ ,阴离子中心原子的杂化方式合理的是___________ 。
a. b.
b. c.
c. d.
d.
 ,性质类似
,性质类似 )可用作白色颜料和阻燃剂。一种从含锑工业废渣(主要成分是
)可用作白色颜料和阻燃剂。一种从含锑工业废渣(主要成分是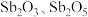 ,含有CuO、
,含有CuO、 和
和 等杂质)中制取
等杂质)中制取 的工业流程如下图所示:
的工业流程如下图所示:
回答下列问题:
(1)锑元素原子序数为51,基态锑原子的价电子轨道表示式为
(2)“还原”加入过量铁粉的目的是
a.将
 转化为
转化为 b.将
b.将 转化为
转化为 c.将铜离子转化为铜单质
c.将铜离子转化为铜单质(3)“滤饼”的成分是SbOCl,“稀释水解”主要反应的离子方程式为
(4)“酸洗”后检验沉淀是否洗净的试剂是
(5)“中和”时生成
 的化学方程式为
的化学方程式为(6)我国锑的蕴藏量占世界第一位,而锑的化合物也用途广泛。
氟锑酸化学式为
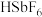 ,酸性比纯硫酸强
,酸性比纯硫酸强 倍,称为超强酸,其与HF作用生成
倍,称为超强酸,其与HF作用生成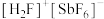 ,则其阳离子的空间结构为
,则其阳离子的空间结构为a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
2023·广东·一模
10 . 镓及其化合物在合金工业、制药工业、电池工业有广泛的应用。回答下列问题:
(1)基态Ga原子的价层电子排布式为_______ 。
(2)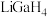 是一种温和的还原剂,其可由
是一种温和的还原剂,其可由 和过量的LiH反应制得:
和过量的LiH反应制得: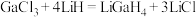 。
。
①已知 的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为_______ 。
② 在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:
在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:_______ 。
③ 的立体构型为
的立体构型为_______ 。
(3)一种含镓的药物合成方法如图所示:_______ ,1 mol化合物I中含有的 键的物质的量为
键的物质的量为_______ 。化合物Ⅰ中所含元素的电负性由大到小的顺序为_______ (用元素符号表示)。
②化合物Ⅱ中Ga的配位数为_______ ,x=_______ 。
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:_______ (填选项字母)。 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为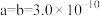 m,
m,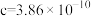 m,则其密度为
m,则其密度为_______  (列出计算式即可)。
(列出计算式即可)。
(1)基态Ga原子的价层电子排布式为
(2)
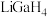 是一种温和的还原剂,其可由
是一种温和的还原剂,其可由 和过量的LiH反应制得:
和过量的LiH反应制得: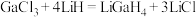 。
。①已知
 的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为②
 在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:
在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:③
 的立体构型为
的立体构型为(3)一种含镓的药物合成方法如图所示:

 键的物质的量为
键的物质的量为②化合物Ⅱ中Ga的配位数为
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:

A. B.
B.  C.
C. 
 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为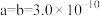 m,
m,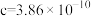 m,则其密度为
m,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2023-02-27更新
|
950次组卷
|
5卷引用:2022年重庆高考真题化学试题变式题(结构与性质)
(已下线)2022年重庆高考真题化学试题变式题(结构与性质)广东省广州市等3地东莞市东华松山湖高级中学有限公司等2校2023届高三下学期一模化学试题(已下线)专题20 结构与性质(已下线)结构与性质陕西省商洛市2023-2024学年高三下学期第四次模拟考试理综试题-高中化学



