真题
名校
1 . 我国科学家发现一种钒配合物Ⅰ可以充当固氮反应的催化剂,反应过程中经历的中间体包括Ⅱ和Ⅲ。
(1)配合物Ⅰ中钒的配位原子有4种,它们是_______ 。
(2)配合物Ⅰ中,R′代表芳基, 空间结构呈角形,原因是
空间结构呈角形,原因是_______ 。
(3)配合物Ⅱ中,第一电离能最大的配位原子是_______ 。
(4)配合物Ⅱ和Ⅲ中,钒的化合价分别为 和
和 ,配合物Ⅱ、Ⅲ和
,配合物Ⅱ、Ⅲ和 三者中,两个氮原子间键长最长的是
三者中,两个氮原子间键长最长的是_______ 。
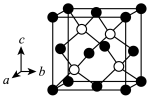
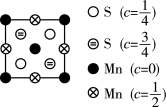
(5)近年来,研究人员发现含钒的锑化物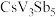 在超导方面表现出潜在的应用前景。
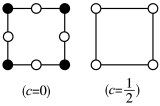
在超导方面表现出潜在的应用前景。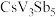 晶胞如图1所示,晶体中包含由V和Sb组成的二维平面(见图2)。
晶胞如图1所示,晶体中包含由V和Sb组成的二维平面(见图2)。_______ 。锑和磷同族,锑原子基态的价层电子排布式为_______ 。
②晶体中少部分钒原子被其它元素(包括Ti、Nb、Cr、Sn)原子取代,可得到改性材料。下列有关替代原子说法正确的是_______ 。
a.有 或
或 价态形式 b.均属于第四周期元素
价态形式 b.均属于第四周期元素
c.均属于过渡元素 d.替代原子与原离子的离子半径相近
( 代表单键、双键或叁键)
代表单键、双键或叁键)
(1)配合物Ⅰ中钒的配位原子有4种,它们是
(2)配合物Ⅰ中,R′代表芳基,
 空间结构呈角形,原因是
空间结构呈角形,原因是(3)配合物Ⅱ中,第一电离能最大的配位原子是
(4)配合物Ⅱ和Ⅲ中,钒的化合价分别为
 和
和 ,配合物Ⅱ、Ⅲ和
,配合物Ⅱ、Ⅲ和 三者中,两个氮原子间键长最长的是
三者中,两个氮原子间键长最长的是(5)近年来,研究人员发现含钒的锑化物
 在超导方面表现出潜在的应用前景。
在超导方面表现出潜在的应用前景。 晶胞如图1所示,晶体中包含由V和Sb组成的二维平面(见图2)。
晶胞如图1所示,晶体中包含由V和Sb组成的二维平面(见图2)。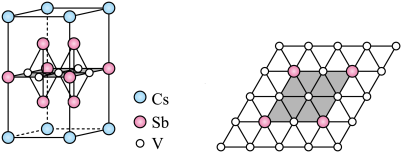
②晶体中少部分钒原子被其它元素(包括Ti、Nb、Cr、Sn)原子取代,可得到改性材料。下列有关替代原子说法正确的是
a.有
 或
或 价态形式 b.均属于第四周期元素
价态形式 b.均属于第四周期元素c.均属于过渡元素 d.替代原子与原离子的离子半径相近
您最近一年使用:0次
2023-08-03更新
|
4403次组卷
|
4卷引用:重庆市万州第二高级中学2023-2024学年高三上学期7月月考化学试题
名校
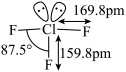
2 . 三氟化氯 是极强氧化剂,能发生自耦电离:
是极强氧化剂,能发生自耦电离: ,其分子结构如图所示,下列推测不合理的是
,其分子结构如图所示,下列推测不合理的是
 是极强氧化剂,能发生自耦电离:
是极强氧化剂,能发生自耦电离: ,其分子结构如图所示,下列推测不合理的是
,其分子结构如图所示,下列推测不合理的是
A. 分子的中心原子有5对价层电子对 分子的中心原子有5对价层电子对 |
B. 离子空间构型为正四面体 离子空间构型为正四面体 |
C. 与 与 反应生成 反应生成 和 和 |
D. 比 比 更易发生自耦电离 更易发生自耦电离 |
您最近一年使用:0次
2023-07-12更新
|
566次组卷
|
3卷引用:重庆市万州第二高级中学2023-2024学年高三上学期8月月考化学试题
名校
解题方法
3 . 卤素元素比较活泼,能形成种类繁多的化合物,回答下列问题:
(1)F,Cl,Br,I形成简单氢化物的沸点由高到低的顺序为:____________________________ 。
(2)卤素可形成很多酸根离子,如 、
、 、
、 、
、 等,
等, 的空间结构为
的空间结构为______________ 。
(3)卤素元素之间还能形成很多卤素互化物,如 ,
, ,
,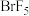 ,
,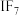 等,根据I与Cl原子的电负性大小关系写成
等,根据I与Cl原子的电负性大小关系写成 在水中水解的化学方程式:
在水中水解的化学方程式:_____________________ 。
(4)在石墨烯膜上可以制备Cl元素和Ca元素形成的新型的化合物,如图是俯视图和侧视图,俯视图中小六元环为石墨层,大六元环含3个大球(石墨六元环中心正上方)和3个小球(石墨层部分碳原子正上方),请写出该化合物的化学式______________ ,在石墨六元环中心正上方的元素为______________ 。(填元素符号)

(5)卤素还被称为成盐元素,某种卤素盐的晶体中含有Cl,Cs与Au三种元素,其最简式为 ,Au有两种化合价,其一个晶胞结构如图所示,未标出的两个小球为金(Au)离子,底面正方形边长为
,Au有两种化合价,其一个晶胞结构如图所示,未标出的两个小球为金(Au)离子,底面正方形边长为 ,高为
,高为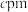 ,高分为两段,分别为
,高分为两段,分别为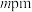 和
和 ,
, 的相对分子质量为M,回答下列问题:
的相对分子质量为M,回答下列问题:
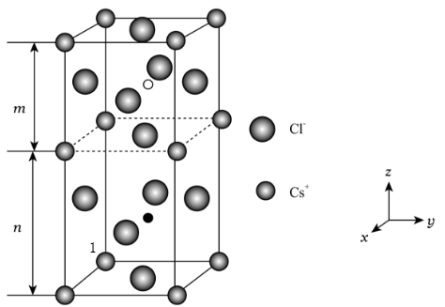
①如果 与
与 相等,
相等, 和
和 构成
构成______________ 晶胞。
②金(Au)离子和 的配位数分别为
的配位数分别为__________ 和__________ 。
③如图所示,以原子1为原点建立坐标系,写出晶胞内部小白球的分数坐标______ 。
(1)F,Cl,Br,I形成简单氢化物的沸点由高到低的顺序为:
(2)卤素可形成很多酸根离子,如
 、
、 、
、 、
、 等,
等, 的空间结构为
的空间结构为(3)卤素元素之间还能形成很多卤素互化物,如
 ,
, ,
,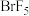 ,
, 等,根据I与Cl原子的电负性大小关系写成
等,根据I与Cl原子的电负性大小关系写成 在水中水解的化学方程式:
在水中水解的化学方程式:(4)在石墨烯膜上可以制备Cl元素和Ca元素形成的新型的化合物,如图是俯视图和侧视图,俯视图中小六元环为石墨层,大六元环含3个大球(石墨六元环中心正上方)和3个小球(石墨层部分碳原子正上方),请写出该化合物的化学式

(5)卤素还被称为成盐元素,某种卤素盐的晶体中含有Cl,Cs与Au三种元素,其最简式为
 ,Au有两种化合价,其一个晶胞结构如图所示,未标出的两个小球为金(Au)离子,底面正方形边长为
,Au有两种化合价,其一个晶胞结构如图所示,未标出的两个小球为金(Au)离子,底面正方形边长为 ,高为
,高为 ,高分为两段,分别为
,高分为两段,分别为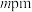 和
和 ,
, 的相对分子质量为M,回答下列问题:
的相对分子质量为M,回答下列问题:
①如果
 与
与 相等,
相等, 和
和 构成
构成②金(Au)离子和
 的配位数分别为
的配位数分别为③如图所示,以原子1为原点建立坐标系,写出晶胞内部小白球的分数坐标
您最近一年使用:0次
名校
解题方法
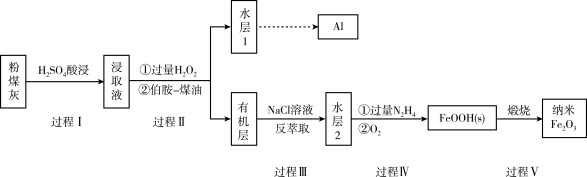
4 . 我国煤储量居世界第一,对煤的综合、高效、无害化利用是二十一世纪能源战略的重要组成部分,利用含铁元素的粉煤灰获得纳米 等重要物质的工艺流程如下。
等重要物质的工艺流程如下。
已知:i:伯胺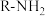 能与
能与 反应:
反应: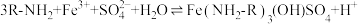 生成易溶于煤油的产物。
生成易溶于煤油的产物。
ii: 在水溶液中易与
在水溶液中易与 反应:
反应: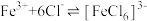
(1)写出过程I中 发生反应的离子方程式:
发生反应的离子方程式:_______ 。
(2)过程Ⅱ加入过量 的作用是
的作用是_______ 。
(3)过程Ⅱ加入伯胺-煤油对浸取液进行分离,该操作的名称是_______ 。
(4)从化学平衡角度解释过程Ⅱ利用 溶液进行反萃取的原理:
溶液进行反萃取的原理:_______ 。
(5) 具有碱性,可与
具有碱性,可与 结合生成
结合生成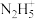 ,其中氮原子的杂化类型为
,其中氮原子的杂化类型为_______ 从结构角度分析,它比 配位能力
配位能力_______ (“强”或“弱”),过程Ⅳ中先用过量的 将水层2中
将水层2中 转化为
转化为 并生成
并生成 ,反应的离子方程式为
,反应的离子方程式为_______ ,得到的 再被
再被 氧化为
氧化为 。
。
(6)以 溶液作为吸收剂对燃煤烟气进行一体化“脱硫”、“脱硝”。控制溶液的
溶液作为吸收剂对燃煤烟气进行一体化“脱硫”、“脱硝”。控制溶液的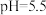 ,将烟气中的
,将烟气中的 、
、 转化为
转化为 、
、 ,均为放热反应。
,均为放热反应。
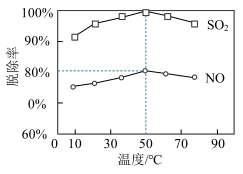
①一定时间内,温度对硫、硝脱除率的影响曲线如下图, 的脱除率高于
的脱除率高于 ,可能的原因是
,可能的原因是_______ (写出1种即可)。
②烟气中 和
和 的体积比为
的体积比为 ,
, 时的脱除率见图,则此吸收液中烟气转化生成的
时的脱除率见图,则此吸收液中烟气转化生成的 和
和 的物质的量之比为
的物质的量之比为_______ 。
 等重要物质的工艺流程如下。
等重要物质的工艺流程如下。
已知:i:伯胺
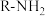 能与
能与 反应:
反应: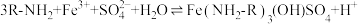 生成易溶于煤油的产物。
生成易溶于煤油的产物。ii:
 在水溶液中易与
在水溶液中易与 反应:
反应: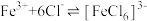
(1)写出过程I中
 发生反应的离子方程式:
发生反应的离子方程式:(2)过程Ⅱ加入过量
 的作用是
的作用是(3)过程Ⅱ加入伯胺-煤油对浸取液进行分离,该操作的名称是
(4)从化学平衡角度解释过程Ⅱ利用
 溶液进行反萃取的原理:
溶液进行反萃取的原理:(5)
 具有碱性,可与
具有碱性,可与 结合生成
结合生成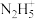 ,其中氮原子的杂化类型为
,其中氮原子的杂化类型为 配位能力
配位能力 将水层2中
将水层2中 转化为
转化为 并生成
并生成 ,反应的离子方程式为
,反应的离子方程式为 再被
再被 氧化为
氧化为 。
。(6)以
 溶液作为吸收剂对燃煤烟气进行一体化“脱硫”、“脱硝”。控制溶液的
溶液作为吸收剂对燃煤烟气进行一体化“脱硫”、“脱硝”。控制溶液的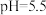 ,将烟气中的
,将烟气中的 、
、 转化为
转化为 、
、 ,均为放热反应。
,均为放热反应。①一定时间内,温度对硫、硝脱除率的影响曲线如下图,
 的脱除率高于
的脱除率高于 ,可能的原因是
,可能的原因是②烟气中
 和
和 的体积比为
的体积比为 ,
, 时的脱除率见图,则此吸收液中烟气转化生成的
时的脱除率见图,则此吸收液中烟气转化生成的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2023-05-28更新
|
570次组卷
|
2卷引用:重庆市万州第二高级中学2023-2024学年高三上学期8月月考化学试题
5 . 2022 年北京大学课题组发现[4+2)]反应并对反应机理进行研究,该[4+2]反应是通过在环丁酮2-位引入乙烯基取代作为导向基诱导铑对环丁酮的碳-碳键活化,同时酮碳基可以与路易斯酸配位,进一步活化环丁酮的碳-碳键。这一协同催化模式选择性切断羰基与季碳中心之间的碳-碳键,不仅成功地构建六元环系,还成功拓展到烷基及多种电子效应的芳基上,大部分底物都具有中等到良好的收率,对氰基,酮羰基,酯基及酰胺等官能团具有良好的兼容性,机理如下图,下列表述错误的是
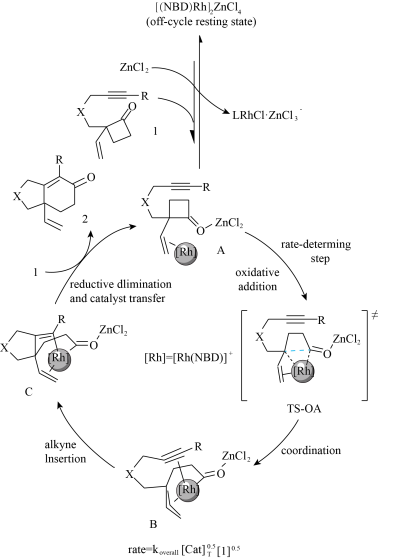

| A.生成TS-OA发生了氧化加成,这一步被认为是反应的决速步 |
| B.其中ZnCl2被认为具有促进C-C的活化和原位生成活性阳离子铑的作用 |
| C.由TS-OA生成B有配位键的形成 |
| D.该反应为合成4元环物质提供一种新的 C-C耦合方式 |
您最近一年使用:0次
2023-05-25更新
|
521次组卷
|
3卷引用:重庆市万州第二高级中学2023-2024学年高三上学期7月月考化学试题
名校
6 . 虎年春晚上,一段舞蹈诗剧《只此青绿》生动还原了北宋画家王希孟的绝世之作——《千里江山图》。它之所以能够流传千年依旧色彩艳丽,璀璨夺目,与其绘制方法和所用颜料有关。
(1)绘制时,第一遍先用水墨画好山水画,第二遍上红色(赭石色),赭石主含 ,为后面的绿色做铺垫,冷暖对比,使其更鲜亮。基态氧原子核外电子的运动状态有
,为后面的绿色做铺垫,冷暖对比,使其更鲜亮。基态氧原子核外电子的运动状态有______ 种,三价铁离子的价电子排布式为______ 。
(2)第三遍上石绿(孔雀石或绿松石),孔雀石主要成分是碱式碳酸铜,化学式为: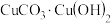 。碳酸根离子的空间构型为
。碳酸根离子的空间构型为______ 。
(3)绿松石是一种含水的铜铝酸盐矿物,属于磷酸盐矿物,化学式为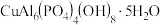 。直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为
。直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为______ 。

(4)第四遍还要再叠加一层绿,第五遍上青色,石青(蓝铜矿或青金石),蓝铜矿化学式为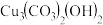 ,青金石是碱性铝硅酸盐矿物,化学式为
,青金石是碱性铝硅酸盐矿物,化学式为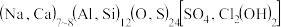 。
。
① 与
与 结合能生成
结合能生成 ,
, 中配位原子为
中配位原子为______ (用元素符号表示) 。
②根据价层电子对互斥理论, 、
、 、
、 的气态分子中,中心原子价层电子对数不同于其他分子的是
的气态分子中,中心原子价层电子对数不同于其他分子的是______ 。 的熔沸点比
的熔沸点比 高很多,主要原因是
高很多,主要原因是______ 。
(5)《千里江山图》中还用到了黄色的颜料䧳黄,雌黄的主要成分是 ,有剧毒。
,有剧毒。
① 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为______ 。
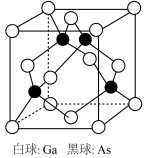
②砷化镓晶胞如图所示,若两个镓原子之间的最近距离为d pm, 代表阿伏加德罗常数的值,则砷化镓晶体的密度
代表阿伏加德罗常数的值,则砷化镓晶体的密度
______  。(用含d,
。(用含d, 的代数式表示)
的代数式表示)
(1)绘制时,第一遍先用水墨画好山水画,第二遍上红色(赭石色),赭石主含
 ,为后面的绿色做铺垫,冷暖对比,使其更鲜亮。基态氧原子核外电子的运动状态有
,为后面的绿色做铺垫,冷暖对比,使其更鲜亮。基态氧原子核外电子的运动状态有(2)第三遍上石绿(孔雀石或绿松石),孔雀石主要成分是碱式碳酸铜,化学式为:
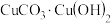 。碳酸根离子的空间构型为
。碳酸根离子的空间构型为(3)绿松石是一种含水的铜铝酸盐矿物,属于磷酸盐矿物,化学式为
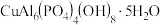 。直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为
。直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为
(4)第四遍还要再叠加一层绿,第五遍上青色,石青(蓝铜矿或青金石),蓝铜矿化学式为
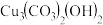 ,青金石是碱性铝硅酸盐矿物,化学式为
,青金石是碱性铝硅酸盐矿物,化学式为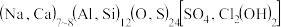 。
。①
 与
与 结合能生成
结合能生成 ,
, 中配位原子为
中配位原子为②根据价层电子对互斥理论,
 、
、 、
、 的气态分子中,中心原子价层电子对数不同于其他分子的是
的气态分子中,中心原子价层电子对数不同于其他分子的是 的熔沸点比
的熔沸点比 高很多,主要原因是
高很多,主要原因是(5)《千里江山图》中还用到了黄色的颜料䧳黄,雌黄的主要成分是
 ,有剧毒。
,有剧毒。①
 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为②砷化镓晶胞如图所示,若两个镓原子之间的最近距离为d pm,
 代表阿伏加德罗常数的值,则砷化镓晶体的密度
代表阿伏加德罗常数的值,则砷化镓晶体的密度
 。(用含d,
。(用含d, 的代数式表示)
的代数式表示)
您最近一年使用:0次
2022-09-22更新
|
1146次组卷
|
4卷引用:重庆南开中学2023届高三上学期9月月考化学试题
重庆南开中学2023届高三上学期9月月考化学试题浙江省东阳中学2023届高三浙江省普通高校招生选考科目考试仿真训练化学试题(已下线)专题02 物质结构专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)浙江省温州市普通高中2023届高三下学期第二次适应性考试化学试题变式题(结构与性质)
名校
解题方法
7 . 锰是第四周期第ⅦB族元素。锰钢异常坚硬,且具抗冲击性能,是制造枪栓、保险库、挖掘机械和铁路设施的理想材料;锰也是人体的重要微量元素。请根据所学知识,回答下列问题。
(1)锰的原子序数为__________ ,基态锰原子的外围电子排布图为__________ 。
(2)下列锰的化合物中,磁矩μ=5.92的是__________ 。(已知μ= ,其中n为金属离子核外的单电子数。)
,其中n为金属离子核外的单电子数。)
A.KMnO4 B.K2MnO4 C.MnCl2 D.MnO2
(3)水杨醛缩邻氨基苯酚又被称为“锰试剂”,可与Mn2+形成黄色的配合物。锰试剂的结构如图所示,其分子中可能与Mn2+形成配位键的原子有__________ ;锰试剂__________ (填“能”或“不能”)形成分子内氢键。

(4)锰试剂分子中,原子采取的杂化方式不涉及_________ (填“sp”“sp2”或“sp3”)杂化;分子中除氢以外的元素,第一电离能从小到大的顺序为__________ (用元素符号表示)。
(5)阿拉班达石(alabandite)是一种属于立方晶系的硫锰矿,其晶胞如下左图(a)所示(●=Mn,○=S)。在该晶胞中,硫原子的堆积方式为__________ 。
(6)已知阿拉班达石晶胞中最近两个硫原子之间的距离为d Å(1 Å=10-10 m),晶体密度为 ρg·cm-3,则阿伏加德罗常数的值NA=__________ (要求化简)。
(7)为更清晰地展示晶胞中原子所在的位置,晶体化学中常将立体晶胞结构转化为平面投影图。例如沿阿拉班达石晶胞的c轴将原子投影到ab平面,即可用上右图(b)表示。下列晶体结构投影图可能表示MnS2晶体的是__________ 。
(1)锰的原子序数为
(2)下列锰的化合物中,磁矩μ=5.92的是
 ,其中n为金属离子核外的单电子数。)
,其中n为金属离子核外的单电子数。)A.KMnO4 B.K2MnO4 C.MnCl2 D.MnO2
(3)水杨醛缩邻氨基苯酚又被称为“锰试剂”,可与Mn2+形成黄色的配合物。锰试剂的结构如图所示,其分子中可能与Mn2+形成配位键的原子有

(4)锰试剂分子中,原子采取的杂化方式不涉及
(5)阿拉班达石(alabandite)是一种属于立方晶系的硫锰矿,其晶胞如下左图(a)所示(●=Mn,○=S)。在该晶胞中,硫原子的堆积方式为
|
|
图(a) | 图(b) |
(7)为更清晰地展示晶胞中原子所在的位置,晶体化学中常将立体晶胞结构转化为平面投影图。例如沿阿拉班达石晶胞的c轴将原子投影到ab平面,即可用上右图(b)表示。下列晶体结构投影图可能表示MnS2晶体的是
A. | B. |
C. | D. |
您最近一年使用:0次
2020-12-21更新
|
1407次组卷
|
4卷引用:重庆市西南大学附属中学校2021届第三次月考化学试题
重庆市西南大学附属中学校2021届第三次月考化学试题(已下线)大题08 物质结构与性质(一)(选修)-【考前抓大题】备战2021年高考化学(全国通用)2021年河北省高考化学试卷变式题10-18题河北省衡水市第十四中学2022-2023学年高二下学期第二次考试化学试题
解题方法
8 . [化学—选修3:物质结构与性质]
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为_______________ ,D原子的杂化类型为_______________ 。
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点________ (填“大于”、“小于”、或“等于”)N的沸点,原因是_______________ 。
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为____________________ 。写出相应的化学反应方程式:____________________ 。
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:__________________ ,加入乙醇的作用是________________ 。
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为__________ 。若两个氧原子间最短距离为apm,列式计算晶体G的密度_______ g.cm-3
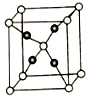
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为

您最近一年使用:0次
9 . 下表为周期表的一部分,表中所列的字母分别代表一种化学元素。
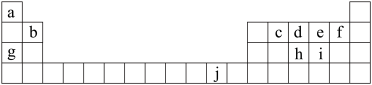
用化学用语回答下列问题:
(1)写出元素f的基态原子核外电子排布式______________ ;
(2)在C6a6分子中,元素c为______________ 杂化,该分子是___________ 分子(填“极性”或“非极性”)。
(3)ci2分子的电子式为_____________ ,ci2与ce2比较,沸点较高的是______________ (写分子式);
(4)第一电离能:h_________ i;电负性:g___________ b(填“>”、“<”或“=”)。
(5)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述正确的是___________ ;
(6)将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液,显深蓝色的离子是_____________ ,写出蓝色沉淀溶解在氨水中的离子方程式______________ ;

用化学用语回答下列问题:
(1)写出元素f的基态原子核外电子排布式
(2)在C6a6分子中,元素c为
(3)ci2分子的电子式为
(4)第一电离能:h
(5)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述正确的是
| A.j位于元素周期表中第四周期、IB族,属于ds区元素 |
| B.d的基态原子中,2p能级为半充满,属于p区元素 |
| C.最外层电子排布式为4s1,一定属于IA族 |
| D.最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族 |
您最近一年使用:0次