名校
解题方法
1 . Mn和Ni是构成合金钢金(即铁合金)的主要元素。请回答下列问题:
(1)Mn在元素周期表中的位置___________ ,
(2)Ni的价电子排布式为___________ ,属于___________ 区的元素
(3)过硫酸盐(S2O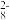 )氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示:
)氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示: ,H2S2O8中S的轨道杂化方式为
,H2S2O8中S的轨道杂化方式为___________
(4)NiO、FeO属于___________ 晶体,已知r(Ni2+)>r(Fe2+),则熔点NiO___________ FeO(填“<"或“>’’),原因是___________ 。
(5)铜盐是自然界中重要的盐,向CuSO4熔液中加入过量稀氨水,产物的外界离子的空间构型为___________ ,Cu(NO3)2中的化学键类型___________
(6)已知CuCl的晶胞结构如图所示:晶胞中C、D两原子核间距为298pm,阿伏加德罗常数的值为NA,则该晶体密度为___________ g·cm-3(列出计算式即可)。

(1)Mn在元素周期表中的位置
(2)Ni的价电子排布式为
(3)过硫酸盐(S2O
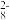 )氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示:
)氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示: ,H2S2O8中S的轨道杂化方式为
,H2S2O8中S的轨道杂化方式为(4)NiO、FeO属于
(5)铜盐是自然界中重要的盐,向CuSO4熔液中加入过量稀氨水,产物的外界离子的空间构型为
(6)已知CuCl的晶胞结构如图所示:晶胞中C、D两原子核间距为298pm,阿伏加德罗常数的值为NA,则该晶体密度为

您最近一年使用:0次
解题方法
2 . 现有 A、B、C、D、E、F六种原子序数依次增大的前四周期元素的原子,其中A在周期表中原子半径最小,光化学烟雾与B的氧化物有关,C的最高价氧化物具有两性,D的原子半径在同周期中最小(稀有气体除外),E位于周期表中第七列,F的最外层只有一个电子。
(1)写出E的价层电子排布式___________ ,BA3的中心原子的杂化方式为___________ 。
(2)已知CD3在453K时就能升华,则其晶体为___________ 晶体;实验研究表明,其蒸气存在二聚体,请写出其二聚体的结构式___________ 。
(3)已知CoD3与BA3可形成多种化合物,如CoD3•6BA3、CoD3•5BA3、CoD3•4BA3;将1mol三种化合物溶于水,然后向三种溶液中加入足量的硝酸银溶液,立即产生氯化银沉淀,其物质的量分别为3、2、1mol。请根据实验事实用配合物的形式写出CoD3•5BA3的化学式___________ ,其中心离子提供的空轨道数为___________ 。
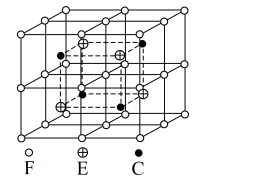
(4)现已发现很多种具有形状记忆效应的合金,其中一种具有磁性形状记忆的合金由C、E、F组成,其晶胞如图所示,其化学式为___________ ,设其晶胞边长为a nm,其密度为___________ g·cm-3.(列出计算表达式)
(1)写出E的价层电子排布式
(2)已知CD3在453K时就能升华,则其晶体为
(3)已知CoD3与BA3可形成多种化合物,如CoD3•6BA3、CoD3•5BA3、CoD3•4BA3;将1mol三种化合物溶于水,然后向三种溶液中加入足量的硝酸银溶液,立即产生氯化银沉淀,其物质的量分别为3、2、1mol。请根据实验事实用配合物的形式写出CoD3•5BA3的化学式
(4)现已发现很多种具有形状记忆效应的合金,其中一种具有磁性形状记忆的合金由C、E、F组成,其晶胞如图所示,其化学式为

您最近一年使用:0次
名校
3 . 下图为N2分子在催化剂作用下发生一系列转化的示意图,下列叙述正确的是( )
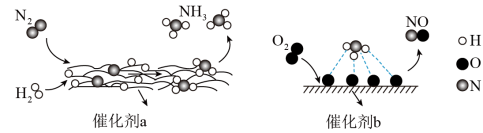
| A.若N≡N键能是a kJ·mol-1,H—H键能是b kJ·mol-1,H—N键能是c kJ·mol-1,则每生成2 mol NH3,放出(6c-a-3b)kJ热量 |
| B.NH3分子和H2O分子的中心原子杂化类型不同 |
| C.催化剂a、b表面均发生了极性共价键的断裂 |
| D.在催化剂b作用下发生转化得到的两种生成物,均为直线形分子 |
您最近一年使用:0次
2020-11-27更新
|
351次组卷
|
5卷引用:江苏省连云港市2021届高三上学期期中调研化学试题
名校
解题方法
4 . 元素周期表中第三、四周期的某些元素在生产、生活中有着广泛的应用。
(1)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
①钒的价电子排布图是___ ;
②V2O5是一种常见的催化剂,常用在SO2转化为SO3的反应中。V2O5的结构式如图所示,则V2O5分子中σ键和π键数目之比为___ ;若将V2O5溶解在NaOH溶液中,可得到锐酸钠(Na3VO4),该盐中阴离子的立体构型为___ ,写出与VO 空间构型相同的一种阳离子
空间构型相同的一种阳离子___ (填化学式)。

(2)氯化铝在有机化学中有很广泛的应用。无水氯化铝在177.8℃时升华,蒸气或熔融状态以Al2Cl6形式存在。下列关于氯化铝的推断错误的是___ 。
a.氯化铝是分子晶体
B.Al2Cl6中Al是sp2杂化
c.氯化铝难溶于有机溶剂
D.Al2Cl6中存在配位键
(3)P及其化合物是重要的工业原料。已知:第一电子亲和能(E1)是指元素的气态基态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ•mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如表:
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因___ 。
(4)GaN是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaN晶胞结构如图2所示。已知六棱柱底边边长为acm,高为bcm,阿伏加德罗常数的值为NA.则晶胞中Ga原子采用的密堆积方式为___ ,每个Ga原子周围距离最近的Ga原子数目为___ ;GaN的密度为___ g/cm-3(用含a、b、NA的代数式表示)。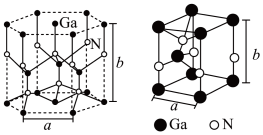
(1)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
①钒的价电子排布图是
②V2O5是一种常见的催化剂,常用在SO2转化为SO3的反应中。V2O5的结构式如图所示,则V2O5分子中σ键和π键数目之比为
 空间构型相同的一种阳离子
空间构型相同的一种阳离子
(2)氯化铝在有机化学中有很广泛的应用。无水氯化铝在177.8℃时升华,蒸气或熔融状态以Al2Cl6形式存在。下列关于氯化铝的推断错误的是
a.氯化铝是分子晶体
B.Al2Cl6中Al是sp2杂化
c.氯化铝难溶于有机溶剂
D.Al2Cl6中存在配位键
(3)P及其化合物是重要的工业原料。已知:第一电子亲和能(E1)是指元素的气态基态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ•mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如表:
| 元素 | Al | Si | P | S | Cl |
| E1(kJ•mol-1) | 42.5 | 134 | 72.0 | 200 | 349 |
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因
(4)GaN是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaN晶胞结构如图2所示。已知六棱柱底边边长为acm,高为bcm,阿伏加德罗常数的值为NA.则晶胞中Ga原子采用的密堆积方式为

您最近一年使用:0次
名校
5 . 由B、N、O、Fe等元素组成的新型材料有着广泛用途。
(1)基态Fe2+离子的核外电子有_______ 种空间运动状态。
(2)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过反应: 3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。
①与上述化学方程式有关的叙述不正确的是_________ 。(填标号)
A H3BNH3与(HB=NH)3分子中B原子的杂化类型相同
B CH4、H2O、CO2分子空间构型分别是:正四面体形、角形、直线形
C 第一电离能:N>O>C>B
D 化合物A中存在配位键
②1个(HB=NH)3分子中有_______ 个σ键。
(3)立方氮化硼(BN)是具有广泛应用的新型无机非金属材料,结构和硬度都与金刚石相似。
①立方氮化硼熔点比金刚石低,原因是______________ 。
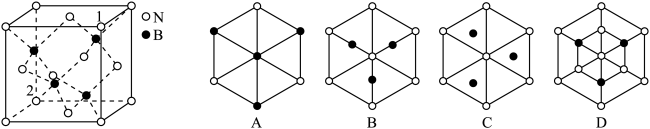
②立方氮化硼晶胞如下图所示,则立方氮化硼晶胞沿着1→2方向的体对角线垂直在纸平面上的投影图应该是图_____ (从A~D图中选填)。
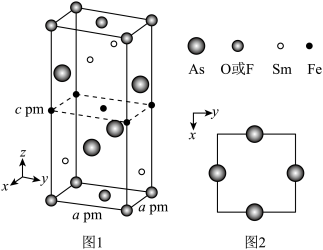
(4)一种O(或F)、Fe、As、Sm形成的四方结构超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为____ 。通过测定密度ρ(g/cm3)和晶胞参数,可以计算该物质的x值,完成它们关系的表达式:x=_____ 。
(1)基态Fe2+离子的核外电子有
(2)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过反应: 3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。
①与上述化学方程式有关的叙述不正确的是
A H3BNH3与(HB=NH)3分子中B原子的杂化类型相同
B CH4、H2O、CO2分子空间构型分别是:正四面体形、角形、直线形
C 第一电离能:N>O>C>B
D 化合物A中存在配位键
②1个(HB=NH)3分子中有
(3)立方氮化硼(BN)是具有广泛应用的新型无机非金属材料,结构和硬度都与金刚石相似。
①立方氮化硼熔点比金刚石低,原因是
②立方氮化硼晶胞如下图所示,则立方氮化硼晶胞沿着1→2方向的体对角线垂直在纸平面上的投影图应该是图

(4)一种O(或F)、Fe、As、Sm形成的四方结构超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为

您最近一年使用:0次
名校
解题方法
6 . 钴是生产耐热合金、硬质合金、防腐合金、磁性合金和各种钻盐的重要原料。Co2+和味唑(咪唑的结构为 ,用“im” 表示)形成的某种离子[Co(im)6]2+的结构为
,用“im” 表示)形成的某种离子[Co(im)6]2+的结构为
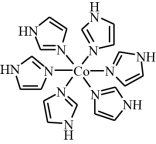 。
。
(1)基态Co原子的价电子轨道表达式为________ 。
(2)已知咪唑分子中N原子都为sp2杂化。下列关于咪唑的说法正确的是__________ 。
A咪唑分子中所有原子位于同一平面上
B味唑具有一定的碱性,与盐酸反应的化学方程式为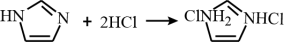
C1 mol咪唑分子中σ键数目为6NA
D味唑分子中只有极性共价键
(3)分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。味唑分子中的大π键可表示为
)。味唑分子中的大π键可表示为________ 。
(4)离子[Co(im)6]2+中N与Co之间的化学键类型是________ ,判断的理由是________ 。
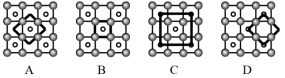
(5)某科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构,如图所示。图中用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是__________ (填字母)。
(6)钻的一种化合物的晶胞结构如图所示:
 。
。
①已知A点的原子坐标参数为(0,0,0),C点为( ,
, ,
, ),则B点的原子坐标参数为
),则B点的原子坐标参数为_______ 。
②已知晶胞参数a=0.55nm,则该晶体的密度为__________ g/cm3(列出计算表达式即可)。
 ,用“im” 表示)形成的某种离子[Co(im)6]2+的结构为
,用“im” 表示)形成的某种离子[Co(im)6]2+的结构为 。
。(1)基态Co原子的价电子轨道表达式为
(2)已知咪唑分子中N原子都为sp2杂化。下列关于咪唑的说法正确的是
A咪唑分子中所有原子位于同一平面上
B味唑具有一定的碱性,与盐酸反应的化学方程式为
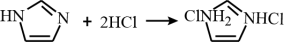
C1 mol咪唑分子中σ键数目为6NA
D味唑分子中只有极性共价键
(3)分子中的大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。味唑分子中的大π键可表示为
)。味唑分子中的大π键可表示为(4)离子[Co(im)6]2+中N与Co之间的化学键类型是
(5)某科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构,如图所示。图中用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是

(6)钻的一种化合物的晶胞结构如图所示:
 。
。 ①已知A点的原子坐标参数为(0,0,0),C点为(
 ,
, ,
, ),则B点的原子坐标参数为
),则B点的原子坐标参数为②已知晶胞参数a=0.55nm,则该晶体的密度为
您最近一年使用:0次
名校
解题方法
7 . 我国已经形成对全球稀土产业链的统治力,在稀土开采技术方面,我国遥遥领先,无论是美国的芒廷帕斯还是澳大利亚的稀土矿山,均为在我国技术的参与下才实现产出。我国科学家最早研究的是稀土—钴化合物的结构。请回答下列问题:
(1)钴原子的价层电子排布图为_________ ,其 层上共有
层上共有______ 个不同运动状态的电子。
(2)酞菁钴结构如图所示。
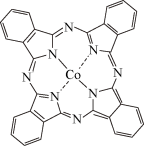
①酞菁钴中氮原子的杂化类型是________ 。
②酞菁钴中所含元素原子的第一电离能由大到小的顺序是_________ 。
③酞菁钴中三种非金属元素原子的电负性由小到大的顺序为________ 。
④酞菁钴中 、
、 原子分别与
原子分别与 原子可形成
原子可形成 和
和 ,
, 的沸点高于
的沸点高于 ,其原因是
,其原因是________ 。
(3)稀土钴系 永磁合金的六方晶胞结构如右图所示【晶体结构可看成如图(a)、(b)两种原子层交替堆积排列而成图(c)】。已知同一原子层的
永磁合金的六方晶胞结构如右图所示【晶体结构可看成如图(a)、(b)两种原子层交替堆积排列而成图(c)】。已知同一原子层的 的最近距离为
的最近距离为 ,不同原子层间
,不同原子层间 的最近距离为
的最近距离为 。
。

① 永磁合金的化学式为
永磁合金的化学式为_________ 。
②已知阿伏加 德罗常数的值为 ,则该合金的密度
,则该合金的密度 为
为________  (相对原子质量
(相对原子质量 ,
,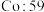 )。
)。
(1)钴原子的价层电子排布图为
 层上共有
层上共有(2)酞菁钴结构如图所示。

①酞菁钴中氮原子的杂化类型是
②酞菁钴中所含元素原子的第一电离能由大到小的顺序是
③酞菁钴中三种非金属元素原子的电负性由小到大的顺序为
④酞菁钴中
 、
、 原子分别与
原子分别与 原子可形成
原子可形成 和
和 ,
, 的沸点高于
的沸点高于 ,其原因是
,其原因是(3)稀土钴系
 永磁合金的六方晶胞结构如右图所示【晶体结构可看成如图(a)、(b)两种原子层交替堆积排列而成图(c)】。已知同一原子层的
永磁合金的六方晶胞结构如右图所示【晶体结构可看成如图(a)、(b)两种原子层交替堆积排列而成图(c)】。已知同一原子层的 的最近距离为
的最近距离为 ,不同原子层间
,不同原子层间 的最近距离为
的最近距离为 。
。
①
 永磁合金的化学式为
永磁合金的化学式为②已知阿伏加 德罗常数的值为
 ,则该合金的密度
,则该合金的密度 为
为 (相对原子质量
(相对原子质量 ,
,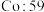 )。
)。
您最近一年使用:0次
名校
解题方法
8 . 中国较早时期就有炼铜、炼锌技术的记录,铜、锌元素也是人体必需的微量元素之一。回答下列问题:
(1)基态Cu原子核外的最高能层符号是______ ,基态Zn原子的价电子排布式为______ 。
(2)硫酸铜溶于氨水形成[Cu(NH3)4]SO4溶液,组成[Cu(NH3)4]SO4的元素中,非金属元素的电负性由大到小排序为_____ 。
(3)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是______ 。
(4)[Zn(CN)4]2-发生反应:4HCHO+[Zn(CN)4]2-+4H++4H2O═[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子的杂化类型是___ 。
②与H2O分子互为等电子体的阴离子为_____ 。(只答一种)
③[Zn(CN)4]2-中Zn2+与碳原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为____ 。
(5)金属锌晶体的晶胞如图所示,若锌原子的半径为r nm,则金属锌晶体的空间利用率是______ (用含r、π的代数式表示)。

(1)基态Cu原子核外的最高能层符号是
(2)硫酸铜溶于氨水形成[Cu(NH3)4]SO4溶液,组成[Cu(NH3)4]SO4的元素中,非金属元素的电负性由大到小排序为
(3)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是
(4)[Zn(CN)4]2-发生反应:4HCHO+[Zn(CN)4]2-+4H++4H2O═[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子的杂化类型是
②与H2O分子互为等电子体的阴离子为
③[Zn(CN)4]2-中Zn2+与碳原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为
(5)金属锌晶体的晶胞如图所示,若锌原子的半径为r nm,则金属锌晶体的空间利用率是

您最近一年使用:0次
名校
9 . 短周期主族元素X、Y、Z、O、P、Q原子序数依次增大。其中X与其它元素都不在同一周期,且X的最高正价与最低负价之和为0;Y是自然界中形成化合物最多元素,Z第一电离能高于同周期的Y和O;P、Q的基态原子核外电子排布分别有3个、1个单电子。
(1)P、Q的简单离子半径由大到小的顺序为_____ (用离子符号表示)。
(2)P与Q两元素可形成1:3的化合物甲,写出甲分子的结构式_________ 该分子空间构型为________ ,该分子式是_________ (填“极性“或“非极性”) 分子。
(3)Y、Z分别与X可形成原子个数比为1:2的6原子二元化合物乙、丙,乙、丙分子中Y、Z的杂化类型依次为___________ ; 已知常温下,乙为气体,丙为液体,丙的熔沸点高于乙的最主要原因是_______ 。
(1)P、Q的简单离子半径由大到小的顺序为
(2)P与Q两元素可形成1:3的化合物甲,写出甲分子的结构式
(3)Y、Z分别与X可形成原子个数比为1:2的6原子二元化合物乙、丙,乙、丙分子中Y、Z的杂化类型依次为
您最近一年使用:0次
名校
解题方法
10 . 硼酸晶体的结构如图所示,下列说法不正确的是
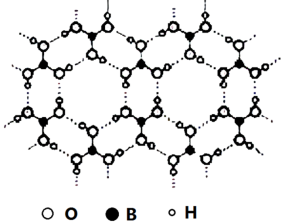

| A.硼酸分子含三个羟基,硼酸属于三元酸 |
| B.硼酸晶体熔融时主要破坏作用力为氢键 |
| C.硼酸分子中含有两种极性键 |
| D.硼酸分子中硼原子采用sp2杂化 |
您最近一年使用:0次



