解题方法
1 . 化学作为一门基础自然科学,在材料科学、生命科学、能源科学等诸多领域发挥着重要作用,其中铁和铜是两种应用广泛的元素。
(1)基态铁原子的价电子轨道表达式为_____ 。
(2)磁性材料铁氧体在制备时常加入 CH3COONa、尿素[CO(NH2)2]等碱性物质。尿素分子中所含元素的电负性由小到大的顺序是_____ ,1mol 尿素分子中含有的 σ 键数目为_____ 。 CH3COONa 中碳原子的杂化类型为_________ 。
(3)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则 Fe(CO)5的晶体类型是_____ ,写出与CO互为等电子体的分子的电子式_____ (任写一种)。
(4)CuO在高温时分解为 O2和 Cu2O,请从阳离子的结构来说明在高温时,Cu2O比 CuO更稳定的原因_____ 。
(5)磷青铜是含少量锡、磷的铜合金,某磷青铜晶胞结构如图所示:
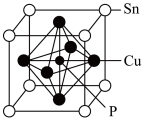
①其化学式为_____ 。
②若晶体密度为 8.82g/cm3,则最近的 Cu原子核间距为_____ pm(用含 NA的代数式表示)。
(1)基态铁原子的价电子轨道表达式为
(2)磁性材料铁氧体在制备时常加入 CH3COONa、尿素[CO(NH2)2]等碱性物质。尿素分子中所含元素的电负性由小到大的顺序是
(3)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则 Fe(CO)5的晶体类型是
(4)CuO在高温时分解为 O2和 Cu2O,请从阳离子的结构来说明在高温时,Cu2O比 CuO更稳定的原因
(5)磷青铜是含少量锡、磷的铜合金,某磷青铜晶胞结构如图所示:

①其化学式为
②若晶体密度为 8.82g/cm3,则最近的 Cu原子核间距为
您最近一年使用:0次
名校
解题方法
2 . 碳和硫是高中化学学习的两种重要非金属元素
(1)下列C原子的电子排布式表达的状态中能量最高的是_____ 。
A 1s22s22p2 B.1s22s22px12py1 C.1s22s22px12pz1 D.1s22s12px12py12pz1_____ 。
(4)已知CS2晶体结构类似于干冰。CS2晶体中与每个CS2分子距离最近且等距的CS2分子有_____ 个。推测CS2晶体密度与冰的晶体密度较大的为_____ 。可能的原因是_____ 。又知CS2晶体中晶胞参数是apm,NA表示阿伏加德罗常数的值,晶体密度为_____ g/cm3(用含a、NA等符号的表达式表示)。
(5)Na2S是高子晶体,其晶格能可通过图的Born﹣Haber循环计算得到。_____ kJ/mol,Na2S的晶格能为_____ kJ/mol。(用图中给出的符号作答)
(1)下列C原子的电子排布式表达的状态中能量最高的是
A 1s22s22p2 B.1s22s22px12py1 C.1s22s22px12pz1 D.1s22s12px12py12pz1
(2)硫有一种结构为 的分子(灰球代表硫原子)。其中硫原子杂化方式为
的分子(灰球代表硫原子)。其中硫原子杂化方式为
(4)已知CS2晶体结构类似于干冰。CS2晶体中与每个CS2分子距离最近且等距的CS2分子有
(5)Na2S是高子晶体,其晶格能可通过图的Born﹣Haber循环计算得到。

您最近一年使用:0次
2020-03-08更新
|
167次组卷
|
3卷引用:辽宁省实验中学、大连八中、大连二十四中、鞍山一中、东北育才学校2018-2019学年高三上学期末考试化学试题
辽宁省实验中学、大连八中、大连二十四中、鞍山一中、东北育才学校2018-2019学年高三上学期末考试化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编重庆市乌江新高考协作体2023-2024学年高二下学期5月期中考试化学试题
名校
解题方法
3 . 本题涉及部分铜及其化合物的相关结构问题的考查,请回答下列问题。
(1)写出基态Cu2+的核外电子排布式:________ 。Cu的同周期元素中,与铜原子最外层电子数相等的元素原子还有___________ (用元素符号表示)。
(2)从原子结构角度分析高温Cu2O比CuO稳定的原因是___________ 。
(3)[Cu(NH3)2]Ac可用于合成氨工业中的铜洗工序,除去进入合成塔前混合气中的CO(CO能使催化剂中毒)。
①Ac表示CH3COO-,Ac中碳原子的杂化方式为________ 。
②[Cu(NH3)2]Ac能够结合CO的原因是________ 。
(4)铜原子与氯原子形成化合物的晶胞如图所示(黑球代表铜原子,白球表示氯原子)。

①已知铜和氯的电负性分别为1.9和3.0,则铜与氯形成的化合物属于________ 填(“离子”或“共价”)化合物。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为( ,
, ,1),则原子2和3的坐标分别为
,1),则原子2和3的坐标分别为___________ 、__________ 。
③已知该晶体的密度为ρg/cm3,阿伏加 德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为_____________ pm(只写计算式)。
(1)写出基态Cu2+的核外电子排布式:
(2)从原子结构角度分析高温Cu2O比CuO稳定的原因是
(3)[Cu(NH3)2]Ac可用于合成氨工业中的铜洗工序,除去进入合成塔前混合气中的CO(CO能使催化剂中毒)。
①Ac表示CH3COO-,Ac中碳原子的杂化方式为
②[Cu(NH3)2]Ac能够结合CO的原因是
(4)铜原子与氯原子形成化合物的晶胞如图所示(黑球代表铜原子,白球表示氯原子)。

①已知铜和氯的电负性分别为1.9和3.0,则铜与氯形成的化合物属于
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为(
 ,
, ,1),则原子2和3的坐标分别为
,1),则原子2和3的坐标分别为③已知该晶体的密度为ρg/cm3,阿伏加 德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为
您最近一年使用:0次
名校
解题方法
4 . 离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+由H、C、N三种元素组成,结构如图甲所示。回答下列问题:
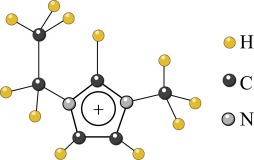
甲
(1)碳原子价层电子的轨道表达式为_____ ,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为_____ 形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是_____ 。NH3比PH3的沸点高,原因是_____ 。氮元素的第一电离能比同周期相邻元素都大的原因是_____ 。
(3)EMIM+中,碳原子的杂化轨道类型为_____ 。
(4)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于______ 晶体,其中硼原子的配位数为_____ 。已知:立方氮化硼密度为dg/cm3,B原子半径为xpm,N原子半径为ypm,阿伏加 德罗常数的值为NA,则该晶胞中原子的空间利用率为_____ (列出化简后的计算式)。


甲
(1)碳原子价层电子的轨道表达式为
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是
(3)EMIM+中,碳原子的杂化轨道类型为
(4)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于

您最近一年使用:0次
名校
解题方法
5 . 新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高电子层符号为__ ,该电子层具有的原子轨道数为__ 。
②LiBH4由Li+和BH4-构成,BH4-的立体构型是__ ,B原子的杂化轨道类型是___ 。
③Li、B元素的电负性由小到大的顺序为___ 。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+__ H-(填“>”“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
M是__ 族元素。
(3)图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和涂“ ”分别标明B与N的相对位置
”分别标明B与N的相对位置___ 。

(4)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,H-的半径为__ ,NaH的理论密度是__ g·cm-3(保留3个有效数字)。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高电子层符号为
②LiBH4由Li+和BH4-构成,BH4-的立体构型是
③Li、B元素的电负性由小到大的顺序为
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
| I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和涂“
 ”分别标明B与N的相对位置
”分别标明B与N的相对位置
(4)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,H-的半径为
您最近一年使用:0次
名校
解题方法
6 . 氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。请回答下列问题:
(1)第一电离能介于B和N之间的第二周期的元素共有________ 种。
(2)基态K+离子电子占据最高能级的电子云轮廓图为_________ 形。
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下BeCl2以双聚分子存在,其结构式为________ ,其中Be原子的电子排布图为_________ 。
(4)四氟硼酸钠(NaBF4)是纺织工业的催化剂。其阴离子的中心原子的杂化轨道类型为_________ 。四氟硼酸钠中存在_______ (填序号):
a. 氢键 b. 范德华力 c. 离子键 d. 配位键 e. σ键 f. π键
(1)第一电离能介于B和N之间的第二周期的元素共有
(2)基态K+离子电子占据最高能级的电子云轮廓图为
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下BeCl2以双聚分子存在,其结构式为
(4)四氟硼酸钠(NaBF4)是纺织工业的催化剂。其阴离子的中心原子的杂化轨道类型为
a. 氢键 b. 范德华力 c. 离子键 d. 配位键 e. σ键 f. π键
您最近一年使用:0次
2020-01-24更新
|
1101次组卷
|
5卷引用:山东省济宁市2019-2020学年高二上学期期末考试化学试题
名校
解题方法
7 . 建造舰船需要大量的新型材料,舰船的甲板也要耐高温且外壳要耐腐蚀,而镍铬铁合金就是具有高强度、耐高温、耐腐蚀等优良性能的特种钢,这类特种钢中含有碳、硅、氧、氮、磷等元素。
(1)保铬钢抗腐蚀性能强, 基态原子的价电子排布
基态原子的价电子排布_________ ,为铬元素在周期表中_________ 区。
(2) 能形成多种配离子,如
能形成多种配离子,如 、
、 和
和 等,
等, 中心原子的配位数是
中心原子的配位数是_________ ,与 互为等电子体的分子为
互为等电子体的分子为_________ 。
(3)舰船甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中 原子杂化方式为
原子杂化方式为________ 杂化。
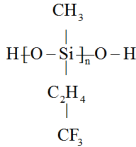
(4)碳和硅可化合成碳化硅, 晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的,但是碳化硅的熔点低于金刚石,原因是
晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的,但是碳化硅的熔点低于金刚石,原因是_________ 。
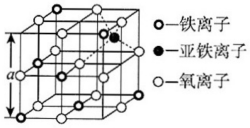
(5)铁的氧化物之一是 ,从
,从 中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?
中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?________ (填“是”或“否”);该立方体是不是 的晶胞?
的晶胞?_________ (填“是”或“否”);立方体中铁离子处于氧离子围成的_________ (填空间结构)空隙;根据上图计算 晶体的密度为
晶体的密度为_________ 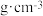 。(图
。(图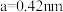 ,计算结果保留两位有效数字)
,计算结果保留两位有效数字)
(1)保铬钢抗腐蚀性能强,
 基态原子的价电子排布
基态原子的价电子排布(2)
 能形成多种配离子,如
能形成多种配离子,如 、
、 和
和 等,
等, 中心原子的配位数是
中心原子的配位数是 互为等电子体的分子为
互为等电子体的分子为(3)舰船甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中
 原子杂化方式为
原子杂化方式为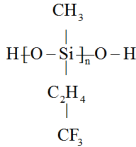
(4)碳和硅可化合成碳化硅,
 晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的,但是碳化硅的熔点低于金刚石,原因是
晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的,但是碳化硅的熔点低于金刚石,原因是(5)铁的氧化物之一是
 ,从
,从 中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?
中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积? 的晶胞?
的晶胞? 晶体的密度为
晶体的密度为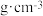 。(图
。(图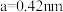 ,计算结果保留两位有效数字)
,计算结果保留两位有效数字)
您最近一年使用:0次
2014高三·全国·专题练习
名校
解题方法
8 . A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是_______ (用对应的元素符号表示);基态D原子的电子排布式为______ 。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取_____ 杂化;BC3-的立体构型为______ (用文字描述)。
(3)1mol AB-中含有的π键个数为______ 。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比______ 。
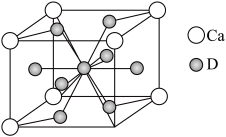
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________ (填数值);氢在合金中的密度为________ (保留2位有效数字)。
(1)A、B、C的第一电离能由小到大的顺序是
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取
(3)1mol AB-中含有的π键个数为
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比

(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=
您最近一年使用:0次
2019-12-08更新
|
181次组卷
|
12卷引用:【全国百强校】重庆市第一中学校2019届高三上学期期中考试理科综合化学试题
【全国百强校】重庆市第一中学校2019届高三上学期期中考试理科综合化学试题(已下线)2014年高考化学指导冲关 第13练物质结构与性质练习卷(已下线)2014届高考化学二轮专题冲刺第16讲 物质结构与性质练习卷(已下线)2014高考名师推荐化学--预测172016届四川省新津中学高三下学期入学考试化学试卷2018版化学(苏教版)高考总复习专题十一课时跟踪训练--微粒间作用力与物质性质【市级联考】湖北省鄂州市2019届高三上学期期中考试理科综合化学试题(已下线)第11章 单元测试(测)-《2020年高考一轮复习讲练测》江西省临川一中2020届高三上学期第一次联考化学试题广东省梅州市五华县2020届高三上学期期末质检理综化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编(已下线)第十一章 能力提升检测卷-2021年高考化学一轮复习讲练测
名校
解题方法
9 . 下列叙述中正确的个数有( )
①氧原子的电子排布图: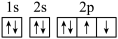 最外层违背了泡利原理
最外层违背了泡利原理
②处于最低能量状态原子叫基态原子,1s22s22px1→1s22s22py1过程中形成的是发射光谱
③所有元素中,氟的第一电离能最大
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
⑥金属元素的电负性均小于1.8
⑦主族元素的电负性越大,其元素原子的第一电离能一定越大
⑧在任何情况下,都是σ键比π键强度大
①氧原子的电子排布图:
 最外层违背了泡利原理
最外层违背了泡利原理②处于最低能量状态原子叫基态原子,1s22s22px1→1s22s22py1过程中形成的是发射光谱
③所有元素中,氟的第一电离能最大
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
⑥金属元素的电负性均小于1.8
⑦主族元素的电负性越大,其元素原子的第一电离能一定越大
⑧在任何情况下,都是σ键比π键强度大
| A.0个 | B.1个 | C.2个 | D.3个 |
您最近一年使用:0次
2019-11-27更新
|
1604次组卷
|
9卷引用:安徽省毛坦厂中学2019-2020学年高二上学期期中考试化学试题
安徽省毛坦厂中学2019-2020学年高二上学期期中考试化学试题重庆市实验中学校2021-2022学年高二下学期第一次月考化学试题重庆市南华中学校2021-2022学年高二3月月考化学试题重庆实验外国语学校2021-2022学年高二下学期6月月考化学试题(人教版2019)选择性必修2 阶段性综合评估测试卷(一)海南热带海洋学院附属中学2021-2022学年高二下学期第一次月考化学试题湖南省永州市祁阳县第四中学2022-2023学年高二下学期第一次段考化学试题黑龙江省齐齐哈尔市第八中学校2022-2023学年高二下学期期中考试化学试题陕西省西安市陕西师范大学附属中学渭北中学2022-2023学年高二下学期5月月考化学试题
名校
10 . [化学——选修3:物质结构与性质]
具有自主知识产权、中国制造的C919,是一款与波音737MAX同等体量的民用飞机。制造C919需要大量的合金材料,其中包括钢,钢是现代社会的物质基础,钢中除含有铁外还含有碳和少量不可避免的硅、锰、磷、硫等元素。请回答下列有关问题:
(1)基态Mn2+的价电子排布图为___________ 。
(2)NO2的立体构型名称为___________ ,其中心原子的杂化方式为___________ 。
(3)写出和CN-互为等电子体的一种分子的电子式___________ 。
(4)铵盐大多易分解,NH4F和NH4Br两种盐中较难分解的是______ (填化学式);理由是_______ 。
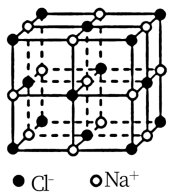
(5) 氧化亚铁晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为apm,该晶体的密度ρ=___________________ g·cm-3 (列出计算式即可,用NA表示阿伏加 德罗常数的值)。
具有自主知识产权、中国制造的C919,是一款与波音737MAX同等体量的民用飞机。制造C919需要大量的合金材料,其中包括钢,钢是现代社会的物质基础,钢中除含有铁外还含有碳和少量不可避免的硅、锰、磷、硫等元素。请回答下列有关问题:

(1)基态Mn2+的价电子排布图为
(2)NO2的立体构型名称为
(3)写出和CN-互为等电子体的一种分子的电子式
(4)铵盐大多易分解,NH4F和NH4Br两种盐中较难分解的是
(5) 氧化亚铁晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为apm,该晶体的密度ρ=
您最近一年使用:0次
2019-11-18更新
|
150次组卷
|
2卷引用:重庆铜梁县第一中学2020届高三上学期期中考试理综化学试题



