名校
解题方法
1 . 元素化学是化学的基石,不同的元素往往呈现出五彩缤纷的特性。回答下列问题:
(1) 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为___________ ,还原性由强到弱的顺序为___________ 。
(2)H、B、N、F四种元素可形成一种离子化合物,其阴、阳离子均为正四面体结构,阴、阳离子各含其中两种元素,写出一种符合要求的化学式:___________ 。
(3)金元素形成的部分离子氧化性很强,化学家们推测可能和“6s惰性电子对”效应有关,即失去6s电子对的离子会具有很强的氧化性。下列选项中具有此效应的离子是__________。
(4)已知 ,
, 的N原子杂化方式为
的N原子杂化方式为___________ ;比较键角 :
: 中的
中的
___________  中的
中的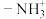 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),请说明理由
”),请说明理由___________ 。
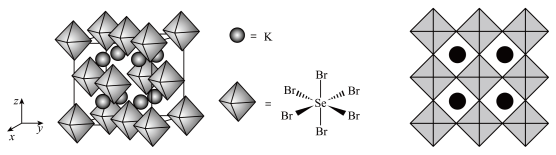
(5) 的晶体结构可以看成Ⅰ型结构和Ⅱ型结构的组合,已知Ⅰ型结构中As原子在内部,每个Ⅰ型和Ⅱ型结构可近似为边长相等的立方体。一个
的晶体结构可以看成Ⅰ型结构和Ⅱ型结构的组合,已知Ⅰ型结构中As原子在内部,每个Ⅰ型和Ⅱ型结构可近似为边长相等的立方体。一个 的晶胞中Ⅰ型结构和Ⅱ型结构的比例是
的晶胞中Ⅰ型结构和Ⅱ型结构的比例是___________ ;___________ 。
②设X的最简式的式量为 ,晶体密度为
,晶体密度为 ,则化合物X中相邻K之间的最短距离为
,则化合物X中相邻K之间的最短距离为___________ nm(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)
 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为(2)H、B、N、F四种元素可形成一种离子化合物,其阴、阳离子均为正四面体结构,阴、阳离子各含其中两种元素,写出一种符合要求的化学式:
(3)金元素形成的部分离子氧化性很强,化学家们推测可能和“6s惰性电子对”效应有关,即失去6s电子对的离子会具有很强的氧化性。下列选项中具有此效应的离子是__________。
A. | B.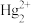 | C. | D. |
(4)已知
 ,
, 的N原子杂化方式为
的N原子杂化方式为 :
: 中的
中的
 中的
中的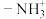 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),请说明理由
”),请说明理由(5)
 的晶体结构可以看成Ⅰ型结构和Ⅱ型结构的组合,已知Ⅰ型结构中As原子在内部,每个Ⅰ型和Ⅱ型结构可近似为边长相等的立方体。一个
的晶体结构可以看成Ⅰ型结构和Ⅱ型结构的组合,已知Ⅰ型结构中As原子在内部,每个Ⅰ型和Ⅱ型结构可近似为边长相等的立方体。一个 的晶胞中Ⅰ型结构和Ⅱ型结构的比例是
的晶胞中Ⅰ型结构和Ⅱ型结构的比例是
②设X的最简式的式量为
 ,晶体密度为
,晶体密度为 ,则化合物X中相邻K之间的最短距离为
,则化合物X中相邻K之间的最短距离为 )。
)。
您最近一年使用:0次
解题方法
2 . 硫代硫酸钠(Na2S2O3)是常见的分析试剂和还原剂,常温下为无色晶体,易溶于水,遇酸反应。某学习小组在实验室制备Na2S2O3并探究其性质。回答下列问题:
实验I:利用高温加热绿矾(FeSO4•7H2O)生成的SO2气体制备Na2S2O3的实验装置如图所示。

已知:i.2FeSO4•7H2O Fe2O3+SO2↑+SO3↑+14H2O↑;
Fe2O3+SO2↑+SO3↑+14H2O↑;
ii.2Na2S+2Na2CO3+4SO2+H2O=3Na2S2O3+2NaHCO3;
iii.Na2S和Na2CO3的混合溶液用煮沸过的蒸馏水配制。

(1)依据FeSO4•7H2O的结构示意图
①比较键角H2O_____ SO (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②FeSO4•7H2O晶体中含有的化学键为_____ (填标号)。
a.离子键 b.共价键 c.氢键 d.配位键
(2)实验过程的操作步骤包括:
a.检查装置气密性,加入药品
b.在m处连接盛有NaOH溶液的容器,关闭活塞K3,打开活塞K1、K2通入一段时间N2
c.打开活塞K1、K2,关闭活塞K3,通入一段时间N2
d.C装置溶液pH约为8时停止加热
e.关闭活塞K1、K2,打开活塞K3,加热绿矾
f.将锥形瓶中溶液进行一系列操作,得到纯净的Na2S2O3晶体
①以上步骤按先后顺序的正确排序为a→______ →f(填标号)。
②B装置中使用冰水浴的作用是_____ 。
③C装置溶液pH约为8时停止加热的原因是_____ 。
实验Ⅱ:探究Na2S2O3的性质
小组同学查阅资料获得信息:Na2S2O3中硫元素的化合价分别为-2价和+6价。
实验步骤:用实验I获得的Na2S2O3晶体配制0.2mol/LNa2S2O3溶液,取出4mL,向溶液中加入1mL饱和氯水(pH=2.4),溶液立即出现浑浊,对溶液出现浑浊的原因提出假设。
假设1:氯水中Cl2氧化了Na2S2O3中的-2价硫生成S单质
假设2:Na2S2O3在酸性(H+)条件下反应生成S单质
(3)实验验证:a、b试管均盛有4mL0.2mol/LNa2S2O3溶液,操作如图所示。

①向试管b中滴加的试剂应为______ 。
②依据现象分析,出现浑浊的主要原因是_____ (用离子方程式表示)。
实验I:利用高温加热绿矾(FeSO4•7H2O)生成的SO2气体制备Na2S2O3的实验装置如图所示。

已知:i.2FeSO4•7H2O
 Fe2O3+SO2↑+SO3↑+14H2O↑;
Fe2O3+SO2↑+SO3↑+14H2O↑;ii.2Na2S+2Na2CO3+4SO2+H2O=3Na2S2O3+2NaHCO3;
iii.Na2S和Na2CO3的混合溶液用煮沸过的蒸馏水配制。

(1)依据FeSO4•7H2O的结构示意图
①比较键角H2O
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②FeSO4•7H2O晶体中含有的化学键为
a.离子键 b.共价键 c.氢键 d.配位键
(2)实验过程的操作步骤包括:
a.检查装置气密性,加入药品
b.在m处连接盛有NaOH溶液的容器,关闭活塞K3,打开活塞K1、K2通入一段时间N2
c.打开活塞K1、K2,关闭活塞K3,通入一段时间N2
d.C装置溶液pH约为8时停止加热
e.关闭活塞K1、K2,打开活塞K3,加热绿矾
f.将锥形瓶中溶液进行一系列操作,得到纯净的Na2S2O3晶体
①以上步骤按先后顺序的正确排序为a→
②B装置中使用冰水浴的作用是
③C装置溶液pH约为8时停止加热的原因是
实验Ⅱ:探究Na2S2O3的性质
小组同学查阅资料获得信息:Na2S2O3中硫元素的化合价分别为-2价和+6价。
实验步骤:用实验I获得的Na2S2O3晶体配制0.2mol/LNa2S2O3溶液,取出4mL,向溶液中加入1mL饱和氯水(pH=2.4),溶液立即出现浑浊,对溶液出现浑浊的原因提出假设。
假设1:氯水中Cl2氧化了Na2S2O3中的-2价硫生成S单质
假设2:Na2S2O3在酸性(H+)条件下反应生成S单质
(3)实验验证:a、b试管均盛有4mL0.2mol/LNa2S2O3溶液,操作如图所示。

①向试管b中滴加的试剂应为
②依据现象分析,出现浑浊的主要原因是
您最近一年使用:0次
解题方法
3 . 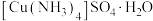 (硫酸四氨合铜晶体)是一种重要化工产品,一种制备流程如图所示。
(硫酸四氨合铜晶体)是一种重要化工产品,一种制备流程如图所示。

回答下列问题:
(1)基态 原子的价层电子排布图为
原子的价层电子排布图为___________ 。
(2) 的键角
的键角___________ (填“大于”“小于”或“等于”) 的键角。
的键角。
(3)已知: 、
、 的结构式如图所示,
的结构式如图所示, (硫酸)、
(硫酸)、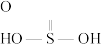 (亚硫酸)。
(亚硫酸)。
①浓硫酸浓度一般为 ,由稀硫酸较难得到无水硫酸,其主要原因是
,由稀硫酸较难得到无水硫酸,其主要原因是______________________ 。
②含氧酸中 键极性越强,酸性越强。
键极性越强,酸性越强。 的酸性比
的酸性比 的强,其原因是
的强,其原因是______________________ 。
(4) 是非极性分子,
是非极性分子, 是极性溶剂,但是
是极性溶剂,但是 能溶于水,其主要原因是
能溶于水,其主要原因是______________________ 。在 ,溶液中加入乙醇析出晶体,由此推知分子极性:
,溶液中加入乙醇析出晶体,由此推知分子极性:
_______ 水(填“大于”或“小于”)。
(5)浓硫酸中 价S具有强氧化性,而稀硫酸中S稳定,不表现强氧化性,其主要原因是
价S具有强氧化性,而稀硫酸中S稳定,不表现强氧化性,其主要原因是______________________ (从结构稳定性角度分析)。
(6)铜单质晶胞如图所示。与铜最近且等距离的铜原子有______ 个。铜晶胞中原子空间利用率为___________ 。

提示:顶点铜原子与面心铜原子紧邻,原子空间利用率等于原子总体积与晶胞体积之比。
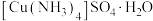 (硫酸四氨合铜晶体)是一种重要化工产品,一种制备流程如图所示。
(硫酸四氨合铜晶体)是一种重要化工产品,一种制备流程如图所示。
回答下列问题:
(1)基态
 原子的价层电子排布图为
原子的价层电子排布图为(2)
 的键角
的键角 的键角。
的键角。(3)已知:
 、
、 的结构式如图所示,
的结构式如图所示, (硫酸)、
(硫酸)、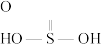 (亚硫酸)。
(亚硫酸)。①浓硫酸浓度一般为
 ,由稀硫酸较难得到无水硫酸,其主要原因是
,由稀硫酸较难得到无水硫酸,其主要原因是②含氧酸中
 键极性越强,酸性越强。
键极性越强,酸性越强。 的酸性比
的酸性比 的强,其原因是
的强,其原因是(4)
 是非极性分子,
是非极性分子, 是极性溶剂,但是
是极性溶剂,但是 能溶于水,其主要原因是
能溶于水,其主要原因是 ,溶液中加入乙醇析出晶体,由此推知分子极性:
,溶液中加入乙醇析出晶体,由此推知分子极性:
(5)浓硫酸中
 价S具有强氧化性,而稀硫酸中S稳定,不表现强氧化性,其主要原因是
价S具有强氧化性,而稀硫酸中S稳定,不表现强氧化性,其主要原因是(6)铜单质晶胞如图所示。与铜最近且等距离的铜原子有

提示:顶点铜原子与面心铜原子紧邻,原子空间利用率等于原子总体积与晶胞体积之比。
您最近一年使用:0次
解题方法
4 . 重铬酸钾( ),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为
),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为 ,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备
,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备 的步骤如下:
的步骤如下:
步骤I.熔融氧化
将6g铬铁矿与4g氯酸钾在研钵中混合均匀,取碳酸钠和氢氧化钠各4.5g于仪器A中混匀后,小火熔融,再将矿粉分批加入坩埚中并不断搅拌。用煤气灯强热,灼烧30~35min,稍冷几分钟,加水,过滤,得滤液i,滤渣中含红棕色固体。
步骤Ⅱ.中和除杂
将滤液i用稀硫酸调pH为7~8,加热煮沸3min后,趁热过滤,用少量蒸馏水洗涤残渣,得滤液ii。
步骤Ⅲ.结晶
将滤液ii转移至蒸发皿中,用6 硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
步骤Ⅳ.纯度测定
利用库仑滴定法测定 固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算
固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算 的浓度公式为
的浓度公式为 (F为96500
(F为96500 ,N为1个
,N为1个 转化为
转化为 时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度
时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度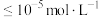 ,则认为该微粒已除尽。
,则认为该微粒已除尽。

回答下列问题:
(1)仪器A为_______(填标号)。
(2)若用 代替
代替 ,则理论上转化1mol
,则理论上转化1mol  所需
所需 的体积(标准状况,单位为L)是所消耗
的体积(标准状况,单位为L)是所消耗 物质的量的
物质的量的_______ 倍。
(3)步骤I中“分批加入”的目的是_______ 。
(4)若步骤Ⅱ中“调pH至3~4”的不良后果是_______ 。
(5)进一步提纯步骤Ⅲ所得晶体的方法是_______ 。
(6)探究pH对 溶液的氧化性强弱的影响。
溶液的氧化性强弱的影响。
(7) 与浓盐酸反应可制得
与浓盐酸反应可制得 ,已知部分卤素单质的键能如下表:
,已知部分卤素单质的键能如下表:
试解释键能 的原因
的原因_______ 。
(8) 固体样品的纯度为
固体样品的纯度为_______ (用含m的式子表示)。
 ),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为
),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为 ,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备
,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备 的步骤如下:
的步骤如下:步骤I.熔融氧化
将6g铬铁矿与4g氯酸钾在研钵中混合均匀,取碳酸钠和氢氧化钠各4.5g于仪器A中混匀后,小火熔融,再将矿粉分批加入坩埚中并不断搅拌。用煤气灯强热,灼烧30~35min,稍冷几分钟,加水,过滤,得滤液i,滤渣中含红棕色固体。
步骤Ⅱ.中和除杂
将滤液i用稀硫酸调pH为7~8,加热煮沸3min后,趁热过滤,用少量蒸馏水洗涤残渣,得滤液ii。
步骤Ⅲ.结晶
将滤液ii转移至蒸发皿中,用6
 硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。步骤Ⅳ.纯度测定
利用库仑滴定法测定
 固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算
固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算 的浓度公式为
的浓度公式为 (F为96500
(F为96500 ,N为1个
,N为1个 转化为
转化为 时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度
时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度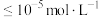 ,则认为该微粒已除尽。
,则认为该微粒已除尽。
回答下列问题:
(1)仪器A为_______(填标号)。
| A.普通坩埚 | B. 坩埚 坩埚 | C.氮化硅坩埚 | D.石英坩埚 |
 代替
代替 ,则理论上转化1mol
,则理论上转化1mol  所需
所需 的体积(标准状况,单位为L)是所消耗
的体积(标准状况,单位为L)是所消耗 物质的量的
物质的量的(3)步骤I中“分批加入”的目的是
(4)若步骤Ⅱ中“调pH至3~4”的不良后果是
(5)进一步提纯步骤Ⅲ所得晶体的方法是
(6)探究pH对
 溶液的氧化性强弱的影响。
溶液的氧化性强弱的影响。| 实验操作 | 实验现象 | 实验结论 |
向酸化的 溶液中加入一定量甲醇 溶液中加入一定量甲醇 | 溶液形成蓝紫色溶液,并产生无色无味的气体 | |
向碱化的 溶液中加入相同量甲醇 溶液中加入相同量甲醇 | 酸性条件下 溶液的氧化性更强 溶液的氧化性更强 |
 与浓盐酸反应可制得
与浓盐酸反应可制得 ,已知部分卤素单质的键能如下表:
,已知部分卤素单质的键能如下表:| 化学键 | F-F | C1-Cl | Br-Br |
键能/( ) ) | 157 | 242.7 | 193.7 |
 的原因
的原因(8)
 固体样品的纯度为
固体样品的纯度为
您最近一年使用:0次
解题方法
5 . 硫、硒、碲的化合物在农药、石油工业、矿物开采、萃取及有机合成等领域的应用广泛。回答下列问题:
(1)基态Se原子的最高能级组的电子排布式为
(2)下列有关氧族元素单质及其化合物的性质说法正确的是_______。
A.氧族元素气态氢化物的稳定性按 、 、 、 、 、 、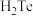 的顺序依次减弱 的顺序依次减弱 |
B.其氢化物中的键长按 、 、 、 、 、 、 的顺序依次减小 的顺序依次减小 |
C.其阴离子的还原性按 、 、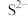 、 、 、 、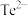 的顺序依次增强 的顺序依次增强 |
D.其最高价氧化物的水化物酸性按 、 、 、 、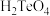 顺序依次增强 顺序依次增强 |
 分子结构式为
分子结构式为 中含有π键的数目为
中含有π键的数目为 结构有两种,已知硫氰酸(
结构有两种,已知硫氰酸( )的沸点低于异硫氰酸(
)的沸点低于异硫氰酸( ),其原因是
),其原因是(4)
 分子结构如图所示,已知键角
分子结构如图所示,已知键角 为
为 ,
, 为
为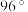 ,则
,则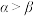 的原因主要是
的原因主要是
(5)二硒键和二硫键是重要的光响应动态共价键(在特定条件下断开并能复原的化学键),其光响应原理可用如图表示,已知光的波长与其能量成反比,则图中实现光响应的波长:
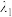
 ,(填“>”或“<”或“=”),其原因是
,(填“>”或“<”或“=”),其原因是
您最近一年使用:0次
2023-07-29更新
|
167次组卷
|
2卷引用:山东省青岛市莱西市2022-2023学年高二下学期4月期中考试化学试题
名校
解题方法
6 . 氮族元素可以形成多种多样的化合物,回答下列问题:
(1)基态As原子的价电子的轨道表示式是______ 。
(2)叠氮酸(HN3)常用于引爆剂,可用联氨( )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
______ 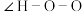 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: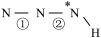 ,
, 为
为 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①______ ②。
(3)乙胺( )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是______ 。
(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是______ 。

(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为 ,晶胞参数为
,晶胞参数为 ,
, 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是______ ,n原子的分数坐标是______ ,若阿伏加德罗常数值为 ,该晶体密度是
,该晶体密度是______  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态As原子的价电子的轨道表示式是
(2)叠氮酸(HN3)常用于引爆剂,可用联氨(
 )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
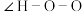 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: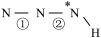 ,
, 为
为 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①(3)乙胺(
 )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是

(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为
 ,晶胞参数为
,晶胞参数为 ,
, 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是 ,该晶体密度是
,该晶体密度是 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-05-21更新
|
510次组卷
|
2卷引用:山东省潍坊市2024届高三下学期二模化学试题
解题方法
7 . 卤族元素是形成化合物的常见元素。请回答:
(1)含Na、Cl、Al三种元素的某化合物,其晶体部分结构如图所示。其化学式是___________ ,晶体类型是___________ 。错误 的是___________。
(3)一种比率光生探针M与铜离子配位,可用于小鼠脑内Cu(Ⅱ)的高时空分辨率动态成像。反应如下所示:___________ 。
②M中键角∠F-B-F___________ BF3中键角∠F-B-F(填“>”、“<”、“=”),请说明理由___________ 。
(4)在水中,氟化氢是一种弱酸,但氟化氢却是酸性很强的溶剂,其酸度与无水硫酸相当,能够给予氟化氢质子的化合物是很少的。如HNO3在HF溶剂中存在如下反应: 。则HNO3在HF溶剂中呈
。则HNO3在HF溶剂中呈___________ (填“酸性”、“中性”、“碱性”)
(1)含Na、Cl、Al三种元素的某化合物,其晶体部分结构如图所示。其化学式是

A.电负性: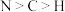 | B.第一电离能: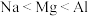 |
C.离子半径: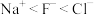 | D. 的简化电子排布式: 的简化电子排布式: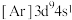 |
(3)一种比率光生探针M与铜离子配位,可用于小鼠脑内Cu(Ⅱ)的高时空分辨率动态成像。反应如下所示:
②M中键角∠F-B-F
(4)在水中,氟化氢是一种弱酸,但氟化氢却是酸性很强的溶剂,其酸度与无水硫酸相当,能够给予氟化氢质子的化合物是很少的。如HNO3在HF溶剂中存在如下反应:
 。则HNO3在HF溶剂中呈
。则HNO3在HF溶剂中呈
您最近一年使用:0次
名校
解题方法
8 . 党的二十大报告中着重强调了生态文明建设的重要性,在这场蓝天保卫战中,如何有效脱除NOx是当前科学家研究的重要课题。
(1)碱性KMnO4氧化法可将NOx进行脱除。
①KMnO4(NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整_______ 。
_______NO+_______MnO _______
_______ =______NO
=______NO 3NO
3NO 10MnO
10MnO _______
_______
②下列叙述错误的是_______ 。
A.将脱除后的混合溶液进行分离可获得氨态氮肥
B.反应后混合溶液中:[MnO ]+[MnO
]+[MnO ]=[K+]
]=[K+]
C.在不同酸碱性条件下,KMnO4发生氧化还原反应的产物可能不同
D.NO 中的O-N-O键角大于NO
中的O-N-O键角大于NO 中的O-N-O键角
中的O-N-O键角
③在实验室用KMnO4(NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为NO ,理论上需要KMnO4的质量为
,理论上需要KMnO4的质量为_______ g。
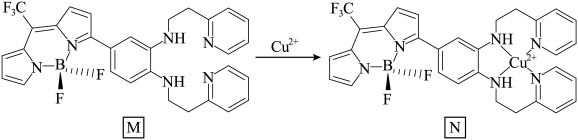
(2)用Pl-g-C3N4光催化氧化法脱除NO的过程如图所示。
在酸性水溶液中,光催化脱除原理和电化学反应原理类似。g-C3N4端的反应为O2+2H++2e-=H2O2,P1端的反应为_______ 。
无害化处理水体中的含氮化合物(以NH3、NO 、NO
、NO 等形式存在)也是生态文明建设的重要环节之一。
等形式存在)也是生态文明建设的重要环节之一。
(3)向该酸性废水(主要是以NH 形式存在)中加入NaClO溶液可将NH
形式存在)中加入NaClO溶液可将NH 转化成无害气体放出,发生反应的离子方程式为
转化成无害气体放出,发生反应的离子方程式为_______ ;NaClO可以通过Cl2与NaOH溶液反应制得,该反应中氧化剂与还原剂的物质的量之比为_______ 。
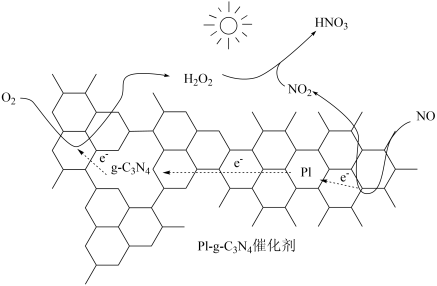
(4)使用NH3时也要注意防止污染环境。电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图:
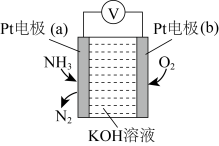
①Pt电极(a)为_______ 极(填“正”或“负”);Pt电极(b)上的电极反应式为_______ 。
②电池总反应的化学反应方程式为_______ ,反应一段时间后,KOH溶液的浓度将_______ (填“增大”“减小”或“不变”)。
(1)碱性KMnO4氧化法可将NOx进行脱除。
①KMnO4(NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整
_______NO+_______MnO
 _______
_______ =______NO
=______NO 3NO
3NO 10MnO
10MnO _______
_______
②下列叙述错误的是
A.将脱除后的混合溶液进行分离可获得氨态氮肥
B.反应后混合溶液中:[MnO
 ]+[MnO
]+[MnO ]=[K+]
]=[K+]C.在不同酸碱性条件下,KMnO4发生氧化还原反应的产物可能不同
D.NO
 中的O-N-O键角大于NO
中的O-N-O键角大于NO 中的O-N-O键角
中的O-N-O键角③在实验室用KMnO4(NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为NO
 ,理论上需要KMnO4的质量为
,理论上需要KMnO4的质量为(2)用Pl-g-C3N4光催化氧化法脱除NO的过程如图所示。

在酸性水溶液中,光催化脱除原理和电化学反应原理类似。g-C3N4端的反应为O2+2H++2e-=H2O2,P1端的反应为
无害化处理水体中的含氮化合物(以NH3、NO
 、NO
、NO 等形式存在)也是生态文明建设的重要环节之一。
等形式存在)也是生态文明建设的重要环节之一。(3)向该酸性废水(主要是以NH
 形式存在)中加入NaClO溶液可将NH
形式存在)中加入NaClO溶液可将NH 转化成无害气体放出,发生反应的离子方程式为
转化成无害气体放出,发生反应的离子方程式为(4)使用NH3时也要注意防止污染环境。电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图:
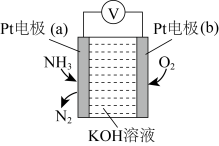
①Pt电极(a)为
②电池总反应的化学反应方程式为
您最近一年使用:0次
解题方法
9 .  固体发生如下转化。
固体发生如下转化。
(1) 固体中所含的化学键为
固体中所含的化学键为_______ ,写出加“过量氯水”后的溶液中的所有阴离子_______ 。
(2)下列说法不正确的是_______。
(3)请依据非氧化还原反应,设计实验验证“固体混合物”中含硫元素的微粒__________ 。
(4)写出 与足量炭黑反应的化学方程式
与足量炭黑反应的化学方程式_______ 。
 固体发生如下转化。
固体发生如下转化。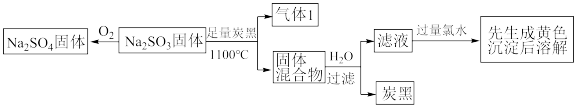
(1)
 固体中所含的化学键为
固体中所含的化学键为(2)下列说法不正确的是_______。
A. 的键角比 的键角比 的键角大 的键角大 |
B.只用稀硝酸不能验证 是否全部氧化为 是否全部氧化为 |
| C.气体1可用作高温炼铁的原料气 |
| D.过滤时,滤纸要对折两次后打开成圆锥形,放入漏斗且紧贴内壁 |
(3)请依据非氧化还原反应,设计实验验证“固体混合物”中含硫元素的微粒
(4)写出
 与足量炭黑反应的化学方程式
与足量炭黑反应的化学方程式
您最近一年使用:0次
解题方法
10 . 氢、碳、氮、氧、氟、氯铁等元素及其化合物在工业生产和生活中有重要用途。请根据物质结构与性质的相关知识,回答下列问题:
(1)下列氮原子的轨道表示式表示的状态中,能量最低的是___________(填字母)。
(2)写出基态铁原子价层电子的电子排布式:___________ ;基态 与
与 中未成对的电子数之比为
中未成对的电子数之比为___________ 。
(3)如表是第三周期某种元素的各级电离能数据。由此可判断该元素名称是___________ 。
(4)HCN分子中C和N原子满足8电子稳定结构,则HCN分子中 键和
键和 键的个数比为
键的个数比为___________ ;
(5)比较 中H—O—H键角和
中H—O—H键角和 中H—O—H键角大小,
中H—O—H键角大小,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(6)试比较下列酸的酸性强弱(填“>”、“<”或“=”):HF___________ HCl;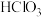
___________  ;
;
(1)下列氮原子的轨道表示式表示的状态中,能量最低的是___________(填字母)。
A. | B. |
C.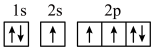 | D. |
(2)写出基态铁原子价层电子的电子排布式:
 与
与 中未成对的电子数之比为
中未成对的电子数之比为(3)如表是第三周期某种元素的各级电离能数据。由此可判断该元素名称是
电离能/( ) ) | ||||
 |  |  |  | 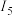 |
| 578 | 1817 | 2745 | 11575 | 14830 |
(4)HCN分子中C和N原子满足8电子稳定结构,则HCN分子中
 键和
键和 键的个数比为
键的个数比为(5)比较
 中H—O—H键角和
中H—O—H键角和 中H—O—H键角大小,
中H—O—H键角大小,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(6)试比较下列酸的酸性强弱(填“>”、“<”或“=”):HF
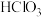
 ;
;
您最近一年使用:0次



