1 . Si、S、Se在自然界中形成多种多样的物质结构。回答下列问题:
(1)Se与O同族,电负性较大的是_____ ;基态Se原子的价电子运动状态有_____ 种。
(2)已知液态的二氧化硫可以发生类似水的自电离: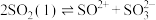 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为__ , 的空间结构为
的空间结构为_______ 。
(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为_______ ,二者中更易与 形成配位键的是
形成配位键的是_______ 。 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是_______ 。
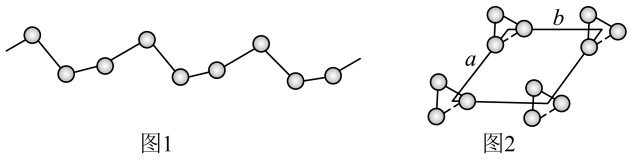
(5) -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、 、
、 (其中
(其中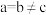 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。_______ 。晶胞中含有Se原子的数目为_______ ;则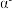 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为______  (列出算式)。
(列出算式)。
(1)Se与O同族,电负性较大的是
(2)已知液态的二氧化硫可以发生类似水的自电离:
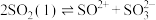 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为 的空间结构为
的空间结构为(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物
 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为 形成配位键的是
形成配位键的是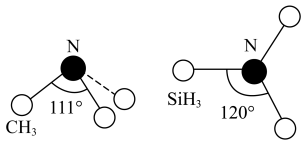
 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是(5)
 -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、 、
、 (其中
(其中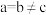 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。
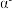 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为 (列出算式)。
(列出算式)。
您最近一年使用:0次
名校
2 . 设NA是阿伏加德罗常数的值,下列说法正确的是
| A.31g白磷(P4)含P-P键数目为6NA |
| B.12g石墨含C-C键数目为1.5NA |
C.17gH2O2中含O 数目为0.5NA 数目为0.5NA |
| D.16gS8中含S-S键数目为NA |
您最近一年使用:0次
2023-10-22更新
|
114次组卷
|
3卷引用:宁夏银川市第二中学2023-2024学年高三上学期统练二化学试题
3 . 用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.常温下,12g石墨中含有的碳碳键数目为2NA |
| B.标准状况下,2.24LHF与1.6gCH4分子所含电子数目均为NA |
| C.0.2molFeI2与足量氯气反应时转移电子数为0.4NA |
| D.60gHCHO与CH3COOH混合物中含C原子数为2NA |
您最近一年使用:0次
2023-08-24更新
|
130次组卷
|
3卷引用:宁夏石嘴山市第三中学2023-2024学年高三上学期开学检测化学试题
解题方法
4 . 铬同铁、钴、镍、铜等金属形成的合金,用于航空、宇航、电器、仪表及高端科技领域。
(1)铬的基态原子的价层电子排布式是___________ ;
(2)氯化铬酰(CrO2Cl2)的熔点为-96.5°C,沸点为117°C,固态氯化铬酰属于___________ 晶体。制备CrO2Cl2的反应为K2Cr2O7+3CC14=2KCl +2CrO2Cl2+3COCl2↑,COC12分子中σ键和π键的个数比为___________ ,空间构型为___________ ;
(3)某镍配合物结构如图所示。

分子内含有的作用力有___________ (填序号),
A.氢键 B.离子键 C.金属键 D.配位键
其中属于第二周期元素的第一电能由大到小的顺序是___________ (填元素符号);
(4)向CuSO4溶液中通入氨气得到深蓝色溶液的离子方程式为___________ 。
(5)CoCl3·4NH3中心原子Co3+配位数为6,向含0. 1 mol CoCl3·4NH3的溶液中滴加2mol·L-1AgNO3溶液,反应完全共消耗50 mL溶液,则CoCl3·4NH3改写成配合物的化学式为___________ 。
(6)下图是Cu的晶体一种堆积方式, 若晶胞的边长为a pm,则晶体的密度为___________ g·cm-3(用含a和NA的表达式表示)。

(1)铬的基态原子的价层电子排布式是
(2)氯化铬酰(CrO2Cl2)的熔点为-96.5°C,沸点为117°C,固态氯化铬酰属于
(3)某镍配合物结构如图所示。

分子内含有的作用力有
A.氢键 B.离子键 C.金属键 D.配位键
其中属于第二周期元素的第一电能由大到小的顺序是
(4)向CuSO4溶液中通入氨气得到深蓝色溶液的离子方程式为
(5)CoCl3·4NH3中心原子Co3+配位数为6,向含0. 1 mol CoCl3·4NH3的溶液中滴加2mol·L-1AgNO3溶液,反应完全共消耗50 mL溶液,则CoCl3·4NH3改写成配合物的化学式为
(6)下图是Cu的晶体一种堆积方式, 若晶胞的边长为a pm,则晶体的密度为

您最近一年使用:0次
5 . 已知NA为阿伏加德罗常数的值。下列说法正确的是
| A.31g白磷分子含有共价单键数目为NA个 |
| B.4.6g有机物C2H6O的分子结构中含有C-H键数目为0.5NA |
| C.0.1molFe分别与足量Cl2、S完全反应,转移电子数均为0.2NA个 |
| D.足量的镁粉与一定量的浓硫酸充分反应,放出SO2和H2混合气体2.24L(标准状况),转移电子数为0.2NA |
您最近一年使用:0次
名校
解题方法
6 . NA为阿伏加德罗常数的值,下列叙述正确的是
A.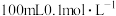 的 的 水溶液中含有氧原子数为0.01NA 水溶液中含有氧原子数为0.01NA |
B.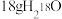 含有的中子数为10NA 含有的中子数为10NA |
C.32g环状 ( ( )分子中含有的 )分子中含有的 键数为1NA 键数为1NA |
| D.0.1 mol CH3COOH与足量CH3CH2OH充分反应生成的CH3COOCH2CH3分子数目为0.1NA |
您最近一年使用:0次
2021-08-30更新
|
229次组卷
|
4卷引用:宁夏银川一中2022届高三第一次月考理科综合化学试题
解题方法
7 . 近年来,我国工程建设自主创新能力实现大跨越,尤其在新材料研究方面有重大突破,回答下列问题:
(1)钛是一种新兴的结构材料,比钢轻、比铝硬。基态钛原子的价电子排布式为_____ , 与钛同周期的元素中,基态原子的未成对电子数与钛相间的有_____ 种;
(2)铁能与三氮唑(结构见图甲)形成多种配合物。
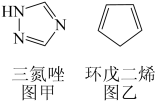
①l mol三氮唑中所含σ键的数目为_____ mol; 碳原子杂化方式是____ ;
②三氮唑的沸点为260°C,与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为42.5℃,前者沸点较高的原因是_____ 。
(3)碳化钨是耐高温耐磨材料。图丙为碳化钨晶体的部分结构,碳原子嵌入金属的晶格间隙,并不破坏原有金属的晶格,形成填隙化合物。
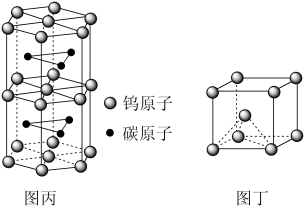
①在该结构中,每个钨原子周围距离其最近的碳原子有_____ 个:
②假设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g•mol-1,密度为d g•cm-3,则阿伏加德罗常数的值NA用上述数据表示为_____ 。
③金属镁的晶体结构与碳化钨相似,金属镁的晶胞可用图丁表示,已知镁原子的半径为r pm,晶胞高为h pm,求晶胞中镁原子的空间利用率_______ (用化简后含字时π、r和h的代数式表示)
(1)钛是一种新兴的结构材料,比钢轻、比铝硬。基态钛原子的价电子排布式为
(2)铁能与三氮唑(结构见图甲)形成多种配合物。

①l mol三氮唑中所含σ键的数目为
②三氮唑的沸点为260°C,与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为42.5℃,前者沸点较高的原因是
(3)碳化钨是耐高温耐磨材料。图丙为碳化钨晶体的部分结构,碳原子嵌入金属的晶格间隙,并不破坏原有金属的晶格,形成填隙化合物。

①在该结构中,每个钨原子周围距离其最近的碳原子有
②假设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g•mol-1,密度为d g•cm-3,则阿伏加德罗常数的值NA用上述数据表示为
③金属镁的晶体结构与碳化钨相似,金属镁的晶胞可用图丁表示,已知镁原子的半径为r pm,晶胞高为h pm,求晶胞中镁原子的空间利用率
您最近一年使用:0次
2021-03-14更新
|
437次组卷
|
2卷引用:宁夏石嘴山市2021届高三下学期3月高考质量监测(一模) 化学试题
名校
解题方法
8 . 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.将lmolCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA(N表示粒子数) |
| B.用惰性电极电解CuSO4溶液一段时间后,若加入29.4gCu(OH)2能使溶液复原,则电解过程中转移电子的数目为1.2NA |
C.H2(g)+I2(g) 2HI(g) ΔH=-akJ·mol-1,若充分反应后放出akJ热量,则起始时向密闭容器中加入了NA个氢分子和足量的碘单质 2HI(g) ΔH=-akJ·mol-1,若充分反应后放出akJ热量,则起始时向密闭容器中加入了NA个氢分子和足量的碘单质 |
| D.100g质量分数17%的H2O2溶液中极性键数目为NA |
您最近一年使用:0次
2020-12-02更新
|
477次组卷
|
4卷引用:宁夏回族自治区银川市兴庆区宁夏回族自治区银川一中2021届高三上学期第四次月考理综化学试题
名校
9 . NA为阿伏加德罗常数的值。下列说法正确的是
| A.18gD2O和18gH2O中含有的质子数均为10NA |
| B.60gSiO2中含有共价键数为2NA |
| C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
| D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
您最近一年使用:0次
名校
解题方法
10 . 自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为__________ ,N、O、S元素的原子对键合电子吸引力最大的是___________ 。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol CN−中含有的π键的数目为__________ 。与CN−互为等电子体的离子或分子有__________ (写出一种即可)。
(3)[Cu(NH3)4]2+中,提供孤对电子的是___________ 。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是___________ (填“极性”或“非极性”)分子,由此推知[Cu(NH)4]2+的空间构型是___________ 。(填“平面正方形”或“正四面体”)
(4)NH3中N原子的杂化方式是___________ ,硫元素对应的含氧酸酸性是H2SO4强于H2SO3,其原因为___________ 。
(5)铜的一种氧化物晶体结构如图所示,该氧化物的化学式是___________ 。若该晶体结构为长方体,其参数如图,阿伏加 德罗常数为NA,则该氧化物的密度为___________ g/cm3。
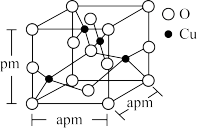
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol CN−中含有的π键的数目为
(3)[Cu(NH3)4]2+中,提供孤对电子的是
(4)NH3中N原子的杂化方式是
(5)铜的一种氧化物晶体结构如图所示,该氧化物的化学式是

您最近一年使用:0次
2019-12-05更新
|
199次组卷
|
2卷引用:宁夏银川市宁夏大学附中2020届高三上学期第二次月考理综化学试题



