解题方法
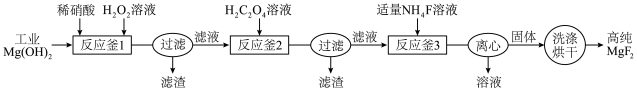
1 . 高纯MgF2在光子晶体等领域应用广泛。一种利用工业Mg(OH)2(含少量Ca、Fe、Mn等元素的氧化物)制备高纯MgF2的工艺如下。
回答下列问题:
(1)基态F的电子排布式为___________ , 的空间结构为
的空间结构为___________ 。
(2)反应釜1中,加入稀硝酸溶解后,调节pH至7.5,生成的沉淀主要是___________ ,再加入H2O2,除去的金属元素是___________ 。
(3)反应釜2中,为使Ca2+沉淀完全, 浓度应大于
浓度应大于___________ mol/L(CaC2O4的Ksp=2.0×10-9)。
(4)反应釜3中,反应的离子方程式为___________ 。
(5)离心后的溶液经浓缩结晶,所得固体的主要成分是___________ ;现称取一定量该固体配成溶液,取20.00mL,加入足量HCHO,反应为:4 +6HCHO=(CH2)6N4H++3H++6H2O,(CH2)6N4H+的酸性与醋酸接近,以酚酞作指示剂,用0.2000mol/LNaOH标准溶液滴定,消耗24.00mL,则所配溶液的
+6HCHO=(CH2)6N4H++3H++6H2O,(CH2)6N4H+的酸性与醋酸接近,以酚酞作指示剂,用0.2000mol/LNaOH标准溶液滴定,消耗24.00mL,则所配溶液的 浓度为
浓度为___________ mol/L。
| 离子 | Mg2+ | Ca2+ | Fe2+ | Fe3+ | Mn2+ |
| 完全沉淀的pH | 10.6 | 13.9 | 9.0 | 2.8 | 10.1 |
(1)基态F的电子排布式为
 的空间结构为
的空间结构为(2)反应釜1中,加入稀硝酸溶解后,调节pH至7.5,生成的沉淀主要是
(3)反应釜2中,为使Ca2+沉淀完全,
 浓度应大于
浓度应大于(4)反应釜3中,反应的离子方程式为
(5)离心后的溶液经浓缩结晶,所得固体的主要成分是
 +6HCHO=(CH2)6N4H++3H++6H2O,(CH2)6N4H+的酸性与醋酸接近,以酚酞作指示剂,用0.2000mol/LNaOH标准溶液滴定,消耗24.00mL,则所配溶液的
+6HCHO=(CH2)6N4H++3H++6H2O,(CH2)6N4H+的酸性与醋酸接近,以酚酞作指示剂,用0.2000mol/LNaOH标准溶液滴定,消耗24.00mL,则所配溶液的 浓度为
浓度为
您最近一年使用:0次
解题方法
2 . 氯化铵焙烧菱锰矿 (主要成分为  , 含少量Fe、Al、Ca、Mg等元素)制备高纯度碳酸锰的工艺流程如下:
, 含少量Fe、Al、Ca、Mg等元素)制备高纯度碳酸锰的工艺流程如下:
②常温下, 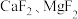 的溶度积分别为
的溶度积分别为 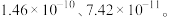
回答下列问题:
(1)基态锰原子的电子排布式为______ ,  的空间结构为
的空间结构为_______ 。
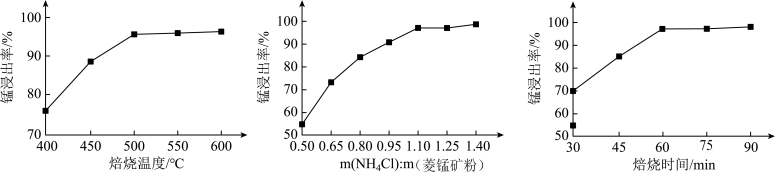
(2)由下图可知, 氯化铵焙烧菱锰矿的最佳条件: m(NH4Cl):m(菱锰矿粉)=1.10:1, 500℃焙烧60min,不选用600℃焙烧 90min的原因是_______ 。
(3)焙烧产生的CO2和NH3可用于工业制备纯碱,操作时应先向饱和食盐水中通入过量的_______ (填化学式)。
(4)浸出液“净化除杂”过程如下:首先加入 MnO2将 Fe2+氧化为Fe3+,反应的离子方程式为_______ ; 若溶液中金属离子浓度均为0.1 mol·L-1,调节溶液pH使 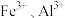 沉淀完全,此时溶液的pH 范围为
沉淀完全,此时溶液的pH 范围为_______ ,再加入NH4F 沉淀Ca²⁺、Mg²⁺,_______ ,当 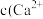 +
+  时,
时,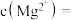
_______ 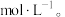
(5)碳化结晶时,发生反应的离子方程式为_______ 。
(6)流程中能循环利用的固态物质是_______ (填化学式)。
 , 含少量Fe、Al、Ca、Mg等元素)制备高纯度碳酸锰的工艺流程如下:
, 含少量Fe、Al、Ca、Mg等元素)制备高纯度碳酸锰的工艺流程如下: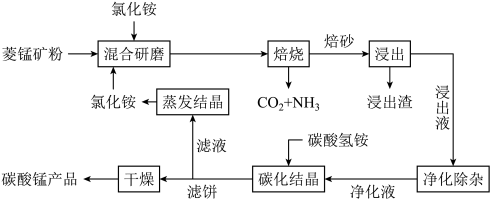
| 金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
| 开始沉淀的 pH | 3.8 | 1.5 | 6.5 | 10.6 | 8.1 | 9.6 |
| 沉淀完全的 pH | 5.2 | 3.7 | 9.7 | 12.6 | 10.1 | 11.6 |
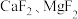 的溶度积分别为
的溶度积分别为 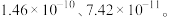
回答下列问题:
(1)基态锰原子的电子排布式为
 的空间结构为
的空间结构为(2)由下图可知, 氯化铵焙烧菱锰矿的最佳条件: m(NH4Cl):m(菱锰矿粉)=1.10:1, 500℃焙烧60min,不选用600℃焙烧 90min的原因是

(3)焙烧产生的CO2和NH3可用于工业制备纯碱,操作时应先向饱和食盐水中通入过量的
(4)浸出液“净化除杂”过程如下:首先加入 MnO2将 Fe2+氧化为Fe3+,反应的离子方程式为
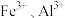 沉淀完全,此时溶液的pH 范围为
沉淀完全,此时溶液的pH 范围为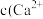 +
+  时,
时,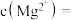
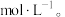
(5)碳化结晶时,发生反应的离子方程式为
(6)流程中能循环利用的固态物质是
您最近一年使用:0次
名校
3 . 过硫酸钠(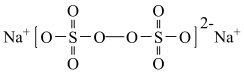 ),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对
),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对 制备和性质及用途进行探究。
制备和性质及用途进行探究。

工业制备过硫酸钠的反应原理:
主反应:

副反应:

实验室设计如图实验装置:
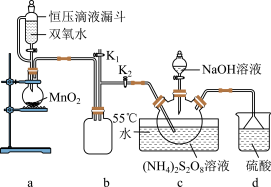
(2)装置b的作用是
(3)上述反应过程中,d装置中主要发生的化学反应方程式为
Ⅱ.探究
 的性质与用途
的性质与用途(4)
 用于废水中苯酚的降解
用于废水中苯酚的降解已知:a.
 具有强氧化性,
具有强氧化性, 浓度较高时会导致
浓度较高时会导致 淬灭。
淬灭。b.
 可将苯酚氧化,但反应速率较慢,加入
可将苯酚氧化,但反应速率较慢,加入 可加快反应。
可加快反应。过程为ⅰ.

ⅱ.
 将苯酚氧化为
将苯酚氧化为 气体
气体①
 氧化苯酚的离子方程式是
氧化苯酚的离子方程式是②将含
 的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。
的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。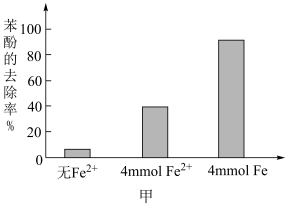
 ,可明显提高苯酚的降解率,主要原因是
,可明显提高苯酚的降解率,主要原因是(5)工业上利用
 能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含
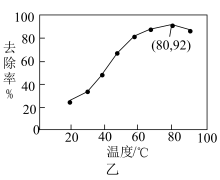
能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含 的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为
的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为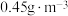 ,
, 达到最大去除率,NO去除的平均反应速率:
达到最大去除率,NO去除的平均反应速率: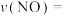
 。
。
您最近一年使用:0次
名校
解题方法
4 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)元素F简单离子的价电子排布式为___________ ;写出元素G在周期表中的位置___________ 。
(2)B与氢元素形成的简单气态氢化物的空间构型为___________ ,C与氢元素形成的简单气态氢化物的VSEPR模型为___________ 。
(3)C、D、E三种元素的简单离子半径由大到小的顺序为___________ (用元素符号表示)。
(4)已知元素A、B形成的 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为___________ 。
(5)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是___________ 化合物(填“离子”或“共价”);M的最高价氧化物对应的水化物与NaOH溶液反应的化学方程式为___________ 。
(6)FC—常用作消毒剂,单质砷(As)在碱性溶液中可被FC—氧化为AsO ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 电离能数据(单位: ):738、1451、7733、10540、13630…… ):738、1451、7733、10540、13630…… |
| E | 基态原子最外层电子排布式为: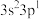 |
| F | 基态原子的最外层p轨道上2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 其中一种氧化物是有磁性的黑色固体 |
(2)B与氢元素形成的简单气态氢化物的空间构型为
(3)C、D、E三种元素的简单离子半径由大到小的顺序为
(4)已知元素A、B形成的
 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为(5)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是
(6)FC—常用作消毒剂,单质砷(As)在碱性溶液中可被FC—氧化为AsO
 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
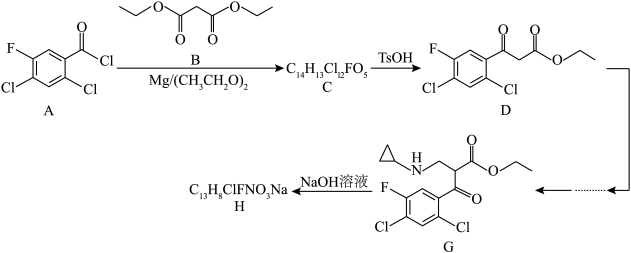
5 . 环氧沙星作为一种重要的喹啉酮类抗菌药物,被广泛使用于肺部、胃肠道和泌尿生殖系统的感染治疗,其重要的中间体H的合成路线如图所示:
已知: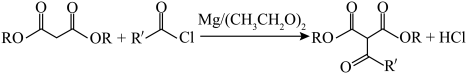
(1)B的名称为___________ ,C中官能团的名称为碳氟键、酮羰基、___________ ,D中采用 和
和 杂化的碳原子的数目比是
杂化的碳原子的数目比是___________ 。
(2)D经如下三步转化为G
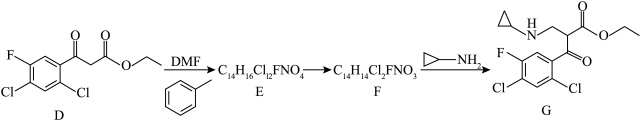
已知:DMF(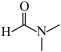 )可以发生反应
)可以发生反应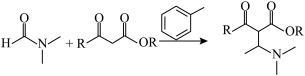
①DMF与银氨溶液反应的化学方程式为___________ 。
②满足下列条件的DMF的同分异构体有___________ 种(不考虑立体异构)。
A.分子内有含氧杂环结构 B.含有氨基(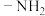 )
)
其同分异构体在下列仪器中显示信号完全相同的是___________ (填序号)。
a.X射线衍射仪 b.元素分析仪 c.红外光谱仪 d.核磁共振仪 e.质谱仪
③E的结构简式为___________ ,由E生成F的反应类型为___________ 。
(3)G生成H的反应称为环合反应。
已知: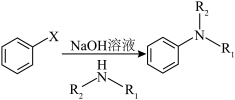 (X为卤原子,R1、R2为烃基)
(X为卤原子,R1、R2为烃基)
NaOH溶液可促进小分子脱落,且以形成五元环或六元环更为稳定,G生成H的反应方程式为___________ 。

已知:
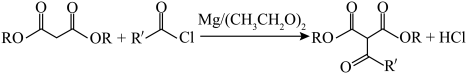
(1)B的名称为
 和
和 杂化的碳原子的数目比是
杂化的碳原子的数目比是(2)D经如下三步转化为G

已知:DMF(
 )可以发生反应
)可以发生反应
①DMF与银氨溶液反应的化学方程式为
②满足下列条件的DMF的同分异构体有
A.分子内有含氧杂环结构 B.含有氨基(
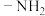 )
)其同分异构体在下列仪器中显示信号完全相同的是
a.X射线衍射仪 b.元素分析仪 c.红外光谱仪 d.核磁共振仪 e.质谱仪
③E的结构简式为
(3)G生成H的反应称为环合反应。
已知:
 (X为卤原子,R1、R2为烃基)
(X为卤原子,R1、R2为烃基)NaOH溶液可促进小分子脱落,且以形成五元环或六元环更为稳定,G生成H的反应方程式为
您最近一年使用:0次
名校
6 . 硫酸盐(含 、
、 )气溶胶是
)气溶胶是 的成分之一、科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
的成分之一、科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:不正确 的是
 、
、 )气溶胶是
)气溶胶是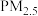 的成分之一、科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
的成分之一、科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下: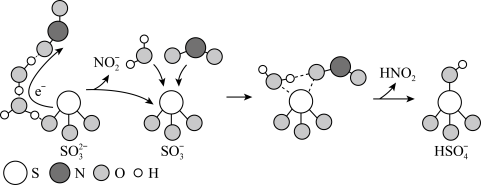
A. 中的O为 中的O为 杂化 杂化 |
B. 的VSEPR模型为平面三角形 的VSEPR模型为平面三角形 |
C. 是由极性键形成的极性分子 是由极性键形成的极性分子 |
| D.反应过程中涉及氧氢键断裂和硫氧键形成 |
您最近一年使用:0次
2023-07-12更新
|
227次组卷
|
6卷引用:选择题6-10
(已下线)选择题6-10北京朝阳区2022-2023学年高二下学期期末考试化学试题北京市第十五中学2023-2024学年高三上学期开学考试化学试题北京师范大学良乡附中2023-2024学年高三上学期10月月考化学试题(已下线)题型01 分子的空间构型及杂化类型的判断-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)(已下线)高二化学期末押题卷01-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(北京专用)
7 . 某金属有机多孔材料(MOFA)对CO2具有超高吸附能力,并能催化CO2与环氧丙烷反应,其工作原理如图所示。下列说法错误的是

| A.b分子中碳原子采用sp2和sp3杂化 |
| B.b的一氯代物有3种 |
| C.1molb最多可与2molNaOH反应 |
| D.a转化为b发生取代反应,并有极性共价键的形成 |
您最近一年使用:0次
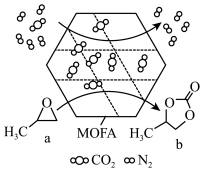
8 . 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物( )。回答下列问题:
)。回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为_______ 。橄榄石中,各元素电负性大小顺序为_______ ,铁的化合价为_______ 。
(2)已知一些物质的熔点数据如下表:
 与
与 均为第三周期元素,
均为第三周期元素, 熔点明显高于
熔点明显高于 ,原因是
,原因是_______ 。分析同族元素的氯化物 、
、 、
、 熔点变化趋势及其原因
熔点变化趋势及其原因_______ 。 的空间结构为
的空间结构为_______ ,其中 的轨道杂化形式为
的轨道杂化形式为_______ 。
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有_______ 个 。该物质化学式为
。该物质化学式为_______ ,B-B最近距离为_______ 。
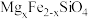 )。回答下列问题:
)。回答下列问题:(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)已知一些物质的熔点数据如下表:
| 物质 | 熔点/℃ |
 | 800.7 |
 |  |
 | 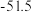 |
 |  |
 与
与 均为第三周期元素,
均为第三周期元素, 熔点明显高于
熔点明显高于 ,原因是
,原因是 、
、 、
、 熔点变化趋势及其原因
熔点变化趋势及其原因 的空间结构为
的空间结构为 的轨道杂化形式为
的轨道杂化形式为(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有
 。该物质化学式为
。该物质化学式为
您最近一年使用:0次
2023-06-12更新
|
14871次组卷
|
15卷引用:重庆市荣昌中学校2023-2024学年高二下学期4月期中考试化学试题
重庆市荣昌中学校2023-2024学年高二下学期4月期中考试化学试题2023年高考全国乙卷化学真题(已下线)T35-结构与性质(已下线)2023年高考化学真题完全解读(全国乙卷)(PPT+Word)(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)第21练 物质结构与性质综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)四川省绵阳市高中理科突击班2023-2024学年高三上学期第零次诊断性考试理综化学试题(已下线)第22讲晶体结构与性质山东省潍坊市昌乐二中2023-2024学年高三上学期12月月考化学试题湖南省永州市第一中学2023-2024学年高二下学期开学考试化学试题2024届四川省雅安市神州天立学校高三下学期高考冲刺考试理科综合试题-高中化学
名校
解题方法
9 . 我国煤储量居世界第一,对煤的综合、高效、无害化利用是二十一世纪能源战略的重要组成部分,利用含铁元素的粉煤灰获得纳米 等重要物质的工艺流程如下。
等重要物质的工艺流程如下。
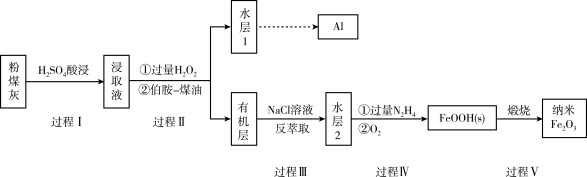
已知:i:伯胺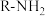 能与
能与 反应:
反应: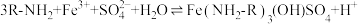 生成易溶于煤油的产物。
生成易溶于煤油的产物。
ii: 在水溶液中易与
在水溶液中易与 反应:
反应: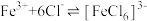
(1)写出过程I中 发生反应的离子方程式:
发生反应的离子方程式:_______ 。
(2)过程Ⅱ加入过量 的作用是
的作用是_______ 。
(3)过程Ⅱ加入伯胺-煤油对浸取液进行分离,该操作的名称是_______ 。
(4)从化学平衡角度解释过程Ⅱ利用 溶液进行反萃取的原理:
溶液进行反萃取的原理:_______ 。
(5) 具有碱性,可与
具有碱性,可与 结合生成
结合生成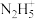 ,其中氮原子的杂化类型为
,其中氮原子的杂化类型为_______ 从结构角度分析,它比 配位能力
配位能力_______ (“强”或“弱”),过程Ⅳ中先用过量的 将水层2中
将水层2中 转化为
转化为 并生成
并生成 ,反应的离子方程式为
,反应的离子方程式为_______ ,得到的 再被
再被 氧化为
氧化为 。
。
(6)以 溶液作为吸收剂对燃煤烟气进行一体化“脱硫”、“脱硝”。控制溶液的
溶液作为吸收剂对燃煤烟气进行一体化“脱硫”、“脱硝”。控制溶液的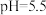 ,将烟气中的
,将烟气中的 、
、 转化为
转化为 、
、 ,均为放热反应。
,均为放热反应。
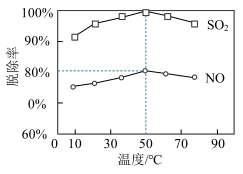
①一定时间内,温度对硫、硝脱除率的影响曲线如下图, 的脱除率高于
的脱除率高于 ,可能的原因是
,可能的原因是_______ (写出1种即可)。
②烟气中 和
和 的体积比为
的体积比为 ,
, 时的脱除率见图,则此吸收液中烟气转化生成的
时的脱除率见图,则此吸收液中烟气转化生成的 和
和 的物质的量之比为
的物质的量之比为_______ 。
 等重要物质的工艺流程如下。
等重要物质的工艺流程如下。
已知:i:伯胺
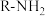 能与
能与 反应:
反应: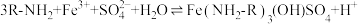 生成易溶于煤油的产物。
生成易溶于煤油的产物。ii:
 在水溶液中易与
在水溶液中易与 反应:
反应: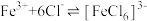
(1)写出过程I中
 发生反应的离子方程式:
发生反应的离子方程式:(2)过程Ⅱ加入过量
 的作用是
的作用是(3)过程Ⅱ加入伯胺-煤油对浸取液进行分离,该操作的名称是
(4)从化学平衡角度解释过程Ⅱ利用
 溶液进行反萃取的原理:
溶液进行反萃取的原理:(5)
 具有碱性,可与
具有碱性,可与 结合生成
结合生成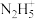 ,其中氮原子的杂化类型为
,其中氮原子的杂化类型为 配位能力
配位能力 将水层2中
将水层2中 转化为
转化为 并生成
并生成 ,反应的离子方程式为
,反应的离子方程式为 再被
再被 氧化为
氧化为 。
。(6)以
 溶液作为吸收剂对燃煤烟气进行一体化“脱硫”、“脱硝”。控制溶液的
溶液作为吸收剂对燃煤烟气进行一体化“脱硫”、“脱硝”。控制溶液的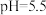 ,将烟气中的
,将烟气中的 、
、 转化为
转化为 、
、 ,均为放热反应。
,均为放热反应。①一定时间内,温度对硫、硝脱除率的影响曲线如下图,
 的脱除率高于
的脱除率高于 ,可能的原因是
,可能的原因是②烟气中
 和
和 的体积比为
的体积比为 ,
, 时的脱除率见图,则此吸收液中烟气转化生成的
时的脱除率见图,则此吸收液中烟气转化生成的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2023-05-28更新
|
579次组卷
|
2卷引用:重庆市万州第二高级中学2023-2024学年高三上学期8月月考化学试题
10 . 西北工业大学曾华强课题组借用足球烯核心,成功实现了高效且选择性可精准定制的离子跨膜运输,如图甲所示。
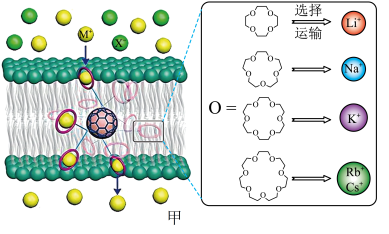
已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
(1)基态Cs原子的价层电子排布式为___________ 。基态K原子的核外电子云有___________ 个伸展方向。
(2)运输Cs+的冠醚名称是___________ 。冠醚分子中氧原子的杂化类型是___________ ,冠醚与碱金属离子之间存在微弱的配位键,配位原子是___________ (填元素符号)。
(3)几种冠醚与识别的碱金属离子的有关数据如下表所示:
18-冠醚-6不能识别和运输Na+和Cs+的原因是___________ 。观察图甲,冠醚不能识别和运输X-的主要原因可能是___________ 。
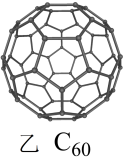
(4)足球烯的结构如图乙所示。1mol足球烯含___________ molσ键。
(5)铷晶胞为体心立方堆积,如图丙所示。
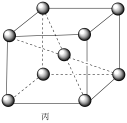
铷晶胞的原子空间利用率为___________ (用含π的式子表示)。
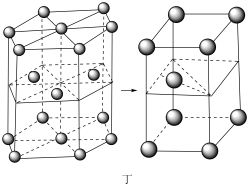
(6)锂晶胞为六方最密堆积,如图丁所示。锂晶胞中底边长为a pm,高为b pm,设NA为阿伏加德罗常数的值,则锂晶胞的密度为___________ g· cm-3(用含字母的式子表示)。

已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
(1)基态Cs原子的价层电子排布式为
(2)运输Cs+的冠醚名称是
(3)几种冠醚与识别的碱金属离子的有关数据如下表所示:
| 冠醚 | 冠醚空腔直径/pm | 适合的粒子直径/pm |
| 12冠醚- 4 | 120~ 150 | Li+ (152) |
| 15 -冠醚-5 | 170~ 220 | Na+ (204) |
| 18 -冠醚- 6 | 260~ 320 | K+ (276) |
| ___________ | 340~ 430 | Rb+ (304) |
| Cs+ (334) |
(4)足球烯的结构如图乙所示。1mol足球烯含

(5)铷晶胞为体心立方堆积,如图丙所示。

铷晶胞的原子空间利用率为
(6)锂晶胞为六方最密堆积,如图丁所示。锂晶胞中底边长为a pm,高为b pm,设NA为阿伏加德罗常数的值,则锂晶胞的密度为

您最近一年使用:0次



