1 . 利用钛铁矿(主要成分为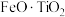 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备磷酸铁和锂离子电池正极材料(
等杂质)制备磷酸铁和锂离子电池正极材料( )的部分工业流程如图所示:
)的部分工业流程如图所示: (
(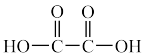 )、
)、 ,中C原子的杂化方式依次为
,中C原子的杂化方式依次为___________ 、___________ 。
(2) 、
、 的熔、沸点:
的熔、沸点: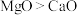 ,原因为
,原因为___________ 。
(3)已知 的配合物有多种,如
的配合物有多种,如 、
、 (
( )等。
)等。
① 的VSEPR模型名称为
的VSEPR模型名称为___________ 。
②从原子结构角度预测 具有较强的还原性,原因为
具有较强的还原性,原因为___________ 。
③配合物 (
( )与游离的
)与游离的 分子相比,配合物中的
分子相比,配合物中的 键角
键角___________ (填“>”“<”或“=”) 中的,原因是
中的,原因是___________ 。
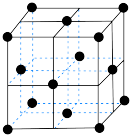
(4)在一定条件下铁形成的晶体的基本结构单元如图所示,设铁原子的半径为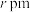 ,则
,则 原子的配位数为
原子的配位数为___________ ,该晶体的密度为___________ (列出计算式) 。
。
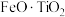 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备磷酸铁和锂离子电池正极材料(
等杂质)制备磷酸铁和锂离子电池正极材料( )的部分工业流程如图所示:
)的部分工业流程如图所示: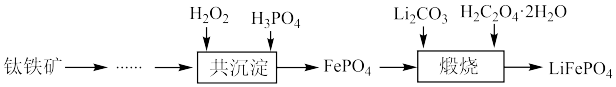
 (
(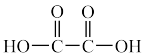 )、
)、 ,中C原子的杂化方式依次为
,中C原子的杂化方式依次为(2)
 、
、 的熔、沸点:
的熔、沸点: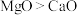 ,原因为
,原因为(3)已知
 的配合物有多种,如
的配合物有多种,如 、
、 (
( )等。
)等。①
 的VSEPR模型名称为
的VSEPR模型名称为②从原子结构角度预测
 具有较强的还原性,原因为
具有较强的还原性,原因为③配合物
 (
( )与游离的
)与游离的 分子相比,配合物中的
分子相比,配合物中的 键角
键角 中的,原因是
中的,原因是(4)在一定条件下铁形成的晶体的基本结构单元如图所示,设铁原子的半径为
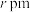 ,则
,则 原子的配位数为
原子的配位数为 。
。
您最近一年使用:0次
2024-05-24更新
|
104次组卷
|
4卷引用:四川省雅安市2023-2024学年高三下学期5月联考理综试题-高中化学
解题方法
2 . 偏磷酸钡Ba(PO3)2具有耐高温、透光性良好等性能,是制备磷酸盐光学玻璃的基础物质。利用湿法磷酸(主要成分为H3PO4,含有少量Mg2+、Fe3+、 、
、 等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示: 时:①
时:①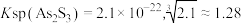 ;
;
②将NH3通入H3PO4溶液中,当pH=3.8~4.5时生成NH4H2PO4,pH=8.0~8.2时生成(NH4)2HPO4。
回答下列问题:
(1)“滤渣1”中含硫化合物的化学式为___________ 。
(2)“滤渣2”的主要成分有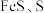 及
及 ,其中生成
,其中生成 的离子方程式为
的离子方程式为___________ ;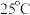 下,当
下,当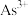 沉淀完全时,
沉淀完全时, 至少为
至少为___________  [当
[当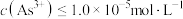 时认为沉淀完全]。
时认为沉淀完全]。
(3)“氨化”的目的之一是通入NH3调节溶液的pH,当溶液pH为4.3时H3PO4转化为___________ (填化学式)。
(4)“脱镁”的目的是生成MgF2沉淀除去Mg2+。若将流程中“氨化”与“脱镁”交换,Mg2+沉淀不完全,原因是___________ 。
(5)“结晶”后得到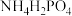 晶体,“煅烧”时生成
晶体,“煅烧”时生成 和
和 等物质,其反应的化学方程式为
等物质,其反应的化学方程式为___________ ;比较 键角:
键角: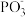
_________  (选填“
(选填“ ”“
”“ ”或“
”或“ ”),其原因是
”),其原因是___________ 。
 、
、 等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
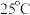 时:①
时:①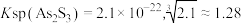 ;
;②将NH3通入H3PO4溶液中,当pH=3.8~4.5时生成NH4H2PO4,pH=8.0~8.2时生成(NH4)2HPO4。
回答下列问题:
(1)“滤渣1”中含硫化合物的化学式为
(2)“滤渣2”的主要成分有
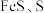 及
及 ,其中生成
,其中生成 的离子方程式为
的离子方程式为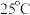 下,当
下,当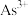 沉淀完全时,
沉淀完全时, 至少为
至少为 [当
[当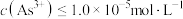 时认为沉淀完全]。
时认为沉淀完全]。(3)“氨化”的目的之一是通入NH3调节溶液的pH,当溶液pH为4.3时H3PO4转化为
(4)“脱镁”的目的是生成MgF2沉淀除去Mg2+。若将流程中“氨化”与“脱镁”交换,Mg2+沉淀不完全,原因是
(5)“结晶”后得到
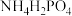 晶体,“煅烧”时生成
晶体,“煅烧”时生成 和
和 等物质,其反应的化学方程式为
等物质,其反应的化学方程式为 键角:
键角: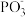
 (选填“
(选填“ ”“
”“ ”或“
”或“ ”),其原因是
”),其原因是
您最近一年使用:0次
2024-04-15更新
|
249次组卷
|
3卷引用:2024届四川省雅安市天全中学高三下学期模拟预测化学试题
名校
解题方法
3 . 铜是生活中一种非常重要的金属,黄铜矿(CuFeS2)是炼铜的最主要矿物,火法炼铜时涉及反应:2CuFeS2+O2=Cu2S+2FeS+SO2。
(1)O的轨道表示式为_______ ,其最高能级的原子轨道形状为_______ ,第一电离能:O_____ N(填“>”或“<”),Fe2+的价层电子排布式为______ 。
(2)SO2的VSEPR构型为_______ ,键角_______ H2O(填“>”或“<”);Cu元素位于周期表的________ 区,Cu和Zn的部分电离能数据如表所示,观察数据可知I2(Cu)>I2(Zn),对此,你的解释是______ 。
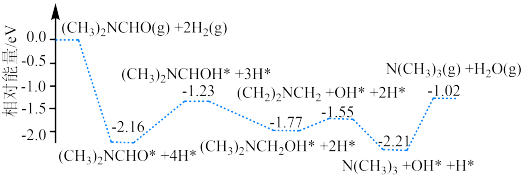
(3)我国科学家实现了铜催化剂将(CH3)2NCHO转化为N(CH3)3。计算机模拟单个分子在铜催化剂表面的反应历程如图所示:______ ;该反应在______ (填“高温”/“低温”/“任何温度”)下有自发性。
(1)O的轨道表示式为
(2)SO2的VSEPR构型为
| 元素 | Cu | Zn | |
| 电离能/(kJ•mol-1) | I1 | 746 | 906 |
| I2 | 1985 | 1733 | |
(3)我国科学家实现了铜催化剂将(CH3)2NCHO转化为N(CH3)3。计算机模拟单个分子在铜催化剂表面的反应历程如图所示:
您最近一年使用:0次
2024-03-10更新
|
127次组卷
|
2卷引用:四川省绵阳中学2023-2024学年高二下学期开学化学试题
名校
4 . 燃油汽车尾气中含有 和氮氧化物,氮氧化物包括
和氮氧化物,氮氧化物包括 等,研究
等,研究 还原氮氧化物及氮氧化物的分解对环境的治理有重要意义。
还原氮氧化物及氮氧化物的分解对环境的治理有重要意义。
(1)已知:
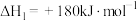 ,
, 的燃烧热为
的燃烧热为 。写出
。写出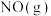 与
与 催化转化成
催化转化成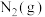 和
和 的热化学方程式
的热化学方程式___________ 。
(2)在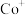 的催化作用下,
的催化作用下, 还原
还原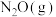 的反应历程和相对能量变化如图所示(逸出后物质认为状态不发生变化,在图中略去)。
的反应历程和相对能量变化如图所示(逸出后物质认为状态不发生变化,在图中略去)。
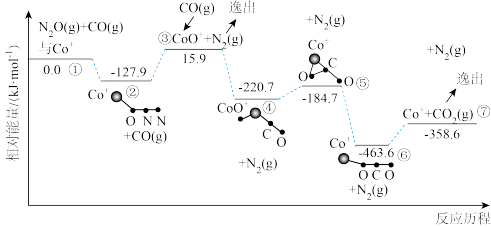
①分析反应历程,

_____  ;
; 分子的中心原子是
分子的中心原子是_____ 。
②该反应分两步进行:a. ;b.
;b._____ 。历程中决定反应速率的变化过程是_____ 。
A.②③ B.③④ C.⑤⑥ D.⑥⑦
(3) 和恒定压强
和恒定压强 时,在密闭容器中模拟某种废气中
时,在密闭容器中模拟某种废气中 直接催化分解过程,分解过程主反应为
直接催化分解过程,分解过程主反应为 。反应前后各组分的信息如下表:
。反应前后各组分的信息如下表:
分析数据,写出一个 分解的副反应的化学方程式:
分解的副反应的化学方程式:_____ 。该温度下主反应的
_____  (以分压表示,分压=总压
(以分压表示,分压=总压 物质的量分数)。若除去废气中的
物质的量分数)。若除去废气中的 气体,在相同的条件下模拟实验,发现体系中
气体,在相同的条件下模拟实验,发现体系中 的平衡转化率明显降低,解释其原因:
的平衡转化率明显降低,解释其原因:_____ 。
 和氮氧化物,氮氧化物包括
和氮氧化物,氮氧化物包括 等,研究
等,研究 还原氮氧化物及氮氧化物的分解对环境的治理有重要意义。
还原氮氧化物及氮氧化物的分解对环境的治理有重要意义。(1)已知:

 ,
, 的燃烧热为
的燃烧热为 。写出
。写出 与
与 催化转化成
催化转化成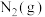 和
和 的热化学方程式
的热化学方程式(2)在
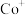 的催化作用下,
的催化作用下, 还原
还原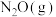 的反应历程和相对能量变化如图所示(逸出后物质认为状态不发生变化,在图中略去)。
的反应历程和相对能量变化如图所示(逸出后物质认为状态不发生变化,在图中略去)。
①分析反应历程,


 ;
; 分子的中心原子是
分子的中心原子是②该反应分两步进行:a.
 ;b.
;b.A.②③ B.③④ C.⑤⑥ D.⑥⑦
(3)
 和恒定压强
和恒定压强 时,在密闭容器中模拟某种废气中
时,在密闭容器中模拟某种废气中 直接催化分解过程,分解过程主反应为
直接催化分解过程,分解过程主反应为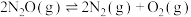 。反应前后各组分的信息如下表:
。反应前后各组分的信息如下表:| 物质 |  |  |  |  |  |  |
 (投料) (投料) | 19 | 34 | 6.5 | 25 | 0 | 0 |
 (平衡) (平衡) | 50 | 1 | 20 | 25 | 2 | 2 |
 分解的副反应的化学方程式:
分解的副反应的化学方程式:
 (以分压表示,分压=总压
(以分压表示,分压=总压 物质的量分数)。若除去废气中的
物质的量分数)。若除去废气中的 气体,在相同的条件下模拟实验,发现体系中
气体,在相同的条件下模拟实验,发现体系中 的平衡转化率明显降低,解释其原因:
的平衡转化率明显降低,解释其原因:
您最近一年使用:0次
2024-02-16更新
|
370次组卷
|
2卷引用:2024届四川省绵阳市高三上学期第二次诊断性考试(二模)理综试题
名校
解题方法
5 . 含碘的物质广泛应用于生活中。如(CH3NH3)PbI3作为典型的有机金属卤化物,一直是太阳能电池研究的宠儿;AgI可用于显影剂和人工增雨。
(1)基态碘原子的价电子排布式为___________ 。
(2)CH3NH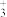 中所含元素电负性从大到小的顺序为
中所含元素电负性从大到小的顺序为___________ 。
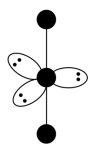
(3)I 的VSEPR模型如下图,中心I原子的杂化方式是
的VSEPR模型如下图,中心I原子的杂化方式是___________ (填“sp3”、“sp”、“sp3d”或“sp3d2”)。I 的空间构型为
的空间构型为___________ 。
(4)Ti的四卤化物熔点如下表所示。由此可推知,TiF4中的化学键类型是___________ TiCl4至TiI4熔点依次升高,原因是___________ 。
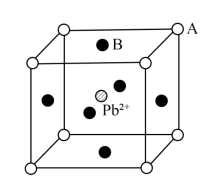
(5)(CH3NH3)PbI3晶体属于钙钛矿型结构(如图所示)。Pb2+周围距离最近且相等的I-数目有___________ 个;晶胞中A、B之间的距离为apm,(CH3NH3)PbI3式量为M,该物质的密度ρ=___________ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
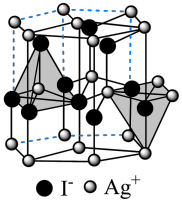
(6)在离子晶体中,当0.414<r(阳离子)∶r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知r(Ag+)∶r(I-)=0.573,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。造成AgI晶体结构不同于NaCl晶体结构的原因不可能 是___________ (填标号)。
a.几何因素 b.电荷因素 c.键性因素
(1)基态碘原子的价电子排布式为
(2)CH3NH
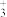 中所含元素电负性从大到小的顺序为
中所含元素电负性从大到小的顺序为(3)I
 的VSEPR模型如下图,中心I原子的杂化方式是
的VSEPR模型如下图,中心I原子的杂化方式是 的空间构型为
的空间构型为
(4)Ti的四卤化物熔点如下表所示。由此可推知,TiF4中的化学键类型是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24.12 | 38.3 | 155 |
(5)(CH3NH3)PbI3晶体属于钙钛矿型结构(如图所示)。Pb2+周围距离最近且相等的I-数目有

(6)在离子晶体中,当0.414<r(阳离子)∶r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知r(Ag+)∶r(I-)=0.573,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。造成AgI晶体结构不同于NaCl晶体结构的原因

a.几何因素 b.电荷因素 c.键性因素
您最近一年使用:0次
名校
解题方法
6 . 现有A、B、C、D、E五种前四周期元素,其原子序数依次增大。部分信息如下表:
用相应的化学用语回答下列问题:
(1)基态D原子的未成对电子数是___________ ,该元素在周期表中的位置为___________ 。
(2)E2+能分别与H2O和NH3形成[E(H2O)4]2+和[E(NH3)4]2+,其中呈深蓝色的离子是___________ ,该离子中的配位原子是___________ 。
(3)A2C分子中心原子的价层电子对数是___________ ,其VSEPR模型为___________ ;BC2分子的立体构型为___________ ,写出BC2的一种等电子体的结构式___________ 。
(4)A元素和B元素形成的一种既有极性键又有非极性键,且相对分子质量最小的分子的分子式___________ ,该分子中 键和
键和 键的数目之比为
键的数目之比为___________ 。
| 元素 | 信息 |
| A | 核外电子排布式为nsn |
| B | 基态原子各能级电子数相等,且核外有4种空间运动状态的电子 |
| C | 价电子排布式为nsnnp2n |
| D | 前四周期中基态原子的未成对电子数最多的元素 |
| E | 基态原子的内层各能级填满电子,且最外层只有一个电子 |
用相应的化学用语回答下列问题:
(1)基态D原子的未成对电子数是
(2)E2+能分别与H2O和NH3形成[E(H2O)4]2+和[E(NH3)4]2+,其中呈深蓝色的离子是
(3)A2C分子中心原子的价层电子对数是
(4)A元素和B元素形成的一种既有极性键又有非极性键,且相对分子质量最小的分子的分子式
 键和
键和 键的数目之比为
键的数目之比为
您最近一年使用:0次
名校
解题方法
7 . 下表为周期表的一部分,其中的编号代表对应的元素。请回答下列问题:
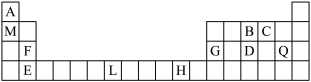
(1)表中属于ds区元素的是_______ (填元素符号)。BC 的
的 模型为
模型为_______ 。
(2)基态L原子的价电子排布图_______ ,同一周期且最外层电子数与L相同的元素有_______ 种。
(3)由A、B、C三元素形成的离子化合物中B原子的_______ 杂化轨道与A原子的_______ 轨道重叠形成_______ 键。
(4)上述元素中金属性最强的为_______ (填名称),其与C以原子个数比为1∶2形成化合物甲,则甲的电子式为_______ ,其中所含化学键类型为_______ 。
(5)工业上用电解法冶炼G的单质,阳极的电极反应式为_______ 。

(1)表中属于ds区元素的是
 的
的 模型为
模型为(2)基态L原子的价电子排布图
(3)由A、B、C三元素形成的离子化合物中B原子的
(4)上述元素中金属性最强的为
(5)工业上用电解法冶炼G的单质,阳极的电极反应式为
您最近一年使用:0次
2023-04-08更新
|
157次组卷
|
2卷引用: 四川省成都市石室中学2022-2023学年高二下学期3月月考化学试题
名校
8 . 乙酰丙酮是“种有酯气味的无色透明液体,常用作溶剂、有机合成中间体、金属络合剂等。它有两种主要互变异构体A、B,与Be2+、Mg2+、Cu2+、Zn2+等形成配合物C。回答下列有关问题:

(1)基态Cu2+离子的价电子排布式为_______ ,Be和Mg第一电离能较大的是_______ 原子。
(2)A中C原子杂化轨道类型有_______ ;按VSEPR预测B中∠HCC约为_______ 、_______ (填角度)。B在碱性条件下断裂极性最大的键,是_______ 键。 具有分子内氢键的是_______ (填“A”或“B”)。
(3)C中σ键与π键数目之比为_______ 。
(4)乙酰丙酮易溶于醇、氯仿、丙酮等多数有机溶剂,理由是_______ 。
(5)金属铜的某些参数如下:
根据上述数据,计算Cu的原子半径为_______ pm (列出计算表达式,设NA是阿伏加德罗常数的值)。

(1)基态Cu2+离子的价电子排布式为
(2)A中C原子杂化轨道类型有
(3)C中σ键与π键数目之比为
(4)乙酰丙酮易溶于醇、氯仿、丙酮等多数有机溶剂,理由是
(5)金属铜的某些参数如下:
| 金属 | 堆积类型 | 密度/g·cm-3 | 相对原子质量 |
| Cu | 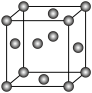 | ρ | 64 |
您最近一年使用:0次
2022-05-12更新
|
1446次组卷
|
7卷引用:四川省南充市2022届高三适应性考试(三诊)理综化学试题
四川省南充市2022届高三适应性考试(三诊)理综化学试题四川省南充市嘉陵第一中学2022-2023学年高二下学期6月月考化学试题四川省眉山市彭山区第一中学2023-2024学年高三上学期11月月考理综试题四川省叙永第一中学校2023-2024学年高三上学期1月期末理综试题-高中化学(已下线)2022年全国甲卷高考真题变式题(非选择题)(已下线)2022年全国乙卷高考变式题(非选择题)(已下线)考前特训 [综合大题分类规范练]
解题方法
9 . 已知周期表前四周期的元素a、b、c、d、e、f原子序数依次增大。a的核外电子总数与其周期数相同,c原子的最外层电子数是内层电子数的3倍,b、c左右相邻,c与d同族,e元素正三价离子的3d能级为半充满,f原子的次外层全充满,最外层只有一个电子。请回答下列问题:
(1)元素e的原子核外共有______ 种不同运动状态的电子,有_____ 种不同能级的电子。
(2)实验室中制备ba3的化学方程式为____ ,产生的ba3与a2d比较,键角更大的是____ ,原因是_____ 。
(3)f晶胞为面心立方最密堆积,其空间利用率为________ ,由d、e、f组成的物质晶胞结构如图。

①该物质的化学式为___________ 。
②以该物质为原料炼f过程中,会产生d的低价氧化物,该d的低价氧化物分子空间构型为___________ ,与其互为等电子体的阴离子有___________ 。
(4)由a、b、c、d四种元素可组成两种酸式盐M和N,请写出M和N之间反应的离子方程式___________ 。
(1)元素e的原子核外共有
(2)实验室中制备ba3的化学方程式为
(3)f晶胞为面心立方最密堆积,其空间利用率为

①该物质的化学式为
②以该物质为原料炼f过程中,会产生d的低价氧化物,该d的低价氧化物分子空间构型为
(4)由a、b、c、d四种元素可组成两种酸式盐M和N,请写出M和N之间反应的离子方程式
您最近一年使用:0次
解题方法
10 .  、
、 、
、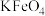 、NaClO和
、NaClO和 都是重要的氧化剂。
都是重要的氧化剂。
(1)Mn位于元素周期表第___________ 周期___________ 族,基态Mn原子未成对的电子数为___________ 。
(2)基态Cr原子的核外电子排布式为___________ ,第四周期ds区元素中,与基态Cr原子最外层电子数目相同的元素的元素符号为___________ 。
(3)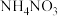 中,电负性最低的元素是
中,电负性最低的元素是___________ (填元素符号);硝酸根中N的___________ 杂化轨道与O的2p轨道形成___________ 键(填“ ”或“
”或“ ”)。
”)。
(4)NaClO的电子式为___________ ,NaClO在水溶液中会水解产生HClO分子,该分子的立体构型为___________ 。
(5)铁的各级电离能数据为:第一电离能 、第二电离能
、第二电离能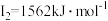 、第三电离能
、第三电离能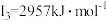 、第四电离能
、第四电离能 、第五电离能
、第五电离能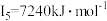 …,
…,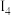 明显大于
明显大于 的原因是
的原因是___________ 。
 、
、 、
、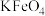 、NaClO和
、NaClO和 都是重要的氧化剂。
都是重要的氧化剂。(1)Mn位于元素周期表第
(2)基态Cr原子的核外电子排布式为
(3)
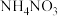 中,电负性最低的元素是
中,电负性最低的元素是 ”或“
”或“ ”)。
”)。(4)NaClO的电子式为
(5)铁的各级电离能数据为:第一电离能
 、第二电离能
、第二电离能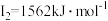 、第三电离能
、第三电离能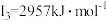 、第四电离能
、第四电离能 、第五电离能
、第五电离能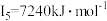 …,
…,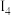 明显大于
明显大于 的原因是
的原因是
您最近一年使用:0次



