名校
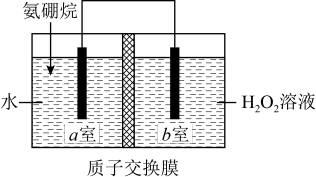
1 . 科学家利用氨硼烷设计成原电池装置如图所示,该电池在常温下即可工作,总反应为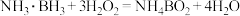 。下列说法正确的是
。下列说法正确的是
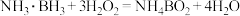 。下列说法正确的是
。下列说法正确的是
| A.NH3与BH3的分子空间构型相同 |
B.a室发生的电极反应式为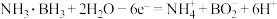 |
| C.NH3·BH3中配位原子是B |
| D.1mol NH4BO2中含7mol σ键 |
您最近一年使用:0次
名校
解题方法
2 . 氯的含氧酸根离子有ClO-、ClO 、ClO
、ClO 、ClO
、ClO 等,有关它们的下列说法正确的是
等,有关它们的下列说法正确的是
 、ClO
、ClO 、ClO
、ClO 等,有关它们的下列说法正确的是
等,有关它们的下列说法正确的是| A.ClO-中氯元素显+1价,具有很强的还原性 |
B.这些离子结合H+的能力,ClO 最强 最强 |
C.ClO 是NO 是NO 的等电子体,其空间构型为平面三角形 的等电子体,其空间构型为平面三角形 |
D.ClO 、ClO 、ClO 、ClO 、ClO 中的氯原子都采取sp3杂化,离子中相邻两个Cl−O键间键角依次增大 中的氯原子都采取sp3杂化,离子中相邻两个Cl−O键间键角依次增大 |
您最近一年使用:0次
2021-08-24更新
|
162次组卷
|
2卷引用:吉林省延边第二中学2020-2021学年高二下学期第一次考试月考化学试题
名校
解题方法
3 . 下列粒子的VSEPR模型为四面体,且空间构型结构为V型的是
| A.H2O | B.NF3 | C.H3O+ | D.SO2 |
您最近一年使用:0次
名校
解题方法
4 . 回答下列问题:
(1)甲烷在一定条件下可生成以下微粒:
A.碳正离子(CH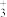 ) B.碳负离子(CH
) B.碳负离子(CH ) C. 甲基 (—CH3) D.碳烯 (
) C. 甲基 (—CH3) D.碳烯 ( CH2)
CH2)
①四种微粒中,键角为120°的是___________ (填序号)。
②碳负离子(CH )的空间构型为
)的空间构型为___________ ,与(CH )互为等电子体的一种分子是
)互为等电子体的一种分子是___________ (填化学式)。
(2)在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学方程式为(HAc表示醋酸)Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac.请回答下列问题:
①该反应中含有的第二周期非金属元素的第一电离能由大到小的顺序为___________ 。
②在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中碳原子轨道的杂化类型为___________ ;1 mol尿素分子中,σ 键的数目为___________ 。
③Cu与O形成的某种化合物的晶胞结构如下图所示,若阿伏加德罗常数的值为NA,晶胞的边长为a pm,则该晶体的密度为___________ g·cm-3。
(1)甲烷在一定条件下可生成以下微粒:
A.碳正离子(CH
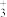 ) B.碳负离子(CH
) B.碳负离子(CH ) C. 甲基 (—CH3) D.碳烯 (
) C. 甲基 (—CH3) D.碳烯 ( CH2)
CH2)①四种微粒中,键角为120°的是
②碳负离子(CH
 )的空间构型为
)的空间构型为 )互为等电子体的一种分子是
)互为等电子体的一种分子是(2)在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学方程式为(HAc表示醋酸)Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac.请回答下列问题:
①该反应中含有的第二周期非金属元素的第一电离能由大到小的顺序为
②在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中碳原子轨道的杂化类型为
③Cu与O形成的某种化合物的晶胞结构如下图所示,若阿伏加德罗常数的值为NA,晶胞的边长为a pm,则该晶体的密度为

您最近一年使用:0次
2021高三·全国·专题练习
5 . 回答下列问题
(1)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是___________ ,中心原子杂化类型为___________ ,属于___________ (填“极性”或“非极性”)分子。
②X的沸点比水低的主要原因是___________ 。
(2)CuFeS2与氧气反应生成SO2,SO2中心原子的价层电子对数为___________ ,共价键的类型有___________ 。
(1)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是
②X的沸点比水低的主要原因是
(2)CuFeS2与氧气反应生成SO2,SO2中心原子的价层电子对数为
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
6 . 磷酸根离子的空间构型为___________ ,其中P的价层电子对数为___________ 、杂化轨道类型为___________ 。
您最近一年使用:0次
2021-08-10更新
|
575次组卷
|
5卷引用:考点34 分子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)
(已下线)考点34 分子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考向37 分子结构与性质-备战2022年高考化学一轮复习考点微专题(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第一部分 二轮专题突破 专题20 原子结构、分子结构与性质的基础考查(选考)(已下线)02 常考题空2 立体构型及杂化类型的判断 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
2021高三·全国·专题练习
解题方法
7 . 判断正误
(1)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对____________
(2)分子中中心原子若通过sp3杂化轨道成键,则该分子一定为正四面体结构____________
(3)NH3分子为三角锥形,N原子发生sp2杂化___________
(4)只要分子构型为平面三角形,中心原子均为sp2杂化___________
(5)中心原子是sp杂化的,其分子构型不一定为直线形___________
(6)价层电子对互斥理论中,π键电子对数不计入中心原子的价层电子对数___________
(7)PCl3分子是三角锥形,这是因为P原子是以sp2杂化的结果___________
(8)sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道___________
(9)凡中心原子采取sp3杂化的分子,其VSEPR模型都是(正)四面体___________
(10)AB3型的分子空间构型必为平面三角形___________
(11)分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构___________
(12)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对___________
(13)NH3和CH4两个分子中中心原子N和C都是通过sp3杂化轨道成键___________
(14)杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾___________
(15)配位键也是一种静电作用___________
(16)形成配位键的电子对由成键双方原子提供___________
(1)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对
(2)分子中中心原子若通过sp3杂化轨道成键,则该分子一定为正四面体结构
(3)NH3分子为三角锥形,N原子发生sp2杂化
(4)只要分子构型为平面三角形,中心原子均为sp2杂化
(5)中心原子是sp杂化的,其分子构型不一定为直线形
(6)价层电子对互斥理论中,π键电子对数不计入中心原子的价层电子对数
(7)PCl3分子是三角锥形,这是因为P原子是以sp2杂化的结果
(8)sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道
(9)凡中心原子采取sp3杂化的分子,其VSEPR模型都是(正)四面体
(10)AB3型的分子空间构型必为平面三角形
(11)分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构
(12)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对
(13)NH3和CH4两个分子中中心原子N和C都是通过sp3杂化轨道成键
(14)杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾
(15)配位键也是一种静电作用
(16)形成配位键的电子对由成键双方原子提供
您最近一年使用:0次
名校
解题方法
8 . 单晶边缘纳米催化剂技术为工业上有效利用二氧化碳提供了一条经济可行的途径,其中单晶氧化镁负载镍催化剂表现出优异的抗积碳和抗烧结性能。
(1). 基态镍原子的核外电子排布式为_______ 。
(2). 氧化镁载体及镍催化反应中涉及到CH4、CO2和CH3OH等物质。元素Mg、O和C的第一电离能由小到大排序为_______ ﹔在上述三种物质的分子中碳原子杂化类型不同于其他两种的是_______ ,立体构型为正四面体的分子是_______ ,三种物质中沸点最高的是CH3OH,其原因是_______ 。
(3). Ni与CO在60~80℃时反应生成Ni(CO)4气体,在Ni(CO)4分子中与Ni形成配位键的原子是_______ ,Ni(CO)4晶体类型是_______ 。
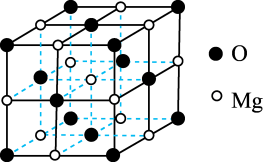
(4). 已知MgO具有NaCl型晶体结构,其结构如图所示。已知MgО晶胞边长为0.42nm,则MgO的密度为_______ g/cm3(保留小数点后一位)。
(1). 基态镍原子的核外电子排布式为
(2). 氧化镁载体及镍催化反应中涉及到CH4、CO2和CH3OH等物质。元素Mg、O和C的第一电离能由小到大排序为
(3). Ni与CO在60~80℃时反应生成Ni(CO)4气体,在Ni(CO)4分子中与Ni形成配位键的原子是
(4). 已知MgO具有NaCl型晶体结构,其结构如图所示。已知MgО晶胞边长为0.42nm,则MgO的密度为

您最近一年使用:0次
2021-08-06更新
|
378次组卷
|
3卷引用:福建省莆田一中2021届高三模拟质量检测化学试题
福建省莆田一中2021届高三模拟质量检测化学试题(已下线)专题十一 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)四川省邻水实验学校2021-2022学年高三上学期第三阶段考试理综化学试题
名校
解题方法
9 . 通常状况下,NCl3是一种油状液体,容易水解,生成物有漂白性,NCl3分子立体构型与氨分子相似,下列对NCl3的有关叙述正确的是
| A.NCl3水解方程式为:NCl3+2H2O=3HCl+HNO2 |
| B.分子中的所有原子均达到8电子稳定结构 |
| C.NCl3分子是非极性分子 |
| D.NCl3比NF3易挥发 |
您最近一年使用:0次
10 . 用图示的方法能够直观形象地将化学知识传授给学生。下列图示正确的是
A.溴原子的结构示意图 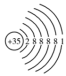 |
B.BF 的结构式 的结构式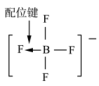 |
C.HF分子间的氢键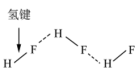 |
D.SO 的VSEPR模型 的VSEPR模型 |
您最近一年使用:0次



