名校
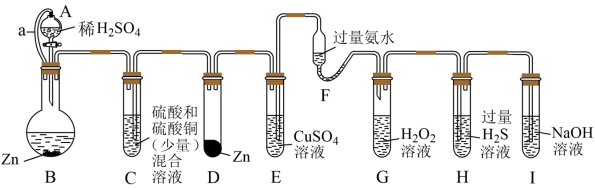
1 . “化学多米诺实验”(如图所示)即只需控制第一个反应,利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生。已知: (该反应产物可作为
(该反应产物可作为 的催化剂)。下列有关分析错误的是
的催化剂)。下列有关分析错误的是
 (该反应产物可作为
(该反应产物可作为 的催化剂)。下列有关分析错误的是
的催化剂)。下列有关分析错误的是
| A.该实验成功的重要条件是整套装置气密性良好 |
| B.H中出现浅黄色浑浊,证明O非金属性强于S |
C. 中存在极性共价键和配位键,N原子的杂化类型为 中存在极性共价键和配位键,N原子的杂化类型为 杂化 杂化 |
| D.若硫酸浓度及锌片大小表面积等均相同,则B中产生氢气速率大于D中速率 |
您最近一年使用:0次
2023-06-06更新
|
389次组卷
|
4卷引用:广东省汕头市2023-2024学年金山中学高三上学期10月阶段考试化学试卷
2 . 碳是地球上组成生命的最基本元素之一。不仅能形成丰富多彩的有机化合物,还能形成多种无机化合物,碳及其化合物的用途广泛。根据要求回答下列问题:
(1)在基态14C原子中,核外存在_______ 对自旋相反的电子;第二周期的元素中,第一电离能介于B和C之间的是_______ ( 写元素符号)。
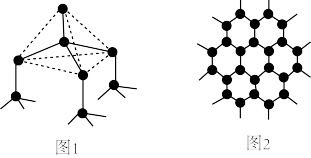
(2)下图中分别代表了碳单质的两种常见晶体,图1晶体中C原子的杂化方式为_______ ,图2晶体中,每个六元环占有_______ 个 C原子。
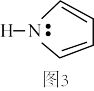
(3)碳可以形成多种有机化合物,如图3所示是一种吡咯的结构,分子中所有原子都在一个平面上。吡咯中所有元素的电负性由大到小的顺序为_______ 。
(4)碳可形成CO、CO2等多种无机化合物,在CO转化成CO2的反应过程中,下列说法正确的是_______。
(5)碳酸盐在一定温度下会发生分解生成二氧化碳和对应氧化物,实验证明:碳酸盐的阳离子不同分解温度不同,如表所示:
随着阳离子半径的增大,碳酸盐的分解温度逐步升高,原因是_______ 。
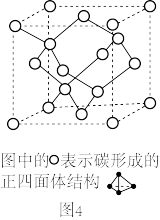
(6)在2017年,中外科学家团队共同合成了碳的一种新型同素异形体:T-碳。 T-碳的结构是:将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,形成碳的一种新型三维立方晶体结构,如图4。已知T-碳晶胞参数为apm,阿伏加德罗常数为NA,则T -碳的密度为_______ g/cm3(列出计算式)。
(1)在基态14C原子中,核外存在
(2)下图中分别代表了碳单质的两种常见晶体,图1晶体中C原子的杂化方式为

(3)碳可以形成多种有机化合物,如图3所示是一种吡咯的结构,分子中所有原子都在一个平面上。吡咯中所有元素的电负性由大到小的顺序为

(4)碳可形成CO、CO2等多种无机化合物,在CO转化成CO2的反应过程中,下列说法正确的是_______。
| A.分子中孤对电子数不变 | B.分子极性发生变化 | C.原子间成键方式改变 | D.分子间作用力减弱 |
| 碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/°C | 402 | 900 | 1 172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
(6)在2017年,中外科学家团队共同合成了碳的一种新型同素异形体:T-碳。 T-碳的结构是:将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,形成碳的一种新型三维立方晶体结构,如图4。已知T-碳晶胞参数为apm,阿伏加德罗常数为NA,则T -碳的密度为

您最近一年使用:0次
解题方法
3 . 热电材料可实现热能和电能的直接相互转换,我国科学家以 铬掺杂的硒化铅
铬掺杂的硒化铅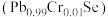 作为研究对象,改写了室温热电优值记录。回答下列问题:
作为研究对象,改写了室温热电优值记录。回答下列问题:
(1)Cr元素属于元素周期表的_______ 区,其基态原子的价层电子排布式为_______ 。
(2)铅(Pb)在元素周期表中位于第六周期,与碳同族,则电负性Pb_______ Se(填“>”、“<”或“=”)
(3) 分子中
分子中 的杂化轨道类型为
的杂化轨道类型为_______ , 可溶于水,而
可溶于水,而 难溶于水,原因是
难溶于水,原因是_______ 。
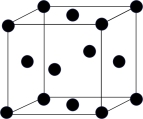
(4)金属 的晶胞结构示意图如下,其晶胞参数为
的晶胞结构示意图如下,其晶胞参数为 ,列式计算该晶胞的空间利用率为
,列式计算该晶胞的空间利用率为_______ (列出计算式即可,不必化简)
(5)火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,如同结晶一般,称为“岩浆晶出”。实验证明,岩浆晶出的次序与晶格能的大小有关,如下面两种氧化物:
则 和
和 两种矿物,晶出次序优先的物质是
两种矿物,晶出次序优先的物质是_______ ,原因为_______ 。
(6)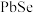 具有
具有 型的晶体结构,其晶体结构如下图所示,晶胞中
型的晶体结构,其晶体结构如下图所示,晶胞中 的配位数为
的配位数为_______ ,若晶胞密度为 ,则两个
,则两个 之间的最短距离为
之间的最短距离为_______ nm(列出计算式,设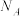 为阿伏加德罗常数值)。
为阿伏加德罗常数值)。

 铬掺杂的硒化铅
铬掺杂的硒化铅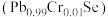 作为研究对象,改写了室温热电优值记录。回答下列问题:
作为研究对象,改写了室温热电优值记录。回答下列问题:(1)Cr元素属于元素周期表的
(2)铅(Pb)在元素周期表中位于第六周期,与碳同族,则电负性Pb
(3)
 分子中
分子中 的杂化轨道类型为
的杂化轨道类型为 可溶于水,而
可溶于水,而 难溶于水,原因是
难溶于水,原因是(4)金属
 的晶胞结构示意图如下,其晶胞参数为
的晶胞结构示意图如下,其晶胞参数为 ,列式计算该晶胞的空间利用率为
,列式计算该晶胞的空间利用率为
(5)火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,如同结晶一般,称为“岩浆晶出”。实验证明,岩浆晶出的次序与晶格能的大小有关,如下面两种氧化物:
| 氧化物 | 晶格能 | 晶出次序 |
 | 3401 | 先 |
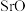 | 3223 | 后 |
则
 和
和 两种矿物,晶出次序优先的物质是
两种矿物,晶出次序优先的物质是(6)
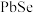 具有
具有 型的晶体结构,其晶体结构如下图所示,晶胞中
型的晶体结构,其晶体结构如下图所示,晶胞中 的配位数为
的配位数为 ,则两个
,则两个 之间的最短距离为
之间的最短距离为 为阿伏加德罗常数值)。
为阿伏加德罗常数值)。
您最近一年使用:0次
名校
解题方法
4 . 氢能被视为21世纪最具发展潜力的清洁能源,开发高效储氢材料是氢能利用的重要研究方向。
(1)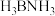 是一种潜在的储氢材料,其中N原子的价电子排布图为
是一种潜在的储氢材料,其中N原子的价电子排布图为______ 。
(2)制备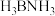 的化学反应为
的化学反应为 。其中
。其中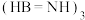 是六元环状物质,与其互为等电子体的有机物分子式为
是六元环状物质,与其互为等电子体的有机物分子式为______ 。 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为______ 。B、C、N、O第一电离能由大到小的顺序为______ 。
(3)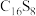 是新型环烯类储氢材料,研究证明其分子呈平面结构,如图所示。
是新型环烯类储氢材料,研究证明其分子呈平面结构,如图所示。

①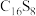 分子中C原子和S原子的杂化轨道类型分别为
分子中C原子和S原子的杂化轨道类型分别为_____ 。
②测得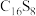 中碳硫键的键长介于C-S键和
中碳硫键的键长介于C-S键和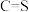 键之间,其原因可能是
键之间,其原因可能是______ 。
(4)某种铜银合金晶体具有储氢功能,它是面心立方最密堆积结构,Cu原子位于面心,Ag原子位于顶点,H原子可进入由Cu原子和Ag原子构成的四面体空隙中。若将Cu、Ag原子等同看待,该晶体储氢后的晶胞结构与 (如图)相似,该晶体储氢后的化学式为
(如图)相似,该晶体储氢后的化学式为______ 。

(5) 是金属氢化物储氢材料,其晶胞如图所示,已知该晶体的密度为
是金属氢化物储氢材料,其晶胞如图所示,已知该晶体的密度为 ,则该晶胞的体积为
,则该晶胞的体积为___________  (用含ρ、NA的代数式表示)。
(用含ρ、NA的代数式表示)。

(1)
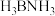 是一种潜在的储氢材料,其中N原子的价电子排布图为
是一种潜在的储氢材料,其中N原子的价电子排布图为(2)制备
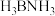 的化学反应为
的化学反应为 。其中
。其中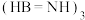 是六元环状物质,与其互为等电子体的有机物分子式为
是六元环状物质,与其互为等电子体的有机物分子式为 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为(3)
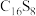 是新型环烯类储氢材料,研究证明其分子呈平面结构,如图所示。
是新型环烯类储氢材料,研究证明其分子呈平面结构,如图所示。
①
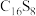 分子中C原子和S原子的杂化轨道类型分别为
分子中C原子和S原子的杂化轨道类型分别为②测得
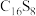 中碳硫键的键长介于C-S键和
中碳硫键的键长介于C-S键和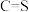 键之间,其原因可能是
键之间,其原因可能是(4)某种铜银合金晶体具有储氢功能,它是面心立方最密堆积结构,Cu原子位于面心,Ag原子位于顶点,H原子可进入由Cu原子和Ag原子构成的四面体空隙中。若将Cu、Ag原子等同看待,该晶体储氢后的晶胞结构与
 (如图)相似,该晶体储氢后的化学式为
(如图)相似,该晶体储氢后的化学式为
(5)
 是金属氢化物储氢材料,其晶胞如图所示,已知该晶体的密度为
是金属氢化物储氢材料,其晶胞如图所示,已知该晶体的密度为 ,则该晶胞的体积为
,则该晶胞的体积为 (用含ρ、NA的代数式表示)。
(用含ρ、NA的代数式表示)。
您最近一年使用:0次
2021-10-14更新
|
271次组卷
|
2卷引用:广东省广州市第六中学2022届高三第二次月考化学试题
名校
解题方法
5 . 关于如图所示的有机物说法不正确的是
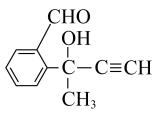
| A.分子中有1个手性碳 | B.该分子采用sp2杂化的碳原子数目为7个 |
| C.该有机物分子中所有原子不可能共面 | D.该有机物含有四种官能团 |
您最近一年使用:0次
名校
6 . 一种外用消炎药主要成分的结构如图所示。分子结构中的苯环和甲基部分已给出,X、Y、Z、W、M为原子序数依次增大的短周期主族元素,其中X的基态原子核外有3个未成对电子,W与Y同主族。下列说法错误的是

| A.简单离子半径:M>X>Z |
B.简单氢化物的沸点: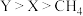 |
C. 与 与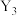 是分子空间结构相似的极性分子 是分子空间结构相似的极性分子 |
| D.Y与Z形成的化合物一定含有离子键和共价键 |
您最近一年使用:0次
解题方法
7 . 电解含硫酸铵的废水可制备硫酸和化肥,电解装置如图所示,下列说法错误的是

| A.b极为电源的正极 |
B. 中N的杂化方式为 中N的杂化方式为 |
| C.电解过程中原料室溶液pH升高 |
D.M室电极反应式为 |
您最近一年使用:0次
8 . 药物合成对于减轻人们的痛苦,提高人类寿命起到了重大的作用。一种利用甲酸、甲苯等基本有机原料,合成某抗过敏药物中间体ⅷ的路线如下(部分反应条件略):
(2)反应②中,化合物ⅲ与化合物y反应生成化合物ⅳ和 ,则y的名称是
,则y的名称是________ 。
(3)化合物ⅴ的分子式为________ 。化合物x为ⅴ的同分异构体,x与ⅴ含相同的官能团相同数目的苯环,且在核磁共振氢谱上有6组峰。x的结构简式为________ 。
(4)2-溴乙醇的结构简式是________ ,其羟基被Br取代生成1,2-二溴乙烷,根据1,2-二溴乙烷的结构特征,分析预测其可能的化学性质,写出反应的化学方程式(标明反应条件):
(a)生成乙炔:______________________ 。
(b)生成乙二醇:___________________ 。
(5)以甲苯为唯一的有机物原料(其他无机试剂任选),利用反应①②③的反应原理,合成酯类化合物xi。 溶液,目的是得到有机生成物
溶液,目的是得到有机生成物________ (写结构简式)。
(b)最后一步反应为酯化反应,需要的条件的是____________ 。

A.化合物ⅰ中,碳原子采取 杂化 杂化 |
B.化合物ⅱ中,未杂化p轨道通过“肩并肩”方式形成大 键 键 |
| C.化合物ⅲ中所有原子一定处于同一平面内 |
D.反应过程中,存在 键断裂和形成 键断裂和形成 |
(2)反应②中,化合物ⅲ与化合物y反应生成化合物ⅳ和
 ,则y的名称是
,则y的名称是(3)化合物ⅴ的分子式为
(4)2-溴乙醇的结构简式是
(a)生成乙炔:
(b)生成乙二醇:
(5)以甲苯为唯一的有机物原料(其他无机试剂任选),利用反应①②③的反应原理,合成酯类化合物xi。
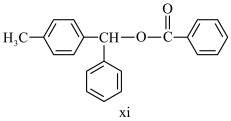
 溶液,目的是得到有机生成物
溶液,目的是得到有机生成物(b)最后一步反应为酯化反应,需要的条件的是
您最近一年使用:0次
名校
9 .  .青蒿素是烃的含氧衍生物,为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃,从青蒿素中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚萃取法和汽油浸取法。乙醚浸取法的主要工艺如图所示:
.青蒿素是烃的含氧衍生物,为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃,从青蒿素中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚萃取法和汽油浸取法。乙醚浸取法的主要工艺如图所示: 、
、 中,不会用到的装置是
中,不会用到的装置是___________ (填序号)。 的主要过程可能是
的主要过程可能是___________ (填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(3)下列有关青蒿素(如图所示)研究的说法正确的是___________。
(4)青蒿素分子中的含氧官能团除过氧基(-O-O-)外,还有___________ (写名称)。
 .完成下列填空。
.完成下列填空。
(5) 表示的有机物的分子式为
表示的有机物的分子式为___________ ;其中碳原子的杂化方式有___________ 种。
(6)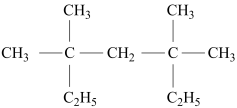 的系统命名法名称是
的系统命名法名称是___________ ,其一氯代物有___________ 种。
(7)某有机物经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,下图是该有机物的质谱图,则其相对分子质量为___________ ,分子式为___________ 。
 .青蒿素是烃的含氧衍生物,为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃,从青蒿素中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚萃取法和汽油浸取法。乙醚浸取法的主要工艺如图所示:
.青蒿素是烃的含氧衍生物,为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃,从青蒿素中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚萃取法和汽油浸取法。乙醚浸取法的主要工艺如图所示: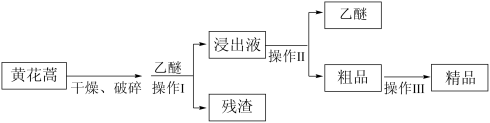
 、
、 中,不会用到的装置是
中,不会用到的装置是A. B.
B.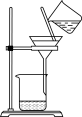 C.
C.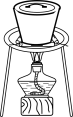
 的主要过程可能是
的主要过程可能是A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(3)下列有关青蒿素(如图所示)研究的说法正确的是___________。
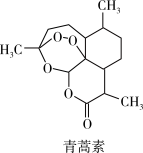
| A.利用黄花蒿茎叶研究青蒿素结构的基本步骤:分离、提纯→元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式 |
| B.可用X射线衍射测定分子的空间结构 |
| C.元素分析仪可以确定青蒿素中是否含有C、H、O等元素 |
| D.可用质谱法确定分子中含有何种官能团的信息 |
(4)青蒿素分子中的含氧官能团除过氧基(-O-O-)外,还有
 .完成下列填空。
.完成下列填空。(5)
 表示的有机物的分子式为
表示的有机物的分子式为(6)
 的系统命名法名称是
的系统命名法名称是(7)某有机物经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,下图是该有机物的质谱图,则其相对分子质量为

您最近一年使用:0次
名校
10 . 室温下可见光催化合成技术,对于人工模仿自然界、发展有机合成新方法意义重大。一种基于 、碘代烃类等,合成化合物ⅶ的路线如下(加料顺序、反应条件略):
、碘代烃类等,合成化合物ⅶ的路线如下(加料顺序、反应条件略):___________ 。化合物x为i的同分异构体,且在核磁共振氢谱上只有2组峰。x的结构简式为___________ (写一种),其名称为___________ 。
(2)反应②中,化合物ⅲ与无色无味气体y反应,生成化合物ⅳ,原子利用率为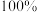 。y为
。y为___________ 。
(3)关于反应⑤的说法中,不正确的有_______。
(4)以苯、乙烯和 为含碳原料,利用反应③和⑤的原理,合成化合物ⅷ。
为含碳原料,利用反应③和⑤的原理,合成化合物ⅷ。
(a)最后一步反应中,有机反应物为___________ (写结构简式)。
(b)相关步骤涉及到烯烃制醇反应,其化学方程式为___________ 。
(c)从苯出发,第一步的化学方程式为___________ (注明反应条件)。
 、碘代烃类等,合成化合物ⅶ的路线如下(加料顺序、反应条件略):
、碘代烃类等,合成化合物ⅶ的路线如下(加料顺序、反应条件略):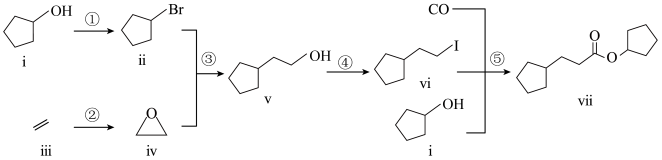
(2)反应②中,化合物ⅲ与无色无味气体y反应,生成化合物ⅳ,原子利用率为
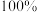 。y为
。y为(3)关于反应⑤的说法中,不正确的有_______。
A.反应过程中,有 键和 键和 键断裂 键断裂 |
B.反应过程中,有 双键和 双键和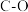 单键形成 单键形成 |
C.反应物i中,氧原子采取 杂化,并且存在手性碳原子 杂化,并且存在手性碳原子 |
D. 属于极性分子,分子中存在由p轨道“头碰头”形成的 属于极性分子,分子中存在由p轨道“头碰头”形成的 键 键 |
(4)以苯、乙烯和
 为含碳原料,利用反应③和⑤的原理,合成化合物ⅷ。
为含碳原料,利用反应③和⑤的原理,合成化合物ⅷ。
(a)最后一步反应中,有机反应物为
(b)相关步骤涉及到烯烃制醇反应,其化学方程式为
(c)从苯出发,第一步的化学方程式为
您最近一年使用:0次



