1 . 碳是地球上组成生命的最基本元素之一,可以sp3、sp2和sp杂化轨道成共价键,具有很强的结合能力,与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态碳原子核外有__________种空间运动状态的电子,其价电子排布图为 。
(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为 ,其碳原子杂化轨道类型为 杂化。
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:

试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?
(4)碳的一种同素异形体——C60,又名足球烯,是一种高度对称的球碳分子。立方烷(分子式:C8H8,结构是立方体: )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为

(5)碳的另一种同素异形体——石墨,其晶体结构如上图所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为 个。已知石墨的密度为ρg.cm-3 ,C-C键长为rcm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距为 cm。
(1)基态碳原子核外有__________种空间运动状态的电子,其价电子排布图为 。
(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为 ,其碳原子杂化轨道类型为 杂化。
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:

试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?
(4)碳的一种同素异形体——C60,又名足球烯,是一种高度对称的球碳分子。立方烷(分子式:C8H8,结构是立方体:
 )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为 
(5)碳的另一种同素异形体——石墨,其晶体结构如上图所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为 个。已知石墨的密度为ρg.cm-3 ,C-C键长为rcm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距为 cm。
您最近一年使用:0次
名校
解题方法
2 . 氮化镓是第三代半导体材料,是坚硬的高熔点材料,常用金属有机物气相沉积法大批量生产。用三甲基镓与氨反应制备氮化镓的原理为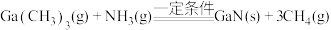 。下列说法错误的是
。下列说法错误的是
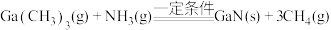 。下列说法错误的是
。下列说法错误的是A. 和 和 的 的 模型相同 模型相同 |
B.基态 原子的电子排布式: 原子的电子排布式: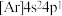 |
C. 中仅含有极性键 中仅含有极性键 |
D. 和N可形成共价晶体 和N可形成共价晶体 |
您最近一年使用:0次
名校
3 . 己二酸是一种重要的化工原料,在现有工业路线基础上,研究提出了“绿色”合成路线:
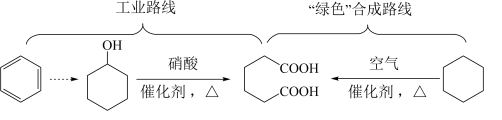
A.苯环中含有C—C键和 键 键 |
| B.—COOH是亲水基团,—OH是疏水基团 |
| C.图中“绿色”合成路线的原子利用率小于100% |
| D.己二酸、环己醇中碳原子杂化方式完全相同 |
您最近一年使用:0次
2024-04-15更新
|
135次组卷
|
2卷引用:2024届甘肃省白银市靖远县高三下学期二模化学试题
名校
4 . 利用硼烷独特温和的化学选择性可还原羧酸﹐其机理如下:

| A.过程①的进行与硼原子的缺电子有关 |
| B.整个过程中硼的杂化方式不发生改变 |
| C.过程⑥的反应类型属于取代反应 |
| D.根据上述机理猜测硼烷还可还原酯基 |
您最近一年使用:0次
2024-04-10更新
|
160次组卷
|
2卷引用:2024届甘肃省白银市靖远县第一中学高三下学期模拟预测化学试题
5 . 我国科学家成功利用 人工合成淀粉,使淀粉生产方式从农耕种植转变为工业制造成为可能,其部分转化过程如下:
人工合成淀粉,使淀粉生产方式从农耕种植转变为工业制造成为可能,其部分转化过程如下:

已知, 是两性氧化物;
是两性氧化物;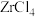 在加热条件下可御底水解制得
在加热条件下可御底水解制得 。
。
下列有关物质关系的说法正确的是
| A.转化过程中涉及的含碳化合物中的碳原子只有两种杂化方式 |
B. 可与水互溶,主要原因是二者均为极性分子 可与水互溶,主要原因是二者均为极性分子 |
C.第一电离能由大到小的顺序为 |
| D.升高温度一定可以加快反应②的反应速率 |
您最近一年使用:0次
解题方法
6 . 化学用语是表述化学学科知识的专业语言符号。下列说法不正确的是
| A.基态Cr原子的价电子排布式:3d54s1 |
B.Cl2O的电子式:  |
C.OF2和 的VSEPR模型均为四面体形 的VSEPR模型均为四面体形 |
| D.ICl和NH3均为极性分子 |
您最近一年使用:0次
名校
7 . 下列说法正确的有几个
①最外层电子数为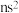 的元素都在元素周期表的第2列
的元素都在元素周期表的第2列
②分子中一定存在 键,不一定存在
键,不一定存在 键
键
③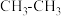 、
、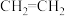 、
、 中碳碳键键长相同
中碳碳键键长相同
④基态原子的价电子排布为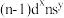 的元素,其族序数一定为
的元素,其族序数一定为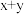
⑤ 核外电子跃迁过程中形城了发射光谱
核外电子跃迁过程中形城了发射光谱
⑥ 与
与 空间结构为V形且中心原子均为
空间结构为V形且中心原子均为 杂化
杂化
①最外层电子数为
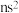 的元素都在元素周期表的第2列
的元素都在元素周期表的第2列②分子中一定存在
 键,不一定存在
键,不一定存在 键
键③
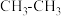 、
、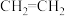 、
、 中碳碳键键长相同
中碳碳键键长相同④基态原子的价电子排布为
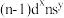 的元素,其族序数一定为
的元素,其族序数一定为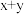
⑤
 核外电子跃迁过程中形城了发射光谱
核外电子跃迁过程中形城了发射光谱⑥
 与
与 空间结构为V形且中心原子均为
空间结构为V形且中心原子均为 杂化
杂化| A.0个 | B.1个 | C.2个 | D.3个 |
您最近一年使用:0次
2024-02-19更新
|
318次组卷
|
4卷引用:甘肃省武山县第一高级中学2023-2024学年高二下学期第一次月考化学试卷
名校
解题方法
8 . 四氨合铜离子一般写作 实际上应该是
实际上应该是 ,结构如图所示。由于姜泰勒(Jahn—Teller)效应的缘故,使其中的两个水的配位键被拉长。下列有关该离子的说法错误的是
,结构如图所示。由于姜泰勒(Jahn—Teller)效应的缘故,使其中的两个水的配位键被拉长。下列有关该离子的说法错误的是
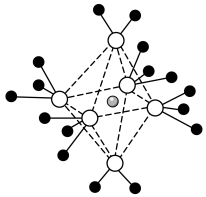
 实际上应该是
实际上应该是 ,结构如图所示。由于姜泰勒(Jahn—Teller)效应的缘故,使其中的两个水的配位键被拉长。下列有关该离子的说法错误的是
,结构如图所示。由于姜泰勒(Jahn—Teller)效应的缘故,使其中的两个水的配位键被拉长。下列有关该离子的说法错误的是
| A.Cu的配位数为6 | B.受热时先失去H2O |
| C.配位原子形成八面体结构 | D. 中Cu为sp3杂化 中Cu为sp3杂化 |
您最近一年使用:0次
名校
解题方法
9 . 金属镍广泛应用于制造记忆合金、储氢合金以及用作加氢反应的催化剂,是重要的战略物资,但资源匮乏。从某废镍渣(含 、NiO、FeO、
、NiO、FeO、 )中回收金属镍并转化为
)中回收金属镍并转化为 的流程如图所示:
的流程如图所示:
(1)“滤液A”中主要溶质的化学式为________ 。
(2)“焙烧”后金属元素以硫酸盐的形式存在,写出NiO与 反应的化学方程式:
反应的化学方程式:_______ 。
(3)使用95℃热水“溶解”后过滤,所得“滤渣”的主要成分的化学式是______ 。
(4)①“萃取”时发生反应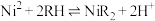 (RH为萃取剂),一定条件下,萃取平衡时,
(RH为萃取剂),一定条件下,萃取平衡时, ,则
,则 的苯取率为
的苯取率为_______ 。
②反萃取获得 ,溶液的实验操作是
,溶液的实验操作是______ 。
(5) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料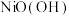 ,该反应的离子方程式为
,该反应的离子方程式为_________ 。
(6)镍能形成多种不同的化合物。图a是镍的一种配合物结构,图b是镍的一种氧化物的结构,下列说法不正确的是_________(填字母)。
 、NiO、FeO、
、NiO、FeO、 )中回收金属镍并转化为
)中回收金属镍并转化为 的流程如图所示:
的流程如图所示:
(1)“滤液A”中主要溶质的化学式为
(2)“焙烧”后金属元素以硫酸盐的形式存在,写出NiO与
 反应的化学方程式:
反应的化学方程式:(3)使用95℃热水“溶解”后过滤,所得“滤渣”的主要成分的化学式是
(4)①“萃取”时发生反应
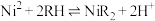 (RH为萃取剂),一定条件下,萃取平衡时,
(RH为萃取剂),一定条件下,萃取平衡时, ,则
,则 的苯取率为
的苯取率为②反萃取获得
 ,溶液的实验操作是
,溶液的实验操作是(5)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料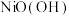 ,该反应的离子方程式为
,该反应的离子方程式为(6)镍能形成多种不同的化合物。图a是镍的一种配合物结构,图b是镍的一种氧化物的结构,下列说法不正确的是_________(填字母)。
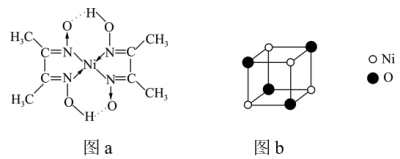
A.图a中,电负性 |
| B.图a分子中存在的化学键有共价键、配位键、氢键 |
| C.图b是氧化镍(NiO)的一个晶胞 |
D.氧化镍中 、 、 的配位数都是6 的配位数都是6 |
您最近一年使用:0次
2024-01-05更新
|
256次组卷
|
5卷引用:甘肃省酒泉育英中学等多校2023-2024学年高三上学期12月一轮复习联考(四)化学试题
名校
10 . 氰化、水解法合成布洛芬的流程如图所示。下列说法错误的是


| A.X分子中的所有C原子可能共平面 |
| B.Y分子中碳原子杂化方式共有3种 |
| C.X→Y氰化过程发生的反应属于加成反应 |
D.布洛芬与金属钠、 、NaOH均能反应 、NaOH均能反应 |
您最近一年使用:0次
2023-12-15更新
|
157次组卷
|
2卷引用:甘肃省武威市民勤县第一中学2023-2024学年高二上学期第二次月考化学试题



