解题方法
1 . X、Y、Z、R、Q是元素周期表中原子序数依次增大的前四周期元素。X元素中的一种核素没有中子;基态Y原子核外电子占据了3种能量不同的原子轨道,且成对电子数是未成对电子数的2倍;Z与R同主族,二者核电荷数之比为1∶2;Q元素基态原子最外层只有一个电子,且内层电子全部充满。
请用化学用语回答下列问题:
(1)元素Q的名称为______ ,其基态价电子轨道表示式为______ 。
(2)元素Y、R得电子能力:_______>______(填元素符号)_______ ,请设计一个简易可行的实验方案予以证明______ 。
(3)Z、R分别与X形成18e-分子A、B,写出A的电子式______ ;已知A、B混合有淡黄色物质产生,则该反应的化学方程式为______ 。
(4)D-青霉胺治疗Wilson氏病症的原理是与Q2+生成无毒螯合物M,从而排除体内Q元素。反应如图:

①D-青霉胺中S的孤电子对数为_______ 。
②含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。1molM中通过螯合作用形成的配位键有______ mol。
请用化学用语回答下列问题:
(1)元素Q的名称为
(2)元素Y、R得电子能力:_______>______(填元素符号)
(3)Z、R分别与X形成18e-分子A、B,写出A的电子式
(4)D-青霉胺治疗Wilson氏病症的原理是与Q2+生成无毒螯合物M,从而排除体内Q元素。反应如图:

①D-青霉胺中S的孤电子对数为
②含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。1molM中通过螯合作用形成的配位键有
您最近一年使用:0次
2 . 砷化镓(GaAs)、碲化镉(CdTe)等材料,可以直接把光能转化成电能。回答下列问题:
(1)元素As与N同族,预测As的氢化物分子的空间构型为____ ;键角:AsH3____ NH3(填“>”、“<”或“=”)。
(2)经X射线衍射实验证明TeF6分子呈八面体结构,则Te原子的杂化类型为___ (填序号)。
a.sp3 b.sp3d2 c.d2sp3 d.sp3d
TeF6与SF6具有相似的结构,则相同状况下的熔沸点:TeF6___ SF6(填“>”、“<”或“=”)。
(3)二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用图表示,已知光的波长与其能量成反比,则图中实现光响应的波长:λ1____ λ2,(填“>”或“<”或“=”),其原因是____ 。

(4)CdTe的晶胞属立方晶系,晶胞参数如图1所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。如原子M的坐标为(0,0,0),则原子N的坐标为____ 。

该晶胞沿其面对角线方向上的投影如图2所示,则代表Te原子的位置是____ (填序号),晶胞中原子9和11之间的距离为____ 。
(1)元素As与N同族,预测As的氢化物分子的空间构型为
(2)经X射线衍射实验证明TeF6分子呈八面体结构,则Te原子的杂化类型为
a.sp3 b.sp3d2 c.d2sp3 d.sp3d
TeF6与SF6具有相似的结构,则相同状况下的熔沸点:TeF6
(3)二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用图表示,已知光的波长与其能量成反比,则图中实现光响应的波长:λ1

(4)CdTe的晶胞属立方晶系,晶胞参数如图1所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。如原子M的坐标为(0,0,0),则原子N的坐标为

该晶胞沿其面对角线方向上的投影如图2所示,则代表Te原子的位置是
您最近一年使用:0次
2022-09-05更新
|
271次组卷
|
2卷引用:山东省泰安市2021-2022学年高二下学期期末考试化学试题
解题方法
3 . 下列说法正确的是
| A.由分子组成的物质中一定存在化学键 |
| B.某化合物熔融态能导电,证明该化合物中含有离子键 |
| C.共价化合物中一定含有共价键,也可能含有离子键 |
D.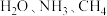 三分子中, 三分子中, 键角最大 键角最大 |
您最近一年使用:0次
解题方法
4 . 下表为元素周期表的一部分,其中的字母代表对应的元素。
回答下列问题:

(1)A、B、C、D四种元素的电负性由大到小的顺序是________ (用元素符号表示)。
(2)BD 离子的中心原子杂化类型为
离子的中心原子杂化类型为________ ,空间构型为________ 。
(3)基态E原子中,核外电子占据最高能层的符号是________ ,占据该能层电子的电子云轮廓图形状为________ ,与其最外层电子数相等的同周期元素还有________ 种。
(4)F元素是________ 区元素,其基态原子价电子排布为________ ;配合物[F(C2A4)2(C3)2]中,F的配位数是6,配位体是________ (写化学式)。
(5)X-射线衍射研究证明,固体C2D5是由直线形的W+和平面三角形的Y-组成,则Y-的化学式为________ ,W+中σ键和π键数目(不考虑大π键)之比为________ 。
回答下列问题:

(1)A、B、C、D四种元素的电负性由大到小的顺序是
(2)BD
 离子的中心原子杂化类型为
离子的中心原子杂化类型为(3)基态E原子中,核外电子占据最高能层的符号是
(4)F元素是
(5)X-射线衍射研究证明,固体C2D5是由直线形的W+和平面三角形的Y-组成,则Y-的化学式为
您最近一年使用:0次
名校
5 . 磷和砷的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)红磷是巨型共价分子,无定型结构,下列方法能证明红磷是非晶体的是_____ 。
A 质谱法 B 原子发射光谱法 C 核磁共振谱法 D X射线衍射法
(2)第一电离能介于Al、P之间的第三周期元素有___ 种。GaCl3分子中心原子的杂化方式为___ 。
(3)基态As原子的核外电子排布式为_____ ,As原子的逐级电离能数据如下:
为什么第五电离能与第六电离能相差较大_____________ 。
(4)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________ 。

(5)黑磷是新型二维半导体材料,具有片层结构(如下图所示),P原子的杂化形式为_____ ,层与层之间的相互作用为_____ 。


(6)GaAs的熔点为1238℃,且熔融状态不导电,其晶胞结构如下图所示,该晶体的类型为_____ ,每个As原子周围最近的As原子数目为_____ ,一个GaAs晶胞中配位键的数目为_____ 。

(7)已知GaAs的密度为dg/cm3,摩尔质量为Mg/mol,阿伏加 德罗常数用NA表示,则晶胞中最近的As和Ga原子核间距为_____ nm(列式表示)。
(1)红磷是巨型共价分子,无定型结构,下列方法能证明红磷是非晶体的是
A 质谱法 B 原子发射光谱法 C 核磁共振谱法 D X射线衍射法
(2)第一电离能介于Al、P之间的第三周期元素有
(3)基态As原子的核外电子排布式为
| 第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | 第五电离能 | 第六电离能 |
| 947.0 | 1798 | 2735 | 4837 | 6043 | 12310 |
为什么第五电离能与第六电离能相差较大
(4)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是

(5)黑磷是新型二维半导体材料,具有片层结构(如下图所示),P原子的杂化形式为


(6)GaAs的熔点为1238℃,且熔融状态不导电,其晶胞结构如下图所示,该晶体的类型为

(7)已知GaAs的密度为dg/cm3,摩尔质量为Mg/mol,阿伏加 德罗常数用NA表示,则晶胞中最近的As和Ga原子核间距为
您最近一年使用:0次
解题方法
6 . 离子液体是在室温附近温度下呈液体状态的盐类物质,一般由有机阳离子和无机阴离子组成。已知: 表示阿伏加德罗常数的值。下列关于离子液体
表示阿伏加德罗常数的值。下列关于离子液体 的说法错误的是
的说法错误的是
 表示阿伏加德罗常数的值。下列关于离子液体
表示阿伏加德罗常数的值。下列关于离子液体 的说法错误的是
的说法错误的是| A.该物质的熔沸点比氯化钠的高 |
B. 的空间构型为正四面体形 的空间构型为正四面体形 |
C. 中含有配位键的数目为 中含有配位键的数目为 |
D. 中 中 杂化的原子数目为 杂化的原子数目为 |
您最近一年使用:0次
名校
解题方法
7 . 回答下列问题。
(1)青蒿素是我国科学家从传统中药中发现的能治疗疟疾的有机化合物,其分子结构如图所示,它可以用溶剂A从中药中提取出来,得到“提取液”后,再经“一系列操作”即可分离出青蒿素,结构如下图所示。下列有关说法正确的有___________
②青蒿素的分子式为C14H20O5
③青蒿素分子中具有的官能团有酮羰基和醚键
④用溶剂A从中药中提取出青蒿素的实验操作是萃取
⑤青蒿素分子中含有7个手性碳原子
(2)化合物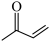 有多种同分异构体,写出满足以下条件的同分异构体结构简式
有多种同分异构体,写出满足以下条件的同分异构体结构简式 ___________ ;写出其与银氨溶液反应的方程式___________ 。
①能与银氨溶液发生反应;②核磁共振氢谱中共含有三组吸收峰。
(3)甘氨酸铜有顺式和反式两种同分异构,结构如图___________ (填序号)
a.sp b.sp2 c.sp3 d.dsp2
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜不能溶于水,原因可能是___________ 。
(4)C、H、O、N是生命元素。下列说法正确的是___________。
(1)青蒿素是我国科学家从传统中药中发现的能治疗疟疾的有机化合物,其分子结构如图所示,它可以用溶剂A从中药中提取出来,得到“提取液”后,再经“一系列操作”即可分离出青蒿素,结构如下图所示。下列有关说法正确的有
②青蒿素的分子式为C14H20O5
③青蒿素分子中具有的官能团有酮羰基和醚键
④用溶剂A从中药中提取出青蒿素的实验操作是萃取
⑤青蒿素分子中含有7个手性碳原子
(2)化合物
 有多种同分异构体,写出满足以下条件的同分异构体结构简式
有多种同分异构体,写出满足以下条件的同分异构体结构简式 ①能与银氨溶液发生反应;②核磁共振氢谱中共含有三组吸收峰。
(3)甘氨酸铜有顺式和反式两种同分异构,结构如图
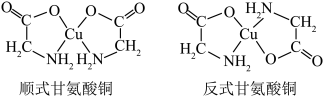
a.sp b.sp2 c.sp3 d.dsp2
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜不能溶于水,原因可能是
(4)C、H、O、N是生命元素。下列说法正确的是___________。
| A.第一电离能:O>N>C>H |
| B.电负性:O>N>C>H |
C.酸性: |
D.键角: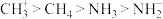 |
您最近一年使用:0次
名校
8 . 氮的某种氧化物晶胞结构如图所示,由两种离子构成,下列说法错误的是

| A.晶胞中阴阳离子中N原子杂化类型不同 |
B.晶体密度: |
| C.阳离子中N—O键长<阴离子中N—O键长 |
| D.该氧化物发生水解反应的产物只有一种 |
您最近一年使用:0次
2024-05-31更新
|
159次组卷
|
2卷引用:2024届山东省日照市五莲县第一中学高三下学期模拟预测化学试题
9 . 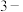 丁烯腈(
丁烯腈( )为无色透明液体,主要用于有机合成和作聚合交联剂等。下列说法错误的是
)为无色透明液体,主要用于有机合成和作聚合交联剂等。下列说法错误的是
| A.可形成分子晶体 | B.分子中 键与 键与 键数目之比为 键数目之比为 |
| C.分子中的碳原子有3种杂化方式 | D.其同分异构体中不可能存在五元环 |
您最近一年使用:0次
2024-05-31更新
|
189次组卷
|
2卷引用:山东省日照市五莲天立学校2024届高三(高复)下学期二模前模拟考试化学试题
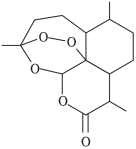
10 . 某有机物的分子结构如图所示,下列关于该分子的说法正确的是

| A.该分子中含有三种含氧官能团 |
B. 该分子最多只能与 该分子最多只能与 溴单质发生反应 溴单质发生反应 |
| C.该有机物可发生加成反应、中和反应、酯化反应和加聚反应 |
| D.该有机物中的碳原子有2种杂化方式 |
您最近一年使用:0次



