名校
1 . 回答下列问题:
(1)根据价层电子对互斥模型, 分子中心原子孤电子对数是
分子中心原子孤电子对数是_______ , 分子的空间构型是
分子的空间构型是_______ 。
(2)气态三氧化硫以单分子形式存在,属于_______ 分子(填“极性”、“非极性”),固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为_______ 。
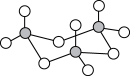
(3) 中心原子的价层电子对数为
中心原子的价层电子对数为_______ ,写出一个与 VEEPR模型相同的离子
VEEPR模型相同的离子_______ 。
(4)下列表述中,不能证明氯的非金属性比硫强的是_______ 。
A.气态氢化物的稳定性:
B.两元素的电负性: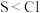
C.高价含氧酸的酸性: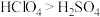
D.常温时,硫单质为固态,氯单质为气态
E.两者间可发生反应: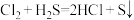
(1)根据价层电子对互斥模型,
 分子中心原子孤电子对数是
分子中心原子孤电子对数是 分子的空间构型是
分子的空间构型是(2)气态三氧化硫以单分子形式存在,属于

(3)
 中心原子的价层电子对数为
中心原子的价层电子对数为 VEEPR模型相同的离子
VEEPR模型相同的离子(4)下列表述中,不能证明氯的非金属性比硫强的是
A.气态氢化物的稳定性:

B.两元素的电负性:
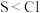
C.高价含氧酸的酸性:
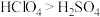
D.常温时,硫单质为固态,氯单质为气态
E.两者间可发生反应:
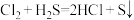
您最近一年使用:0次
解题方法
2 . 含硼物质在储氢、有机合成、超导等方面有广泛用途。
(1)金属催化剂M(Co、Ni)催化硼氢化钠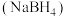 水解释放
水解释放 机理如下图所示:
机理如下图所示:
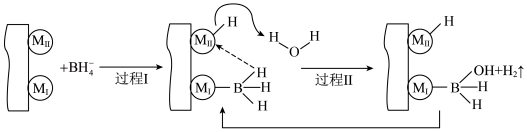
①基态Co原子的电子排布式为___________ ,其中未成对电子有___________ 个。
②过程Ⅱ中形成化学键的类型有___________ (填序号)。
A.离子键 B.金属键 C.极性键 D.非极性键
③ 最终会转化为
最终会转化为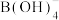 ,1个
,1个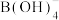 中存在
中存在___________ 个配位键。
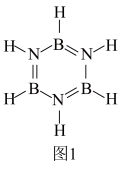
(2)有机电子器件产品环硼氮六烷的结构如图1所示,环硼氮六烷在热水中比冷水中溶解度显著增大的主要原因是___________ 。
(3)氮化硼有多种晶体结构。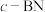 是一种与金刚石类似的正四面体结构晶体;
是一种与金刚石类似的正四面体结构晶体;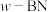 是一种硼和氮原子之间的成键方式与
是一种硼和氮原子之间的成键方式与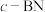 类似的晶体;
类似的晶体;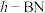 是一种类似石墨的蜂窝六边形层状结构晶体。它们的晶体结构如图2所示。
是一种类似石墨的蜂窝六边形层状结构晶体。它们的晶体结构如图2所示。

①下列有关说法,正确的是___________ (填序号)。
A.三种BN晶体中B—N键的键长相等
B.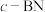 晶体的硬度较大
晶体的硬度较大
C.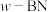 中B原子采取的杂化方式是
中B原子采取的杂化方式是
D.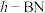 具有一定的润滑性
具有一定的润滑性
②已知氮化铝(AlN)晶体也是一种微粒之间以共价键结合的晶体,请用结构知识解释BN晶体熔点比 高的原因
高的原因___________ 。
(4)镁粉与硼粉在一定条件下可合成一种超导体,其晶胞结构如图Ⅰ、Ⅱ所示,则其化学式为___________ 。

(1)金属催化剂M(Co、Ni)催化硼氢化钠
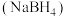 水解释放
水解释放 机理如下图所示:
机理如下图所示:
①基态Co原子的电子排布式为
②过程Ⅱ中形成化学键的类型有
A.离子键 B.金属键 C.极性键 D.非极性键
③
 最终会转化为
最终会转化为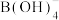 ,1个
,1个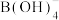 中存在
中存在(2)有机电子器件产品环硼氮六烷的结构如图1所示,环硼氮六烷在热水中比冷水中溶解度显著增大的主要原因是

(3)氮化硼有多种晶体结构。
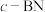 是一种与金刚石类似的正四面体结构晶体;
是一种与金刚石类似的正四面体结构晶体;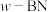 是一种硼和氮原子之间的成键方式与
是一种硼和氮原子之间的成键方式与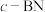 类似的晶体;
类似的晶体;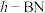 是一种类似石墨的蜂窝六边形层状结构晶体。它们的晶体结构如图2所示。
是一种类似石墨的蜂窝六边形层状结构晶体。它们的晶体结构如图2所示。
①下列有关说法,正确的是
A.三种BN晶体中B—N键的键长相等
B.
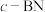 晶体的硬度较大
晶体的硬度较大C.
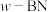 中B原子采取的杂化方式是
中B原子采取的杂化方式是
D.
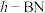 具有一定的润滑性
具有一定的润滑性②已知氮化铝(AlN)晶体也是一种微粒之间以共价键结合的晶体,请用结构知识解释BN晶体熔点比
 高的原因
高的原因(4)镁粉与硼粉在一定条件下可合成一种超导体,其晶胞结构如图Ⅰ、Ⅱ所示,则其化学式为

您最近一年使用:0次
名校
解题方法
3 . 我国的激光技术在世界上处于领先地位。据报道,有科学家用激光溅射技术成功研制出氮化碳薄膜。分析表明,β-氮化碳的硬度可以媲美金刚石,成为首屈一指的超硬新材料,其结构如图。下列有关β-氮化碳的说法错误的是


| A.属于共价晶体 | B.化学式为 |
C.碳、氮原子均采取 杂化 杂化 | D.1molβ-氮化碳中含有4mol N—C键 |
您最近一年使用:0次
名校
解题方法
4 . X、Y、Z、D、E、F均为前四周期原子序数依次增大的元素。X原子的L电子层的p能级上有一个空轨道;Z的最外层有6个运动状态不同电子;D与Z同主族;E、F是同族且原子序数差2的元素。
(1)下列关于X2H4分子和H2Z2分子的说法正确的是____________。
(2)X、Y、Z三种元素中的两种,能形成原子个数比为1:3的阴离子,推测这种微粒的空间构型为___________ 。
(3)①YH3②三氯化硼③YCl3三种物质键角排序:____________ (用序号表示)。
(4)F与XZ能形成挥发性液体F(XZ)4,则其固体属于______________ 晶体。
(5)X和D形成的化合物XD2为一种液体溶剂,其分子中的σ键和π键数目之比为_____________ ,该化合物____________ (填“易”或“难”)溶于水,原因为_____________ 。
(1)下列关于X2H4分子和H2Z2分子的说法正确的是____________。
| A.分子中都含有σ键和π键 | B.中心原子都sp2杂化 |
| C.都是含极性键和非极性键的非极性分子 | D.X2H4分子的沸点明显低于H2Z2分子 |
(2)X、Y、Z三种元素中的两种,能形成原子个数比为1:3的阴离子,推测这种微粒的空间构型为
(3)①YH3②三氯化硼③YCl3三种物质键角排序:
(4)F与XZ能形成挥发性液体F(XZ)4,则其固体属于
(5)X和D形成的化合物XD2为一种液体溶剂,其分子中的σ键和π键数目之比为
您最近一年使用:0次
名校
5 . 近年来一些近海的煤电厂利用海水微碱性(8.0≤pH≤8.3)开发海水脱硫新工艺。主要原理是:工业烟气中的SO2与海水生成H2SO3,H2SO3被进一步氧化成SO 。脱硫后海水酸性增强,与新鲜海水中的CO
。脱硫后海水酸性增强,与新鲜海水中的CO 和HCO
和HCO 反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。下列有关SO3、SO2、CO2的说法正确的是
反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。下列有关SO3、SO2、CO2的说法正确的是
 。脱硫后海水酸性增强,与新鲜海水中的CO
。脱硫后海水酸性增强,与新鲜海水中的CO 和HCO
和HCO 反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。下列有关SO3、SO2、CO2的说法正确的是
反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。下列有关SO3、SO2、CO2的说法正确的是| A.SO3的空间构型为平面正三角形 | B.键角:CO2>SO2>SO3 |
| C.SO2中硫原子的杂化轨道类型是sp3 | D.CO2、SO2都是非极性分子 |
您最近一年使用:0次
2023-05-09更新
|
219次组卷
|
3卷引用:不定项选择题
6 . 硒(Se)是人体必需的微量元素之一,含硒化合物在材料和药物领域具有重要应用。一种含Se的新型AIE分子(IV)的合成路线如图:

下列说法错误的是

下列说法错误的是
A.N原子的基态电子轨道表示式为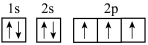 |
| B.I能发生取代反应和加成反应 |
| C.II中碳原子的杂化轨道类型为sp2杂化 |
| D.II中所有碳原子可能共平面 |
您最近一年使用:0次
名校
7 . 近年来,我国航天科技事业取得了辉煌的成就。下列说法错误的是
| A.嫦娥五号带回的月壤样品中的主要氧化物SiO2属于离子晶体 |
| B.某型长征运载火箭以液氧和煤油为推进剂,氧气的同素异形体臭氧是极性分子 |
| C.(Ca8Y)Fe(PO4)7是月壤中发现的新型静态矿物,矿物中的Fe位于周期表中的ds区 |
D.航天器部件应用了特种石墨材料,石墨中碳原子杂化轨道类型是 |
您最近一年使用:0次
2024-05-04更新
|
61次组卷
|
2卷引用:海南省文昌中学2023-2024学年高二下学期第一次月考化学试题
解题方法
8 . 在碱性条件下,硫砷铁矿主要采取氧压浸出的方法脱砷,有关反应的离子方程式为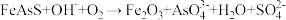 (未配平,
(未配平, 中
中 、S的化合价与
、S的化合价与 中相同)。下列说法错误的是
中相同)。下列说法错误的是
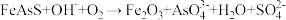 (未配平,
(未配平, 中
中 、S的化合价与
、S的化合价与 中相同)。下列说法错误的是
中相同)。下列说法错误的是A.该反应中氧化剂是 被氧化 被氧化 |
B. 中 中 的杂化轨道类型为 的杂化轨道类型为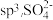 的空间结构为正四面体形 的空间结构为正四面体形 |
C.参加反应的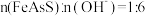 |
D.基态 原子核外未成对电子数为3, 原子核外未成对电子数为3, 属于周期表的副族元素 属于周期表的副族元素 |
您最近一年使用:0次
9 . 根据如图所示,下列说法错误的是

| A.第三周期某元素的前5个电子的电离能如图1所示,则该元素是Al |
| B.图2表示石墨晶体结构,石墨晶体既存在共价键又存在范德华力,属于混合型晶体 |
| C.图3 中60 g SiO2晶体中所含共价键数目为2NA (NA是阿伏加德罗常数的值) |
| D.图4金刚砂晶胞中,所有原子都是sp3杂化,一个晶胞平均占有8个原子 |
您最近一年使用:0次
真题
10 . 氮的化合物种类繁多,应用广泛。
(1)基态N原子的价层电子排布式是___________ 。
(2)与碳氢化合物类似,N、H两元素之间也可以形成氮烷、氮烯。
①下列说法不正确 的是___________ 。
A.能量最低的激发态N原子的电子排布式:
B.化学键中离子键成分的百分数:
C.最简单的氮烯分子式: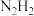
D.氮烷中N原子的杂化方式都是
②氮和氢形成的无环氮多烯,设分子中氮原子数为n,双键数为m,其分子式通式为______ 。
③给出 的能力:
的能力:
_______  (填“>”或“<”),理由是
(填“>”或“<”),理由是___________ 。
(3)某含氮化合物晶胞如图,其化学式为___________ ,每个阴离子团的配位数(紧邻的阳离子数)为___________ 。
(1)基态N原子的价层电子排布式是
(2)与碳氢化合物类似,N、H两元素之间也可以形成氮烷、氮烯。
①下列说法
A.能量最低的激发态N原子的电子排布式:

B.化学键中离子键成分的百分数:

C.最简单的氮烯分子式:
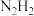
D.氮烷中N原子的杂化方式都是

②氮和氢形成的无环氮多烯,设分子中氮原子数为n,双键数为m,其分子式通式为
③给出
 的能力:
的能力:
 (填“>”或“<”),理由是
(填“>”或“<”),理由是(3)某含氮化合物晶胞如图,其化学式为
您最近一年使用:0次



