1 . 氢能被视为最具发展潜力的清洁能源,开发新型储氢材料是氢能利用的重要研究方向。请回答下列问题:
Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。
(1)基态B原子的价电子排布式为__________ ,B、C、N、O第一电离能由大到小的顺序为__________ ,CH4、H2O、CO2的键角按照由大到小的顺序排列为__________ 。
(2)与(HB=NH)3互为等电子体的有机分子为__________ (填分子式)。
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
(1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图),每个杂环平面上下两侧最多可吸附10个H2分子。

①C16S8分子中C原子和S原子的杂化轨道类型分别为__________ 。
②相关键长数据如表所示:
从表中数据看出,C16S8中碳硫键键长介于C-S键与C=S键之间,原因可能是__________ 。
③C16S8与H2微粒间的作用力是__________ 。
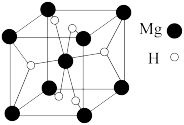
(2)MgH2是金属氢化物储氢材料,其晶胞如图所示,该晶体的密度为ag·cm-3,则晶胞的体积为__________ cm3(用含a、NA的代数式表示,NA表示阿伏加德罗常数的值)。

Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。
(1)基态B原子的价电子排布式为
(2)与(HB=NH)3互为等电子体的有机分子为
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
(1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图),每个杂环平面上下两侧最多可吸附10个H2分子。

①C16S8分子中C原子和S原子的杂化轨道类型分别为
②相关键长数据如表所示:
| 化学键 | C—S | C=S | C16S8中碳硫键 |
| 键长/pm | 181 | 155 | 176 |
③C16S8与H2微粒间的作用力是
(2)MgH2是金属氢化物储氢材料,其晶胞如图所示,该晶体的密度为ag·cm-3,则晶胞的体积为

您最近一年使用:0次
名校
解题方法
2 . 氢能被视为21世纪最具发展潜力的清洁能源,开发高效储氢材料是氢能利用的重要研究方向。
(1)H3BNH3是一种潜在的储氢材料,其中N原子的价电子轨道表达式为____ 。
(2)制备H3BNH3的化学原料为(HB=NH)3,为六元环状物质,与其互为等电子体的有机物分子式为__ ,CH4、H2O、CO2的键角由大到小的顺序为____ ,B、C、N、O的第一电离能由大到小的顺序为_ 。
(3)C16S8是新型环烯类储氢材料,研究证明其分子呈平面结构(如图所示)。

①C16S8分子中C原子和S原子的杂化轨道类型分别为____ 。
②测得C16S8中碳硫键的键长介于C─S和C=S之间,其原因可能是______ 。
(4)某种铜银合金晶体具有储氢功能,它是面心立方最密堆积结构,Cu原子位于面心,Ag原子位于顶点,H原子可进入由Cu原子和Ag原子构成的四面体空隙中。若将Cu、Ag原子等同看待,该晶体储氢后的晶胞结构与CaF2(如图)相似,该晶体储氢后的化学式为_____ 。

(5)MgH2是金属氢化物储氢材料,其晶胞如图所示,该晶体的密度为 ρ g/cm3,则该晶胞的体积为_____ 。(用含ρ、NA的代数式表示即可)
(1)H3BNH3是一种潜在的储氢材料,其中N原子的价电子轨道表达式为
(2)制备H3BNH3的化学原料为(HB=NH)3,为六元环状物质,与其互为等电子体的有机物分子式为
(3)C16S8是新型环烯类储氢材料,研究证明其分子呈平面结构(如图所示)。

①C16S8分子中C原子和S原子的杂化轨道类型分别为
②测得C16S8中碳硫键的键长介于C─S和C=S之间,其原因可能是
(4)某种铜银合金晶体具有储氢功能,它是面心立方最密堆积结构,Cu原子位于面心,Ag原子位于顶点,H原子可进入由Cu原子和Ag原子构成的四面体空隙中。若将Cu、Ag原子等同看待,该晶体储氢后的晶胞结构与CaF2(如图)相似,该晶体储氢后的化学式为

(5)MgH2是金属氢化物储氢材料,其晶胞如图所示,该晶体的密度为 ρ g/cm3,则该晶胞的体积为

您最近一年使用:0次
2020-09-01更新
|
275次组卷
|
5卷引用:宁夏回族自治区银川一中2021届高三上学期第一次月考理综化学试题
2016高二·全国·课时练习
3 . 按照下列元素基态原子的电子排布特征判断元素,并回答问题。
A元素的原子中只有一个能层且只含1个电子;B元素的原子3p轨道上得到1个电子后不能再容纳外来电子;C元素的原子的2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D元素的原子第三能层上有8个电子,第四能层上只有1个电子;E元素原子的外围电子排布为3s23p6。
(1)写出由A、B、C、D中的三种元素组成的化合物的化学式:___________________ (至少写出5个)。
(2)写出用上述元素组成的物质制得A的单质的化学方程式:___________________ 、_______________
(3)检验某溶液中是否含有D+,可通过___________ 反应来实现;检验某溶液中是否含有B-,通常所用的试剂是___________ 和___________ 。
(4)写出E的元素符号:___________ ,要证明太阳上是否含有E元素,可采用的方法是________________ 。
A元素的原子中只有一个能层且只含1个电子;B元素的原子3p轨道上得到1个电子后不能再容纳外来电子;C元素的原子的2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D元素的原子第三能层上有8个电子,第四能层上只有1个电子;E元素原子的外围电子排布为3s23p6。
(1)写出由A、B、C、D中的三种元素组成的化合物的化学式:
(2)写出用上述元素组成的物质制得A的单质的化学方程式:
(3)检验某溶液中是否含有D+,可通过
(4)写出E的元素符号:
您最近一年使用:0次
2017-11-27更新
|
253次组卷
|
3卷引用:宁夏吴忠市2017-2018学年高二人教版选修3化学同步练习:第1章 原子结构与性质综合练习1
宁夏吴忠市2017-2018学年高二人教版选修3化学同步练习:第1章 原子结构与性质综合练习1(已下线)同步君 选修3 第一章 第一节 电子云和原子轨道高中化学人教版 选修三 第1章 原子结构与性质 电子云与原子轨道
名校
解题方法
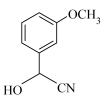
4 .  某有机物A在足量
某有机物A在足量 中充分燃烧,生成水和二氧化碳的质量分别为
中充分燃烧,生成水和二氧化碳的质量分别为 和
和 ,已知A的质谱与红外光谱如图所示,下列说法错误的是
,已知A的质谱与红外光谱如图所示,下列说法错误的是
 某有机物A在足量
某有机物A在足量 中充分燃烧,生成水和二氧化碳的质量分别为
中充分燃烧,生成水和二氧化碳的质量分别为 和
和 ,已知A的质谱与红外光谱如图所示,下列说法错误的是
,已知A的质谱与红外光谱如图所示,下列说法错误的是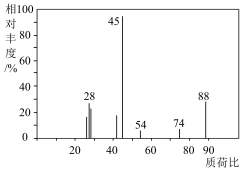

| A.符合A分子结构特征的有机物只有一种 |
| B.有机物A中含有C、H、O三种元素 |
C.有机物A的分子式为 |
D.有机物A中碳原子的杂化方式有 和 和 |
您最近一年使用:0次
名校
解题方法
5 . 电极活性物质Cu4O(PO4)2的制备,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3·H2O = Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O。
(1)上述反应涉及的元素中不属于元素周期表p区元素的是______ ,写出基态Cu2+的电子排布式_______ 。
(2)P、S元素第一电离能大小关系为P_____ S(填“>”、“<”或“=”),原因是___________ 。
(3)O的原子核外有____ 种不同能量的电子,其氢化物沸点高于同族元素H2S的原因是___________ 。
(4)CuSO4溶液中逐滴加入氨水,先产生蓝色沉淀,后又溶解得到深蓝色溶液[Cu(NH3)4]SO4,加入乙醇后有深蓝色沉淀析出,关于该深蓝色物质的说法错误的是______ (填序号),写出沉淀溶解生成深蓝色溶液的离子方程式______ 。
A.该物质正离子的中心是Cu原子 B.该配合物的配体数等于配位数
C.外界离子的中心原子的杂化方式为sp3 D.乙醇的作用是将配合物转化为Cu(OH)2
(5)晶体铜的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示,铜原子的配位数为_____ ,已知铜原子半径为127.8 pm,NA=6.02×1023 mol-1,计算晶体铜的密度______ g·cm-3(写出表达式)。

(1)上述反应涉及的元素中不属于元素周期表p区元素的是
(2)P、S元素第一电离能大小关系为P
(3)O的原子核外有
(4)CuSO4溶液中逐滴加入氨水,先产生蓝色沉淀,后又溶解得到深蓝色溶液[Cu(NH3)4]SO4,加入乙醇后有深蓝色沉淀析出,关于该深蓝色物质的说法错误的是
A.该物质正离子的中心是Cu原子 B.该配合物的配体数等于配位数
C.外界离子的中心原子的杂化方式为sp3 D.乙醇的作用是将配合物转化为Cu(OH)2
(5)晶体铜的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示,铜原子的配位数为

您最近一年使用:0次
名校
解题方法
6 . 味精能增加食品的鲜味,是一种常用的增味剂,其化学名称为谷氢酸钠(结构如图所示),下列有关谷氨酸钠的说法正确的是

| A.所有原子均满足8电子结构 |
B.该物质中碳原子的杂化类型有sp、 和 和 |
| C.该物质中含有2个手性碳原子 |
| D.该物质既可形成分子间氢键又可形成分子内氢键 |
您最近一年使用:0次
名校
7 . 气相离子催化剂(Fe+、Co+、Mn+等)具有优良的催化效果。其中在Fe+催化下乙烷氧化反应的机理如图所示(图中…为副反应),下列说法不正确的是

A.主反应的总反应方程式为:C2H6+2N2O CH3CHO+H2O+2N2 CH3CHO+H2O+2N2 |
| B.每生成1mol CH3CHO消耗N2O的物质的量等于2mol |
| C.CH3CHO中碳原子的杂化方式有sp3和sp2两种 |
| D.X与Y能互溶因为它们的分子结构具有相似性且X与Y能形成分子间氢键 |
您最近一年使用:0次
名校
解题方法
8 . Tapentadol是一种新型止痛药物,合成其中间体ⅷ的路线如下:
(1)化合物ⅰ的分子式为______ ,含有的官能团名称为______ 。
(2)根据化合物iii的结构特征,分析预测其可能的化学性质,完成下表。
(3)反应⑤的方程式可表示为ⅲ+ⅳ→ⅶ+y,化合物y的化学式为______ 。
(4)关于反应⑥的说法中,正确的有______。
(5)化合物x是ⅱ的同分异构体,满足下列条件的同分异构体有______ 种。
a.含有苯环,且苯环上有两个侧链
b.与 溶液反应显紫色
溶液反应显紫色
c.1 mol x与足量Na反应,生成1 mol
(6)以 和NaCN为含碳原料,合成化合物
和NaCN为含碳原料,合成化合物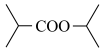 。
。
基于你设计的合成路线,回答下列问题:
①相关步骤涉及到卤代烃制醇反应,其化学方程式为____________ 。
②最后一步反应中,能与 反应产生
反应产生 的有机反应物为
的有机反应物为______ (写结构简式)。
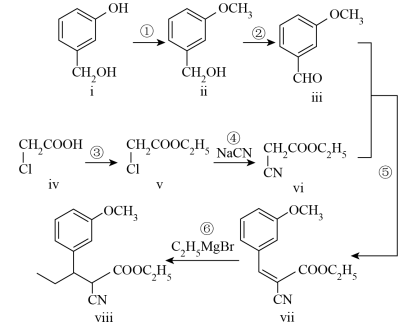
(1)化合物ⅰ的分子式为
(2)根据化合物iii的结构特征,分析预测其可能的化学性质,完成下表。
| 序号 | 反应试剂、条件 | 反应形成的新物质 | 反应类型 |
| a | 新制 、加热 、加热 | ||
| b |
|
(3)反应⑤的方程式可表示为ⅲ+ⅳ→ⅶ+y,化合物y的化学式为
(4)关于反应⑥的说法中,正确的有______。
| A.反应过程中,有π键发生断裂 | B.化合物ⅶ的 杂化的原子只有C 杂化的原子只有C |
| C.化合物ⅶ所有碳原子一定处于同一平面上 | D.化合物ⅷ只有1个手性碳原子 |
(5)化合物x是ⅱ的同分异构体,满足下列条件的同分异构体有
a.含有苯环,且苯环上有两个侧链
b.与
 溶液反应显紫色
溶液反应显紫色c.1 mol x与足量Na反应,生成1 mol

(6)以
 和NaCN为含碳原料,合成化合物
和NaCN为含碳原料,合成化合物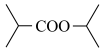 。
。基于你设计的合成路线,回答下列问题:
①相关步骤涉及到卤代烃制醇反应,其化学方程式为
②最后一步反应中,能与
 反应产生
反应产生 的有机反应物为
的有机反应物为
您最近一年使用:0次
2024-03-22更新
|
1265次组卷
|
4卷引用:2024届宁夏银川市唐徕中学高三下学期四模理科综合试题-高中化学
2024届宁夏银川市唐徕中学高三下学期四模理科综合试题-高中化学广东省佛山市2024届高三教学质量检测(一)化学试题(已下线)题型12 有机推断题(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)压轴题14?有机合成与推断(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)-2024年高考化学压轴题专项训练(新高考通用)
名校
9 . 硫酰氟SO2F2是一种低温高效杀虫剂,分子呈四面体型,结构如图所示。下列有关说法不正确的是

| A.硫原子的杂化方式是sp3 |
| B.SO2F2是极性分子 |
| C.键角大小:α>β |
| D.SO2F2分子结构中心对称,不是手性分子 |
您最近一年使用:0次
2024-01-25更新
|
137次组卷
|
3卷引用:宁夏吴忠市吴忠中学2023-2024学年高二下学期第一次月考化学试卷
名校
解题方法
10 . “天问一号”着陆火星,“嫦娥五号”采回月壤,探索宇宙离不开化学。镍铼合金是制造喷气发动机的燃烧室、涡轮叶片及排气喷嘴的重要材料。75号元素铼Re,熔点仅次于钨,是稀有金属之一、回答:
(1)镍基态原子有___________ 种不同空间运动状态的电子,第四周期与基态镍原子单电子数相同的元素有___________ 种(不含镍元素)。
(2)Ni2+与丁二酮肟可形成鲜红色的二丁二酮肟合镍(M= 289 g·mol-1),结构如下图所示。0.2mol二丁二酮肟合镍分子内含有σ键___________ mol,碳碳键是由___________ 轨道重叠形成的。

a.sp3和sp2 b.sp2和 sp2 c.sp2和p d.sp3和p
(3) 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键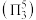 。
。 键角
键角___________  键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因___________ 。
(4)人类合成的第一个稀有气体化合物是XeF+PtF ,PtF
,PtF 中的键角有90°和180°两种。下列关于该化合物的说法中正确的是___________。
中的键角有90°和180°两种。下列关于该化合物的说法中正确的是___________。
(5)三氧化铼晶胞如图所示,摩尔质量为Mg/mol,晶胞密度为bg/cm3,铼原子填在氧原子围成的___________ (填“四面体”“立方体"或“八面体”)空隙中,该晶胞的空间利用率为___________ (铼的原子半径为rRepm,氧原子半径为rOpm,列出计算式)。
(6)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:
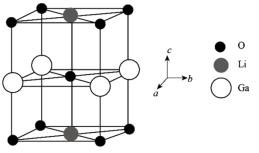
①上述晶胞沿着a轴的投影图为___________ (填字母)。
A. B.
B.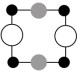 C.
C.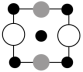
②用 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为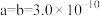 m,
m,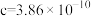 m,则其密度为
m,则其密度为___________  (列出计算式即可)。
(列出计算式即可)。
(1)镍基态原子有
(2)Ni2+与丁二酮肟可形成鲜红色的二丁二酮肟合镍(M= 289 g·mol-1),结构如下图所示。0.2mol二丁二酮肟合镍分子内含有σ键

a.sp3和sp2 b.sp2和 sp2 c.sp2和p d.sp3和p
(3)
 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键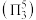 。
。 键角
键角 键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因(4)人类合成的第一个稀有气体化合物是XeF+PtF
 ,PtF
,PtF 中的键角有90°和180°两种。下列关于该化合物的说法中正确的是___________。
中的键角有90°和180°两种。下列关于该化合物的说法中正确的是___________。| A.熔化状态下不能导电 |
| B.XeF+中所有原子都满足8电子稳定结构 |
| C.用两个Cl替换F后,所得PtF4Cl2有两种结构 |
| D.含有离子键、极性键、非极性键和配位键 |
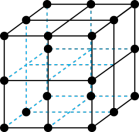
(6)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:

①上述晶胞沿着a轴的投影图为
A.
 B.
B. C.
C.
②用
 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为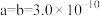 m,
m,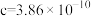 m,则其密度为
m,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次