名校
解题方法
1 . 翡翠的主要成分为NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅,是决定翡翠品质的重要因素之一。
(1)基态Cr3+最外电子层的电子排布图(轨道表示式)为___________ 。
(2)下列状态的铝中,电离最外层一个电子所需能量最大的是___________ ,最小的是___________ (填标号)。
A. B.
B.  C.
C.  D.
D. 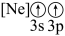
(3)配合物K[Cr(C2O4)(H2O)]中的配体是___________ ,H2O的沸点比CO2的高了许多,主要原因是___________ 。
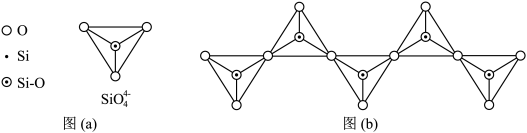
(4)在翡翠等硅酸盐中,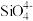 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为___________ ,其化学式为___________ 。低温石英中也存在有顶角相连的硅氧四面体形成螺旋上升的长链,没有封闭的环状结构,这一结构决定了它具有___________ 。
(5)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是___________ 原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为___________ % (列出计算表达式)。

(1)基态Cr3+最外电子层的电子排布图(轨道表示式)为
(2)下列状态的铝中,电离最外层一个电子所需能量最大的是
A.
 B.
B.  C.
C.  D.
D. 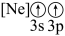
(3)配合物K[Cr(C2O4)(H2O)]中的配体是
(4)在翡翠等硅酸盐中,
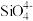 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
(5)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是

您最近一年使用:0次
名校
解题方法
2 . 下列有关物质结构的说法正确的是
| A.C-Cl键长顺序:一氯乙烷(C2H5Cl) <一氯乙烯(C2H3Cl) <一氯乙炔(C2HCl) |
| B.第四周期元素中,基态原子的未成对电子数与钛相同的有Ni、Ge、Se |
| C.三醋酸锰[(CH3COO)3Mn]中阳离子的价层电子排布式中电子的自旋状态不相同 |
| D.比较Fe和Mn的第三电离能,可得I3(Fe)大于I3(Mn) |
您最近一年使用:0次
名校
解题方法
3 . 四氟肼可发生反应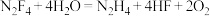 。下列有关叙述中正确的是
。下列有关叙述中正确的是
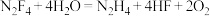 。下列有关叙述中正确的是
。下列有关叙述中正确的是A. 的电子式为 的电子式为 |
B.O的价电子排布式为 |
C. 在水溶液中的电离方程式: 在水溶液中的电离方程式: |
D. 中N的杂化轨道: 中N的杂化轨道: |
您最近一年使用:0次
2023-09-01更新
|
78次组卷
|
2卷引用:吉林省长春市朝阳区长春外国语学校2022-2023学年高三上学期11月期中考试化学试题
名校
4 . 利用细胞中的三种酶处理废水中含氮粒子的反应机理如图所示,下列有关说法错误的是


| A.氮原子间的共价键键长:N2H4>N2 |
B.NO 、N2H4、NH2OH中的N原子均采用sp3杂化 、N2H4、NH2OH中的N原子均采用sp3杂化 |
C.三种酶共同作用的总反应表示为:NO +H++NH3=N2+2H2O +H++NH3=N2+2H2O |
D.NH2OH在溶液中能体现弱碱性,其离子方程式为:NH2OH+H2O NH3OH++OH- NH3OH++OH- |
您最近一年使用:0次
5 . 硒(Se)是人体必需的微量元素之一,含硒化合物在材料和药物领域具有重要应用。一种含Se的新型AIE分子(IV)的合成路线如图:

下列说法错误的是

下列说法错误的是
A.N原子的基态电子轨道表示式为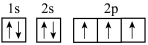 |
| B.I能发生取代反应和加成反应 |
| C.II中碳原子的杂化轨道类型为sp2杂化 |
| D.II中所有碳原子可能共平面 |
您最近一年使用:0次
名校
解题方法
6 . 元素及其化合物的性质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的。肼可用作火箭燃料,燃烧时发生的反应是 。若该反应中有4molN—H键断裂,则形成的π键有
。若该反应中有4molN—H键断裂,则形成的π键有_______ mol。
(2)氯化溴(BrCl)的化学性质类似于卤素单质,写出BrCl与水反应的化学方程式_______ 。
(3)请根据下表提供的第一电离能数据判断,还原性最强的卤素原子是_______ (写出名称)。
(4)已知下列5种羧酸,①CF3COOH②CH3COOH③CH2FCOOH④CH2ClCOOH其酸性由强到弱的顺序为_______ (填序号)。
(5)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是_______ (填“极性”或“非极性”)分子。
(6)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图)。
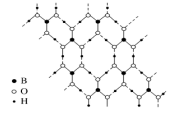
则1molH3BO3形成的晶体中有_______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+,其中B原子的杂化方式是_______ 。
(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的。肼可用作火箭燃料,燃烧时发生的反应是
 。若该反应中有4molN—H键断裂,则形成的π键有
。若该反应中有4molN—H键断裂,则形成的π键有(2)氯化溴(BrCl)的化学性质类似于卤素单质,写出BrCl与水反应的化学方程式
(3)请根据下表提供的第一电离能数据判断,还原性最强的卤素原子是
| 元素 | 氟 | 氯 | 溴 | 碘 |
| 第一电离能/(kJ·mol-1) | 1681 | 1251 | 1140 | 1008 |
(4)已知下列5种羧酸,①CF3COOH②CH3COOH③CH2FCOOH④CH2ClCOOH其酸性由强到弱的顺序为
(5)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是
(6)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图)。

则1molH3BO3形成的晶体中有
您最近一年使用:0次
解题方法
7 . 我国政府承诺要在2030年前实现碳达峰, 相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
(1) 催化加氢制取汽油时,
催化加氢制取汽油时, 的转化过程如图1:
的转化过程如图1:
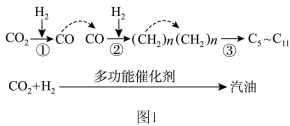
下列对该反应过程的说法正确的是_______ (填标号)。
A.整个反应过程中,有非极性键和极性键的断裂和形成
B. 中C原子的杂化类型为sp
中C原子的杂化类型为sp
C.汽油为纯净物
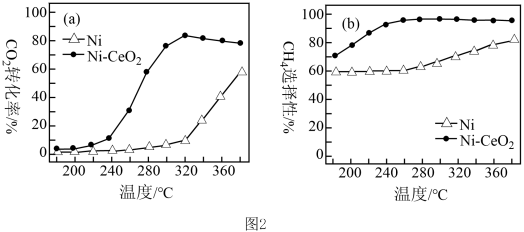
(2)已知 甲烷化技术的反应原理为
甲烷化技术的反应原理为
 ,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得
,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得 转化率和
转化率和 选择性随温度变化的曲线如图2所示。
选择性随温度变化的曲线如图2所示。
①四羰基镍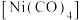 是镍的一种配合物,该配合物中中心原子的配位数为
是镍的一种配合物,该配合物中中心原子的配位数为_______ 。
②以Ni为催化剂,高于320℃后,单位时间内 转化率上升的原因是
转化率上升的原因是_______ ;工业上应选择的催化剂是_______ 。
(3)以 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
Ⅰ.
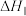
Ⅱ.
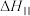
①反应

_______ 。(用含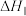 和
和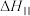 的代数式表示)
的代数式表示)
②反应Ⅰ、Ⅱ的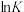 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中
(温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中 的含量将
的含量将_______ (填“增大”、“减小”或“不变”,下同),CO的含量将_______ 。
③某温度下往恒容密闭容器中充入1 mol 和3 mol
和3 mol  ,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的
,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的 ,该反应的压强平衡常数
,该反应的压强平衡常数
_______ (用平衡分压代替平衡浓度,分压=总压 物质的量分数)。
物质的量分数)。
 相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
相关转化的研究对解决环境、能源问题意义重大。回答下列问题:(1)
 催化加氢制取汽油时,
催化加氢制取汽油时, 的转化过程如图1:
的转化过程如图1:
下列对该反应过程的说法正确的是
A.整个反应过程中,有非极性键和极性键的断裂和形成
B.
 中C原子的杂化类型为sp
中C原子的杂化类型为spC.汽油为纯净物
(2)已知
 甲烷化技术的反应原理为
甲烷化技术的反应原理为
 ,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得
,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得 转化率和
转化率和 选择性随温度变化的曲线如图2所示。
选择性随温度变化的曲线如图2所示。
①四羰基镍
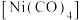 是镍的一种配合物,该配合物中中心原子的配位数为
是镍的一种配合物,该配合物中中心原子的配位数为②以Ni为催化剂,高于320℃后,单位时间内
 转化率上升的原因是
转化率上升的原因是(3)以
 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:Ⅰ.

Ⅱ.

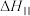
①反应


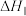 和
和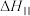 的代数式表示)
的代数式表示)②反应Ⅰ、Ⅱ的
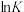 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中
(温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中 的含量将
的含量将
③某温度下往恒容密闭容器中充入1 mol
 和3 mol
和3 mol  ,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的
,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的 ,该反应的压强平衡常数
,该反应的压强平衡常数
 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
2023-01-02更新
|
366次组卷
|
3卷引用:吉林省部分学校2022-2023学年高三上学期12月联考化学试题
解题方法
8 . 碳元素的单质有多种形式,如图所示,依次是C60、石墨和金刚石的结构图:

回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为______ 。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为______ 、______ 。
(3)C60属于_____ 晶体,石墨属于______ 晶体。
(4)根据CsCl的晶胞结构分析,CsCl晶体中两距离最近的Cs+间距离为a,则每个Cs+周围与其距离为a的Cs+数目为______ ;每个Cs+周围距离相等且次近的Cs+数目为______ ,距离为______ ;每个Cs+周围距离相等且第三近的Cs+数目为______ ,距离为______ ;每个Cs+周围紧邻且等距的Cl—数目为______ 。


回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为
(3)C60属于
(4)根据CsCl的晶胞结构分析,CsCl晶体中两距离最近的Cs+间距离为a,则每个Cs+周围与其距离为a的Cs+数目为

您最近一年使用:0次
名校
解题方法
9 . 以Cu2O、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
(1)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是_______ 。
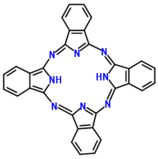
(2)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。邻苯二甲酸酐( )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(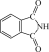 )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是_______ 。
(3)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为_______ 。
(4)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是_______ 。
(5)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面_______ 、_______ 。

(1)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是
(2)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是
(3)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为
(4)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是
(5)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。
 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
您最近一年使用:0次
名校
10 . 金刚石、石墨、C60和石墨烯的结构示意图分别如图所示,下列说法不正确的是
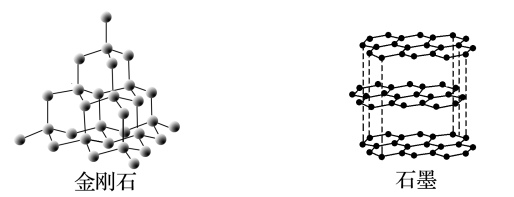
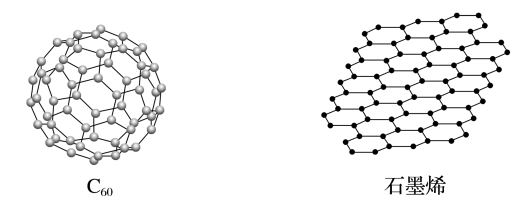
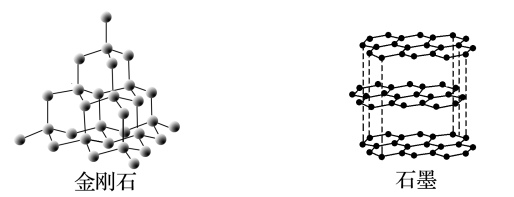

| A.金刚石和石墨烯中碳原子的杂化方式不同 |
| B.金刚石、石墨、C60和石墨烯的关系:互为同素异形体 |
| C.这四种物质完全燃烧后的产物都是CO2 |
| D.石墨与C60的晶体类型相同 |
您最近一年使用:0次
2022-08-20更新
|
131次组卷
|
2卷引用:吉林省长春外国语学校2021-2022学年高二下学期阶段测试化学试题



