名校
解题方法
1 . 翡翠的主要成分为NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅,是决定翡翠品质的重要因素之一。
(1)基态Cr3+最外电子层的电子排布图(轨道表示式)为___________ 。
(2)下列状态的铝中,电离最外层一个电子所需能量最大的是___________ ,最小的是___________ (填标号)。
A. B.
B.  C.
C.  D.
D. 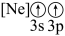
(3)配合物K[Cr(C2O4)(H2O)]中的配体是___________ ,H2O的沸点比CO2的高了许多,主要原因是___________ 。
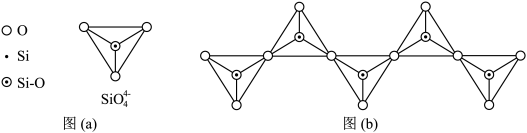
(4)在翡翠等硅酸盐中, 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为___________ ,其化学式为___________ 。低温石英中也存在有顶角相连的硅氧四面体形成螺旋上升的长链,没有封闭的环状结构,这一结构决定了它具有___________ 。
(5)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是___________ 原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为___________ % (列出计算表达式)。

(1)基态Cr3+最外电子层的电子排布图(轨道表示式)为
(2)下列状态的铝中,电离最外层一个电子所需能量最大的是
A.
 B.
B.  C.
C.  D.
D. 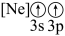
(3)配合物K[Cr(C2O4)(H2O)]中的配体是
(4)在翡翠等硅酸盐中,
 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
(5)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是

您最近一年使用:0次
名校
解题方法
2 . 下列有关物质结构的说法正确的是
| A.C-Cl键长顺序:一氯乙烷(C2H5Cl) <一氯乙烯(C2H3Cl) <一氯乙炔(C2HCl) |
| B.第四周期元素中,基态原子的未成对电子数与钛相同的有Ni、Ge、Se |
| C.三醋酸锰[(CH3COO)3Mn]中阳离子的价层电子排布式中电子的自旋状态不相同 |
| D.比较Fe和Mn的第三电离能,可得I3(Fe)大于I3(Mn) |
您最近一年使用:0次
名校
解题方法
3 . 四氟肼可发生反应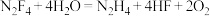 。下列有关叙述中正确的是
。下列有关叙述中正确的是
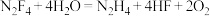 。下列有关叙述中正确的是
。下列有关叙述中正确的是A. 的电子式为 的电子式为 |
B.O的价电子排布式为 |
C. 在水溶液中的电离方程式: 在水溶液中的电离方程式: |
D. 中N的杂化轨道: 中N的杂化轨道: |
您最近一年使用:0次
2023-09-01更新
|
78次组卷
|
2卷引用:吉林省长春市朝阳区长春外国语学校2022-2023学年高三上学期11月期中考试化学试题
4 . 硒(Se)是人体必需的微量元素之一,含硒化合物在材料和药物领域具有重要应用。一种含Se的新型AIE分子(IV)的合成路线如图:

下列说法错误的是

下列说法错误的是
A.N原子的基态电子轨道表示式为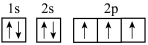 |
| B.I能发生取代反应和加成反应 |
| C.II中碳原子的杂化轨道类型为sp2杂化 |
| D.II中所有碳原子可能共平面 |
您最近一年使用:0次
解题方法
5 . 2022年9月9日,国家航天局、国家原子能机构联合在北京发布“嫦娥五号”最新科学成果:中国科学家首次在月球上发现新矿物,并命名为“嫦娥石”。“嫦娥石”是一种新的磷酸盐矿物,属于陨磷钠镁钙石(Merrillite)族,颗粒约2~30微米,伴生矿物有钛铁矿等。回答下列问题:
(1)基态钛原子价电子排布式为_______ 。
(2)Fe的配合物有多种。 、
、 、
、 的配体中所含原子C、N、O、F电负性由大到小的顺序是
的配体中所含原子C、N、O、F电负性由大到小的顺序是_______ (写元素符号,下同);第一电离能由大到小的顺序为_______ 。
(3)磷酸为磷的最高价含氧酸,其空间结构如图:
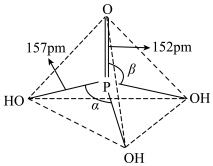
①纯净的磷酸黏度极大,随温度升高黏度迅速下降,原因是_______ 。
② 的立体构型为
的立体构型为_______ ,中心原子的杂化类型是_______ 。
(4)反型钙钛矿电池无须使用具有光催化活性的 (通过氮掺杂生成
(通过氮掺杂生成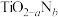 ,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
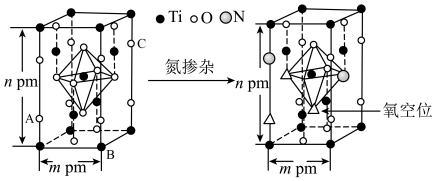
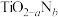 晶体中
晶体中
_______ ;已知原子A、B的分数坐标分别为 和
和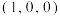 ,则原子C的坐标为
,则原子C的坐标为_______ ,设阿伏加德罗常数的值为 ,
, 的密度为
的密度为_______ g·cm 。
。
(1)基态钛原子价电子排布式为
(2)Fe的配合物有多种。
 、
、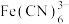 、
、 的配体中所含原子C、N、O、F电负性由大到小的顺序是
的配体中所含原子C、N、O、F电负性由大到小的顺序是(3)磷酸为磷的最高价含氧酸,其空间结构如图:

①纯净的磷酸黏度极大,随温度升高黏度迅速下降,原因是
②
 的立体构型为
的立体构型为(4)反型钙钛矿电池无须使用具有光催化活性的
 (通过氮掺杂生成
(通过氮掺杂生成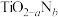 ,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
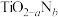 晶体中
晶体中
 和
和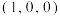 ,则原子C的坐标为
,则原子C的坐标为 ,
, 的密度为
的密度为 。
。
您最近一年使用:0次
2023-01-02更新
|
391次组卷
|
3卷引用:吉林省部分学校2022-2023学年高三上学期12月联考化学试题
解题方法
6 . 我国政府承诺要在2030年前实现碳达峰, 相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
(1) 催化加氢制取汽油时,
催化加氢制取汽油时, 的转化过程如图1:
的转化过程如图1:
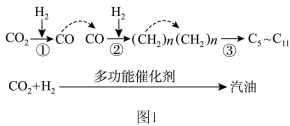
下列对该反应过程的说法正确的是_______ (填标号)。
A.整个反应过程中,有非极性键和极性键的断裂和形成
B. 中C原子的杂化类型为sp
中C原子的杂化类型为sp
C.汽油为纯净物
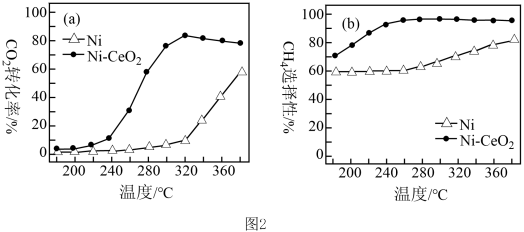
(2)已知 甲烷化技术的反应原理为
甲烷化技术的反应原理为
 ,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得
,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得 转化率和
转化率和 选择性随温度变化的曲线如图2所示。
选择性随温度变化的曲线如图2所示。
①四羰基镍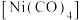 是镍的一种配合物,该配合物中中心原子的配位数为
是镍的一种配合物,该配合物中中心原子的配位数为_______ 。
②以Ni为催化剂,高于320℃后,单位时间内 转化率上升的原因是
转化率上升的原因是_______ ;工业上应选择的催化剂是_______ 。
(3)以 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
Ⅰ.

Ⅱ.

①反应

_______ 。(用含 和
和 的代数式表示)
的代数式表示)
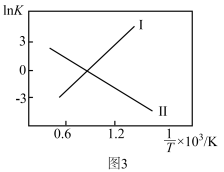
②反应Ⅰ、Ⅱ的 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中
(温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中 的含量将
的含量将_______ (填“增大”、“减小”或“不变”,下同),CO的含量将_______ 。
③某温度下往恒容密闭容器中充入1 mol 和3 mol
和3 mol  ,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的
,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的 ,该反应的压强平衡常数
,该反应的压强平衡常数
_______ (用平衡分压代替平衡浓度,分压=总压 物质的量分数)。
物质的量分数)。
 相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
相关转化的研究对解决环境、能源问题意义重大。回答下列问题:(1)
 催化加氢制取汽油时,
催化加氢制取汽油时, 的转化过程如图1:
的转化过程如图1:
下列对该反应过程的说法正确的是
A.整个反应过程中,有非极性键和极性键的断裂和形成
B.
 中C原子的杂化类型为sp
中C原子的杂化类型为spC.汽油为纯净物
(2)已知
 甲烷化技术的反应原理为
甲烷化技术的反应原理为
 ,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得
,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得 转化率和
转化率和 选择性随温度变化的曲线如图2所示。
选择性随温度变化的曲线如图2所示。
①四羰基镍
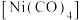 是镍的一种配合物,该配合物中中心原子的配位数为
是镍的一种配合物,该配合物中中心原子的配位数为②以Ni为催化剂,高于320℃后,单位时间内
 转化率上升的原因是
转化率上升的原因是(3)以
 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:Ⅰ.


Ⅱ.


①反应


 和
和 的代数式表示)
的代数式表示)②反应Ⅰ、Ⅱ的
 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中
(温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中 的含量将
的含量将
③某温度下往恒容密闭容器中充入1 mol
 和3 mol
和3 mol  ,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的
,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的 ,该反应的压强平衡常数
,该反应的压强平衡常数
 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
2023-01-02更新
|
366次组卷
|
3卷引用:吉林省部分学校2022-2023学年高三上学期12月联考化学试题
名校
7 . 茉莉醛具有优雅的茉莉花香味,是一种广泛应用于化妆品、洗涤剂和空气清新剂的合成香料。
制备茉莉醛的一种反应原理、发生装置、工艺流程和有关数据如下:
I.反应原理:
II.发生装置:

III.工艺流程:

IV.关数据:
V.色谱分离图

回答下列问题:
(1)仪器b的名称是______ ;a与普通分液漏斗相比,其优点是______ 。
(2)“搅拌”中加入乙醇的作用是______ ;“加热”中需保持温度为60~65℃,应采取的加热方法是______ ;“操作I”的名称是______ 。
(3)柱色谱分离法是利用吸附剂对物质吸附能力的不同,进行物质分离提纯的一种方法。吸附剂一般难溶于水、表面积比较大,可选用下列物质中______ 作吸附剂。(填正确选项)
a.氯化钠 B.活性炭
(4)茉莉醛分子中碳原子的杂化方式为______ 。
(5)根据题中所给数据,所得茉莉醛产率约为______ %(保留三位有效数字)。
制备茉莉醛的一种反应原理、发生装置、工艺流程和有关数据如下:
I.反应原理:

II.发生装置:

III.工艺流程:

IV.关数据:
相对分子质量 | 密度/ | 沸点/℃ | |
苯甲醛 | 106 | 1.04 | 179 |
庚醛 | 114 | 0.85 | 153 |
茉莉醛 | 202 | 0.97 | 287 |

回答下列问题:
(1)仪器b的名称是
(2)“搅拌”中加入乙醇的作用是
(3)柱色谱分离法是利用吸附剂对物质吸附能力的不同,进行物质分离提纯的一种方法。吸附剂一般难溶于水、表面积比较大,可选用下列物质中
a.氯化钠 B.活性炭
(4)茉莉醛分子中碳原子的杂化方式为
(5)根据题中所给数据,所得茉莉醛产率约为
您最近一年使用:0次
名校
解题方法
8 . 以Cu2O、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
(1)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是_______ 。
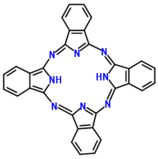
(2)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。邻苯二甲酸酐( )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(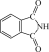 )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是_______ 。
(3)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为_______ 。
(4)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是_______ 。
(5)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面_______ 、_______ 。

(1)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是
(2)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是
(3)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为
(4)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是
(5)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。
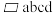 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
您最近一年使用:0次
9 . 镍钴锰酸锂是锂电池的关键三元正极材料,化学式为LiNixCoyMn1-x-yO2。其中的锰(Mn)、钴(Co)、镍(Ni)等过渡金属元素化合物的应用研究是前沿科学之一、回答下列问题:
(1)基态Ni原子的价电子排布式为___________ 。金属锰可导电、导热,有金属光泽和延展性,这些性质都可以用“___________ 理论”解释。
(2)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2。DMSO中硫原子的杂化轨道类型为___________ ,ClO 的空间构型是
的空间构型是___________ , SO(CH3)2中键角∠C—S—O___________ CH3COCH3中键角∠C—C—O(填“>”、“<”或“=”),元素S、Cl、O的电负性由小到大的顺序为___________ 。
(3)已知:r(Fe2+)为61pm、r(Co2+)为65pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是___________ 。
(4)La、Ni合金是较为理想的储氢材料,其晶胞结构如图所示:

①该储氢材料的化学式为___________ 。
②已知晶胞参数边长为anm,高为bnm,设阿伏加德罗常数的值为NA,一个晶胞内可以储存18个氢原子,储氢后的晶胞密度为___________ g·cm-3。
(1)基态Ni原子的价电子排布式为
(2)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2。DMSO中硫原子的杂化轨道类型为
 的空间构型是
的空间构型是(3)已知:r(Fe2+)为61pm、r(Co2+)为65pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是
(4)La、Ni合金是较为理想的储氢材料,其晶胞结构如图所示:

①该储氢材料的化学式为
②已知晶胞参数边长为anm,高为bnm,设阿伏加德罗常数的值为NA,一个晶胞内可以储存18个氢原子,储氢后的晶胞密度为
您最近一年使用:0次
名校
10 . 半导体材料是半导体⼯业的基础,由第ⅢA和第ⅤA元素所形成的化合物在半导体材料领域有⼴泛的应⽤。如砷化镓(GaAs)、砷化硼(BAs)、砷化铝(AlAs),氮化镓(GaN)等。请根据第ⅢA和第ⅤA元素核外电⼦排布的特点和形成化学键的多样性等特点回答下列问题:
(1)基态As原⼦的电⼦排布式为[Ar]___________ 。Ga、As和Se的第⼀电离能由小到大的顺序是:___________ 。
(2)实验发现,氯化铝的蒸⽓或溶于⾮极性溶剂中或处于熔融状态时,都以二聚态(Al2Cl6)形式存在。其球棍模型如图所示。

①该分子中Al原⼦采取___________ 杂化。
②Al2Cl6与过量NaOH溶液反应⽣成 ,
, -中存在的化学作⽤⼒类型有
-中存在的化学作⽤⼒类型有___________ (填标号)。
A.离⼦键 B.极性共价键 C.⾦属键 D.非极性共价键 E.配位键 F. 键 G.氢键
键 G.氢键
(3)N、B可以分别形成化合物NF3和BF3,试判断两种分⼦中键角的大小:NF3___________ BF3(填“>”、“<”、“=”)。
(4)⾃然界中不存在单质硼,硼的氢化物也很少,主要以含氧化合物形式存在,根据下表数据分析原因是___________ 。
(5)GaN是第三代半导体材料的研究热点,在⼲燥的NH3⽓流中焙烧磨细的GaAs可制得GaN。GaN、GaP、GaAs晶体类型与SiC相似,熔点如下表所示,其熔点差异的原因是___________ 。
(6)砷化硼的晶胞结构如图(a)所示,图(b)中矩形A´C´CA是沿晶胞对⻆⾯取得的截图。

①若晶胞的边长均为apm,阿伏加德罗常数的值为NA,晶体的密度为___________ g·cm-3(列出计算表达式)。
②晶胞中各原⼦在矩形A´C´CA的位置为___________ (填标号)。
A. B.
B.
C. D.
D.
(1)基态As原⼦的电⼦排布式为[Ar]
(2)实验发现,氯化铝的蒸⽓或溶于⾮极性溶剂中或处于熔融状态时,都以二聚态(Al2Cl6)形式存在。其球棍模型如图所示。

①该分子中Al原⼦采取
②Al2Cl6与过量NaOH溶液反应⽣成
 ,
, -中存在的化学作⽤⼒类型有
-中存在的化学作⽤⼒类型有A.离⼦键 B.极性共价键 C.⾦属键 D.非极性共价键 E.配位键 F.
 键 G.氢键
键 G.氢键(3)N、B可以分别形成化合物NF3和BF3,试判断两种分⼦中键角的大小:NF3
(4)⾃然界中不存在单质硼,硼的氢化物也很少,主要以含氧化合物形式存在,根据下表数据分析原因是
| 化学键 | B—H | B—O | B—B |
| 键能(kJ/mol) | 389 | 561 | 293 |
| 物质 | GaN | GaP | GaAs |
| 熔点/℃ | 1700 | 1480 | 1238 |

①若晶胞的边长均为apm,阿伏加德罗常数的值为NA,晶体的密度为
②晶胞中各原⼦在矩形A´C´CA的位置为
A.
 B.
B.
C.
 D.
D.
您最近一年使用:0次
2022-06-03更新
|
665次组卷
|
3卷引用:东北师范大学附属中学2022届高三考前模拟预测化学试题
东北师范大学附属中学2022届高三考前模拟预测化学试题(已下线)专题17 物质结构与性质综合题-备战2023年高考化学母题题源解密(全国通用)黑龙江省佳木斯市第十二中学2022-2023学年高三上学期期中考试化学试题




