1 . 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是
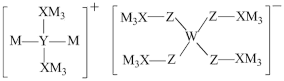
A.氢化物沸点: | B.原子半径: |
C.第一电离能: | D.阴、阳离子中均有配位键 |
您最近一年使用:0次
2021-09-13更新
|
12013次组卷
|
34卷引用:重庆市万州第二高级中学2021-2022学年高二下学期期末考试化学试题
重庆市万州第二高级中学2021-2022学年高二下学期期末考试化学试题2021年新高考辽宁化学高考真题湖北省华中师范大学第一附属中学2021-2022学年高二上学期期中检测化学试题2021年辽宁高考化学试题变式题11-19辽宁省朝阳市建平县实验中学2021-2022学年高二下学期第一次月考化学试题福建省厦门集美中学2021-2022学年高二下学期第一次月考化学试题浙江省宁波市六校2021-2022学年高二下学期期中联考化学试题(已下线)查补易混易错点06 物质结构 元素周期律-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷06题 元素周期表元素周期律-备战2022年高考化学临考题号押题(新高考通版)天津市第一中学2022届高三下学期5月月考化学试题(已下线)专题06 物质结构元素周期律-三年(2020-2022)高考真题分项汇编福建省福州第一中学2021-2022学年高二下学期期中考试化学试题(已下线)专题讲座(五) “位-构-性”综合推断题的解题方法(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第29讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)山东省菏泽市单县第二中学2021-2022学年高二下学期慧光班段考化学试题(已下线)题型78 基于物质结构考查元素周期律北京市平谷区2022-2023学年高三下学期质量监控(零模)化学试题山西省太原市第五中学2022-2023学年高二下学期3月月考化学试题(已下线)专题07 元素周期表与元素周期律河南省郑州市六校联盟2022-2023学年高二下学期4月期中考试化学试题黑龙江省富锦市第一中学2022-2023学年高二下学期第二次考试化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二下学期期中考试化学试题(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖北武汉市硚口区2023-2024学年高三起点质量检测化学试题吉林省长春市新解放学校2022-2023学年高二下学期4月月考化学试题辽宁省六校协作体2023-2024学年高三上学期11月期中考试化学试题(已下线)题型01 元素位-构-性推断-2024年高考化学答题技巧与模板构建天津市第四中学2023-2024学年高三上学期第二次月考化学试卷湖南省永州市第一中学2023-2024学年高二下学期开学考试化学试题(已下线)选择题6-10福建省泉州市泉港区第一中学2023-2024学年高二下学期3月月考化学试题(已下线)选择题6-10
名校
解题方法
2 . 材料是人类文明进步的阶梯,第ⅢA族、ⅣA族、VA族及Ⅷ族元素是组成特殊材料的重要元素。回答下列问题:
(1)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则其基态原子的核外电子数为___________ 。
(2)经测定发现,N2O5固体由NO 和NO
和NO 两种离子组成,该固体中N原子杂化类型有
两种离子组成,该固体中N原子杂化类型有___________ 。
(3)K4[Fe(CN)6]溶液可以检验铁陨石中铁元素的价态。1mol K4[Fe(CN)6]含σ键的物质的量为___________ ,化合物K4[Fe(CN)6]中存在的作用力有___________ (填字母)。
a.离子键 b.极性键 c.非极性键 d.配位键 e.氢键
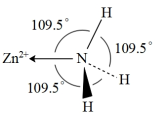
(4)NH3分子在独立存在时H−N−H键角为107°。如图是[Zn(NH3)6]2+离子的部分结构以及H−N−H键角的测量值。解释NH3形成如图配合物后H−N−H键角变大的原因:___________ 。
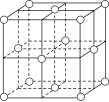
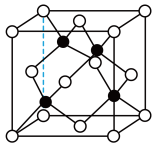
(5)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中位置如图所示,其堆积方式为___________ (填“简单立方”、“体心立方”、“六方最密”或“面心立方最密”)Li+占据阴离子组成的所有正四面体中心,该化合物的化学式为___________ (用最简整数比表示)。假设晶胞边长为anm,NA代表阿伏加德罗常数的值,则该晶胞的密度为___________ g/cm3。
(1)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则其基态原子的核外电子数为
(2)经测定发现,N2O5固体由NO
 和NO
和NO 两种离子组成,该固体中N原子杂化类型有
两种离子组成,该固体中N原子杂化类型有(3)K4[Fe(CN)6]溶液可以检验铁陨石中铁元素的价态。1mol K4[Fe(CN)6]含σ键的物质的量为
a.离子键 b.极性键 c.非极性键 d.配位键 e.氢键
(4)NH3分子在独立存在时H−N−H键角为107°。如图是[Zn(NH3)6]2+离子的部分结构以及H−N−H键角的测量值。解释NH3形成如图配合物后H−N−H键角变大的原因:

(5)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中位置如图所示,其堆积方式为

您最近一年使用:0次
2021-07-24更新
|
339次组卷
|
2卷引用:重庆育才中学高2021届高亖下学期二诊模拟考试化学试题
名校
解题方法
3 . B和Ni均为新材料的主角。回答下列问题:
(1)基态B原子的核外电子有___________ 种空间运动状态;基态Ni原子核外占据最高能层电子的电子云轮廓图的形状为___________ 。
(2)硼的卤化物的沸点如表所示:
解释表中卤化物之间沸点差异的原因___________ 。
(3)镍及其化合物常用作有机合成的催化剂,如Ni(PPh3)2,其中Ph表示苯基,PPh3表示分子,PPh3的空间构型为___________ ;Ni(PPh3)2晶体中存在的化学键类型有___________ (填字母)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(4)鉴定Ni2+的特征反应如下:
Ni2++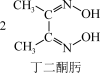

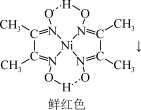 +2H+
+2H+
在1mol鲜红色沉淀中,含有sp2杂化原子的数目为___________ 个(阿伏加德罗常数的值为NA)。丁二酮肟中,各元素电负性由大到小的顺序为___________ (用元素符号表示)。
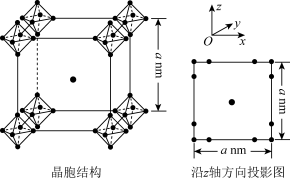
(5)硼化钙可用于新型半导体材料,一种硼化钙的晶胞结构及沿z轴方向的投影图如图所示,硼原子形成的正八面体占据顶角位置。若阿伏加德罗常数的值为NA,晶体密度ρ=___________ g·cm-3。
(1)基态B原子的核外电子有
(2)硼的卤化物的沸点如表所示:
| 卤化物 | BF3 | BCl3 | BBr3 |
| 沸点/℃ | -100.3 | 12.5 | 90 |
解释表中卤化物之间沸点差异的原因
(3)镍及其化合物常用作有机合成的催化剂,如Ni(PPh3)2,其中Ph表示苯基,PPh3表示分子,PPh3的空间构型为
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(4)鉴定Ni2+的特征反应如下:
Ni2++


 +2H+
+2H+在1mol鲜红色沉淀中,含有sp2杂化原子的数目为
(5)硼化钙可用于新型半导体材料,一种硼化钙的晶胞结构及沿z轴方向的投影图如图所示,硼原子形成的正八面体占据顶角位置。若阿伏加德罗常数的值为NA,晶体密度ρ=

您最近一年使用:0次
2021-07-23更新
|
456次组卷
|
3卷引用:重庆育才中学高2021届高三下学期三诊模拟考试化学试题
解题方法
4 . LiAlH4是有机合成中常用的还原剂,可在乙醚中制得:4LiH+AlCl3=LiAlH4+3LiCl。下列说法错误的是
| A.Li+半径大于H-半径 |
| B.[AlH4]-空间构型是正四面体 |
| C.LiAlH4中存在离子键、σ键、配位键 |
| D.Al2Cl6为AlCl3的双聚分子,氯原子提供给铝原子孤对电子 |
您最近一年使用:0次
2021-05-19更新
|
164次组卷
|
2卷引用:重庆市缙云联盟2021-2022学年高一10月质量检测化学试题
名校
5 . 一水合甘氨酸锌是一种矿物类饲料添加剂,其结构简式如图所示。下列说法错误的是
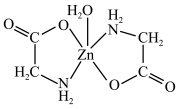
A.第一电离能: |
B.基态Zn原子的价电子排布式为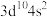 |
C.该物质中, 的配位数为5,配原子为O、N 的配位数为5,配原子为O、N |
D.电负性由小到大的顺序为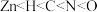 |
您最近一年使用:0次
2021-05-06更新
|
814次组卷
|
12卷引用:选择题6-10
(已下线)选择题6-10湖北部分重点学校联考2021届高三2月新高考质量检测化学试题湖北省罗田县第一中学2020-2021学年高二下学期第一次月考化学试题(已下线)本册综合检测(B)-2020-2021学年高二化学同步单元AB卷(鲁科版2019选择性必修2)新疆乌鲁木齐市第八中学2020-2021学年高二下学期第一阶段考试化学试题(已下线)押山东卷第04题 物质结构与性质选择题-备战2021年高考化学临考题号押题(山东卷)山西省太原市2020-2021学年高二下学期期中质量监测理科化学试题(已下线)押新高考卷08题 物质结构与性质-备战2022年高考化学临考题号押题(新高考通版)专题4 分子空间结构与物质性质 第二单元 配合物的形成和应用 第2课时 配合物的应用福建省南平市高级中学2022-2023学年高二下学期期中考试化学试题4.2.1配合物的形成和应用 课后河南省百师联盟2023-2024学年高二下学期五月大联考化学试卷
名校
6 . 某物质的实验式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是
| A.配合物中中心原子的电荷数和配位数均为6 |
| B.该配合物可能是平面正方形结构 |
| C.Cl-和NH3分子均与Pt4+形成配位键 |
| D.该配合物的配体为NH3 |
您最近一年使用:0次
2021-02-06更新
|
1678次组卷
|
9卷引用:重庆市实验中学校2021-2022学年高二下学期第一次月考化学试题
重庆市实验中学校2021-2022学年高二下学期第一次月考化学试题2016-2017学年福建省厦门一中高二上期中化学卷福建省三明市第一中学2016-2017学年高二下学期半期考试化学试题吉林省乾安县第七中学2018-2019学年高二下学期第一次质量检测化学试题高二选择性必修2(人教版2019)全书综合训练(已下线)2.2 分子的空间结构(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)黑龙江省大庆市大庆中学2021-2022学年高二下学期期中考试化学试题吉林省通化市部分重点中学校2021-2022学年高二下学期期末联考化学试题广东省惠州市龙门县高级中学2021-2022学年高二下学期期中考试化学试题
名校
7 . 由B、N、O、Fe等元素组成的新型材料有着广泛用途。
(1)基态Fe2+离子的核外电子有_______ 种空间运动状态。
(2)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过反应: 3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。
①与上述化学方程式有关的叙述不正确的是_________ 。(填标号)
A H3BNH3与(HB=NH)3分子中B原子的杂化类型相同
B CH4、H2O、CO2分子空间构型分别是:正四面体形、角形、直线形
C 第一电离能:N>O>C>B
D 化合物A中存在配位键
②1个(HB=NH)3分子中有_______ 个σ键。
(3)立方氮化硼(BN)是具有广泛应用的新型无机非金属材料,结构和硬度都与金刚石相似。
①立方氮化硼熔点比金刚石低,原因是______________ 。
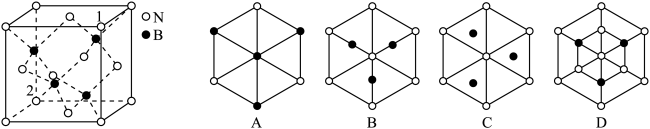
②立方氮化硼晶胞如下图所示,则立方氮化硼晶胞沿着1→2方向的体对角线垂直在纸平面上的投影图应该是图_____ (从A~D图中选填)。
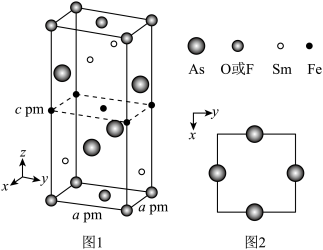
(4)一种O(或F)、Fe、As、Sm形成的四方结构超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为____ 。通过测定密度ρ(g/cm3)和晶胞参数,可以计算该物质的x值,完成它们关系的表达式:x=_____ 。
(1)基态Fe2+离子的核外电子有
(2)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过反应: 3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。
①与上述化学方程式有关的叙述不正确的是
A H3BNH3与(HB=NH)3分子中B原子的杂化类型相同
B CH4、H2O、CO2分子空间构型分别是:正四面体形、角形、直线形
C 第一电离能:N>O>C>B
D 化合物A中存在配位键
②1个(HB=NH)3分子中有
(3)立方氮化硼(BN)是具有广泛应用的新型无机非金属材料,结构和硬度都与金刚石相似。
①立方氮化硼熔点比金刚石低,原因是
②立方氮化硼晶胞如下图所示,则立方氮化硼晶胞沿着1→2方向的体对角线垂直在纸平面上的投影图应该是图

(4)一种O(或F)、Fe、As、Sm形成的四方结构超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为

您最近一年使用:0次
解题方法
8 . 铜及其化合物在生活和生产中有着广泛的应用。回答下列问题
(1)基态铜原子价层电子的轨道表达式(电子排布图)为_____ 。
(2)单质铜及镍都是由_____ 键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1958kJ/mol,INi=1753kJ/mol,ICu>INi的原因是_____ 。
(3)Cu2+能与多种物质形成配合物。
①CuSO4溶液与氨水在一定条件下可以生成[Cu(NH3)4]SO4•H2O晶体,该晶体中杂化轨道类型为sp3的原子为_____ ,写出与SO 互为等电子体的一种分子是
互为等电子体的一种分子是_____ 。
②CuSO4溶液与过量KCN可以形成配合物离子[Cu(CN)4]2﹣,1mol该微粒中含有的σ键和π键的数目之比为_____ 。
③CuCl2溶液与乙二胺(H2N﹣CH2﹣CH2﹣NH2)可形成配离子: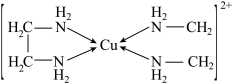 则H、O、N三种元素的电负性从大到小的顺序为
则H、O、N三种元素的电负性从大到小的顺序为_____ ,乙二胺沸点高于1,2﹣二氯乙烷(Cl﹣CH2﹣CH2﹣Cl)的主要原因是_____ 。
(4)已知铜与氯形成化合物的立方晶胞如图所示(黑点代表铜原子)。
①该晶体的化学式为_____ 。
②已知铜与氯的电负性分别为1.9和3.0,则铜与氯组成的化合物属于_____ (填“共价”或“离子”)化合物。
③已知该晶体的密度为ρg•cm﹣3,阿伏加 德罗常数为NA,该晶体中铜原子和氯原子之间的最短距离为体对角线的 ,则该晶体中铜原子和氯原子之间的最短距离为
,则该晶体中铜原子和氯原子之间的最短距离为_____ pm(写出计算列式)。
(1)基态铜原子价层电子的轨道表达式(电子排布图)为
(2)单质铜及镍都是由
(3)Cu2+能与多种物质形成配合物。
①CuSO4溶液与氨水在一定条件下可以生成[Cu(NH3)4]SO4•H2O晶体,该晶体中杂化轨道类型为sp3的原子为
 互为等电子体的一种分子是
互为等电子体的一种分子是②CuSO4溶液与过量KCN可以形成配合物离子[Cu(CN)4]2﹣,1mol该微粒中含有的σ键和π键的数目之比为
③CuCl2溶液与乙二胺(H2N﹣CH2﹣CH2﹣NH2)可形成配离子:
 则H、O、N三种元素的电负性从大到小的顺序为
则H、O、N三种元素的电负性从大到小的顺序为(4)已知铜与氯形成化合物的立方晶胞如图所示(黑点代表铜原子)。

①该晶体的化学式为
②已知铜与氯的电负性分别为1.9和3.0,则铜与氯组成的化合物属于
③已知该晶体的密度为ρg•cm﹣3,阿伏加 德罗常数为NA,该晶体中铜原子和氯原子之间的最短距离为体对角线的
 ,则该晶体中铜原子和氯原子之间的最短距离为
,则该晶体中铜原子和氯原子之间的最短距离为
您最近一年使用:0次
2020-08-18更新
|
334次组卷
|
2卷引用:重庆市缙云教育联盟2022-2023学年高三上学期第一次诊断性检测 化学试题
9 . 铁及其化合物在生产生活中有着广泛的应用。回答下列问题:
(1)基态Fe原子的外围电子排布图为____ ,基态Fe2+中,核外电子占据最高能层的符号是____ ,Fe2+和Fe3+是铁的两种常见离子,Fe3+的稳定性强于Fe2+,原因是____ 。
(2)Fe3+可以与SCN—形成一系列不同配位数的红色配合物,所以常用KSCN溶液检验Fe3+的存在,KSCN中四种元素的电负性由小到大的顺序为_______ ,SCN—的几何构型为______ ,中心原子的杂化类型为_______ 。
(3)实验中常用K3[Fe(CN)6]检验Fe2+, K3[Fe(CN)6]晶体中的化学键有_________ (填写选项字母)
a.离子键. b.共价键 c,氢键 d .配位键 e.金属键
1mol K3[Fe(CN)6]中含有σ键与π键的数目比为_____________ 。
(4)FexO为氯化钠型结构,在实际晶体中,由于存在缺陷,x<1。 测得Fe0.92O晶体的晶胞参数a=428.0pm,则该晶体的密度ρ=__________ g/cm3 (列出计算式),晶体中最近的两个铁离子间的距离为_______ pm。
(1)基态Fe原子的外围电子排布图为
(2)Fe3+可以与SCN—形成一系列不同配位数的红色配合物,所以常用KSCN溶液检验Fe3+的存在,KSCN中四种元素的电负性由小到大的顺序为
(3)实验中常用K3[Fe(CN)6]检验Fe2+, K3[Fe(CN)6]晶体中的化学键有
a.离子键. b.共价键 c,氢键 d .配位键 e.金属键
1mol K3[Fe(CN)6]中含有σ键与π键的数目比为
(4)FexO为氯化钠型结构,在实际晶体中,由于存在缺陷,x<1。 测得Fe0.92O晶体的晶胞参数a=428.0pm,则该晶体的密度ρ=
您最近一年使用:0次
2020-05-20更新
|
386次组卷
|
3卷引用:重庆市第八中学2020届高三高考模拟试卷化学试题(三)
名校
10 . 配合物Na3[Fe(CN)6]可用于离子检验,下列说法不正确的是( )
| A.此配合物中存在离子键、配位键、极性键、非极性键 |
| B.配离子为[Fe(CN)6]3−,中心离子为 Fe3+,配位数为 6,配位原子有 C |
| C.1mol 配合物中σ键数目为 12NA |
| D.该配合物为离子化合物,易电离,1mol 配合物电离得到阴阳离子共 4NA |
您最近一年使用:0次
2020-03-28更新
|
401次组卷
|
7卷引用:重庆市三峡名校联盟2021-2022学年高二下学期春季联考化学试题



