名校
1 . I.以下物质中:①HF ②Cl2 ③H2O ④N2 ⑤C2H4
(1)既有极性键又有非极性键的是_______ 。
(2)只含有σ键的是_______ 。
(3)属于极性分子的是_______ 。
(4)属于非极性分子的是_______ 。
II.COCl2分子的结构式为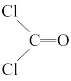
(5)COCl2分子内含有_______(填选项字母)。
III.超氧化钾的晶胞结构如图所示。

(6)则与K+等距离且最近的K+个数为_______ 。
(1)既有极性键又有非极性键的是
(2)只含有σ键的是
(3)属于极性分子的是
(4)属于非极性分子的是
II.COCl2分子的结构式为

(5)COCl2分子内含有_______(填选项字母)。
| A.4个σ键 | B.2个σ键、2个π键 |
| C.2个σ键、1个π键 | D.3个σ键、1个π键 |
III.超氧化钾的晶胞结构如图所示。

(6)则与K+等距离且最近的K+个数为
您最近一年使用:0次
名校
解题方法
2 . 有以下10种微粒:①CCl4 ②BeCl2 ③CH≡CH ④NH3 ⑤NH ⑥BF3 ⑦HCHO ⑧H2O ⑨H2O2 ⑩SiH4
⑥BF3 ⑦HCHO ⑧H2O ⑨H2O2 ⑩SiH4
(1)空间结构呈正四面体的是_______ (填序号,下同)
(2)中心原子采用sp2杂化方式的是_______ 。
(3)所有原子共平面的是_______ 。
(4)含有极性键的极性分子是_______ 。
 ⑥BF3 ⑦HCHO ⑧H2O ⑨H2O2 ⑩SiH4
⑥BF3 ⑦HCHO ⑧H2O ⑨H2O2 ⑩SiH4(1)空间结构呈正四面体的是
(2)中心原子采用sp2杂化方式的是
(3)所有原子共平面的是
(4)含有极性键的极性分子是
您最近一年使用:0次
名校
解题方法
3 . 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)元素Mn与O中,基态原子核外未成对电子数较多的是___________ 。
(2)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为___________ ,原因是___________ 。
(3)①H2O分子内O-H键、②分子间的范德华力、③氢键,从强到弱依次为___________ (用序号进行排序)。
(4)H2O2是一种无色液体,其结构如图所示。根据“相似相溶规则”,H2O2在水中的溶解度___________ (填“大于”、“小于”、“等于”)其在CCl4中的溶解度。

(5)基态Co原子的核外电子占据的最高能层符号为___________ , CO2分子中σ键与π键数目的比值为___________ 。
(1)元素Mn与O中,基态原子核外未成对电子数较多的是
(2)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
(3)①H2O分子内O-H键、②分子间的范德华力、③氢键,从强到弱依次为
(4)H2O2是一种无色液体,其结构如图所示。根据“相似相溶规则”,H2O2在水中的溶解度

(5)基态Co原子的核外电子占据的最高能层符号为
您最近一年使用:0次
2021-10-27更新
|
415次组卷
|
3卷引用:黑龙江省大庆市大庆中学2021-2022学年高二下学期期中考试化学试题
黑龙江省大庆市大庆中学2021-2022学年高二下学期期中考试化学试题广东省东莞市光明中学2021-2022学年高二上学期第一次月考化学试题(已下线)2.3.2 分子间作用力 分子的手性-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)
名校
4 . 如表列出了①~⑦七种元素在周期表中的位置。请按要求回答:
(1)七种元素中,原子半径最大的是(填元素符号)___________ 。
(2)③与⑦的简单氢化物中,稳定性较强的是(填化学式)___________ ,该物质的分子为___________ (填“极性”或“非极性”)分子。
(3)元素②形成的一种氢化物常用作火箭燃料,则该物质的电子式为___________ 。
(4)元素④的最高价氧化物对应的水化物与元素⑤的最高价氧化物对应的水化物发生反应的离子方程式为___________ 。
(5)由①、②、③三种元素组成的离子化合物是___________ ,检验该化合物中阳离子的方法是___________ 。
(6)下列事实能说明O的非金属性比S的非金属性强的是___________(填字母代号)。
(7)含有上述元素的物质间存在如图转化。
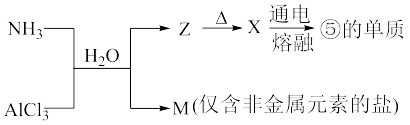
M所含的化学键类型是___________ ,实验室检验AlCl3是否为离子化合物的方法___________ 。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
(1)七种元素中,原子半径最大的是(填元素符号)
(2)③与⑦的简单氢化物中,稳定性较强的是(填化学式)
(3)元素②形成的一种氢化物常用作火箭燃料,则该物质的电子式为
(4)元素④的最高价氧化物对应的水化物与元素⑤的最高价氧化物对应的水化物发生反应的离子方程式为
(5)由①、②、③三种元素组成的离子化合物是
(6)下列事实能说明O的非金属性比S的非金属性强的是___________(填字母代号)。
| A.O2与H2S溶液反应,溶液变浑浊 |
| B.加热条件下H2S比H2O更容易分解 |
| C.在氧化还原反应中,1 mol O2比1 mol S得电子多 |
| D.H2O的沸点比H2S高 |
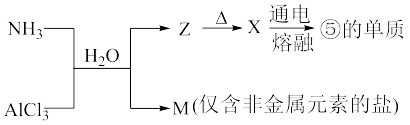
M所含的化学键类型是
您最近一年使用:0次
名校
解题方法
5 . 已知A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A的一种核素中子数是质子数的2倍;B含有3个能级,且每个能级所含的电子数相同;D原子基态核外电子运动状态共8种;E为VIII族元素,基态E原子中有4个未成对电子且全在同一能级;E、F原子序数相差3。
(1)写出阳离子E2+的核外电子排布式_______ 。
(2)B、C、D简单气态氢化物的稳定性由小到大的顺序是_______ 。(用化学式书写)
(3)由A、B、C、D构成的物质(ADBC)的结构式是_______ ,其中B原子的杂化方式是_______ ,根据等电子体原理,可推测BCD-离子的空间构型是_______ 。
(4)E元素与D元素形成的ED晶体与NaCl晶体晶胞结构相似,则ED晶体中E离子的配位数为___ 。
(5)B、C与A可以形成多种分子,有关说法不正确的是_______ 。
①B2A2分子中σ键与π键的个数比为3︰2
②CA3和BA4的VSEPR构型相同
③C2A4分子、CA3分子都可以做配体与某些金属离子形成配位键
④BA4是由非极性键构成的非极性分子
(6)F单质晶体中原子的堆积方式如图甲所示,其晶胞结构如图乙所示,原子之间相互位置关系的平面图如丙所示。
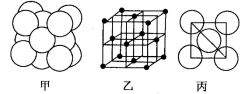
若F原子半径为acm,则F单质晶体的密度为_______ g·cm-3(只列出计算式,阿伏加德罗常数的值为NA)。
(1)写出阳离子E2+的核外电子排布式
(2)B、C、D简单气态氢化物的稳定性由小到大的顺序是
(3)由A、B、C、D构成的物质(ADBC)的结构式是
(4)E元素与D元素形成的ED晶体与NaCl晶体晶胞结构相似,则ED晶体中E离子的配位数为
(5)B、C与A可以形成多种分子,有关说法不正确的是
①B2A2分子中σ键与π键的个数比为3︰2
②CA3和BA4的VSEPR构型相同
③C2A4分子、CA3分子都可以做配体与某些金属离子形成配位键
④BA4是由非极性键构成的非极性分子
(6)F单质晶体中原子的堆积方式如图甲所示,其晶胞结构如图乙所示,原子之间相互位置关系的平面图如丙所示。

若F原子半径为acm,则F单质晶体的密度为
您最近一年使用:0次
2021-08-03更新
|
231次组卷
|
2卷引用:黑龙江省大庆市2020届高三第一次质量检测化学试题
6 . 铍及其化合物的应用正日益被重视。
(1)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为__________ 。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有______ (填字母)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)氯化铍在气态时存在BeCl2分子(a)和二聚分子(BeCl2)2(b),固态时则具有如下图所示的链状结构(c)。
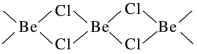
①a属于________ (填“极性”或“非极性”)分子。
②二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为__________ (标出配位键)。
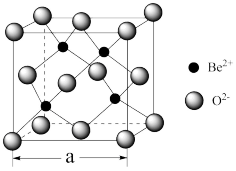
(4)BeO立方晶胞如下图所示,若BeO晶体的密度为d g·cm-3,则晶胞参数a=______ nm。
(1)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)氯化铍在气态时存在BeCl2分子(a)和二聚分子(BeCl2)2(b),固态时则具有如下图所示的链状结构(c)。

①a属于
②二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为
(4)BeO立方晶胞如下图所示,若BeO晶体的密度为d g·cm-3,则晶胞参数a=

您最近一年使用:0次
2020-07-02更新
|
209次组卷
|
3卷引用:黑龙江省牡丹江市第二高级中学2022-2023学年高二下学期4月月考化学试题
9-10高二下·黑龙江·期末
7 . 以下物质①HF②H2③H2O④N2⑤C2H4⑥H2O2⑦NaCl(填序号)
(1)只含有极性键的是____________________________________________ ;
(2)既含有极性键又含有非极性键的是______________________________ ;
(3)属于极性分子的是____________________________________________ ;
(4)既有σ键又有π键的是_______________________________________ ;
(5)含有s—sσ键的是____________________________________________ ;
(6)以上物质为固体时,属于离子晶体的是____________________________ 。
(1)只含有极性键的是
(2)既含有极性键又含有非极性键的是
(3)属于极性分子的是
(4)既有σ键又有π键的是
(5)含有s—sσ键的是
(6)以上物质为固体时,属于离子晶体的是
您最近一年使用:0次



