1 . 按要求回答下列问题:
(1)CH4是_______ 形分子,是_______ 分子(填“极性”“非极性”)。
(2)①基态原子的N层有1个未成对电子,M层未成对电子数最多的元素的价电子排布式为_______ 。
②最外层电子数是次外层电子数3倍的元素的轨道表示式为_______ 。
③Cu原子的结构示意图为_______ 。
(3)某元素+3价离子的电子排布式为1s22s22p63s23p63d3,该元素在周期表中的_______ 区。
(4)已知下列四种酸①CH3CBr2COOH②CH3CF2COOH③CH3CH2COOH④CH3COOH酸性由弱到强的顺序为_______ 。
(1)CH4是
(2)①基态原子的N层有1个未成对电子,M层未成对电子数最多的元素的价电子排布式为
②最外层电子数是次外层电子数3倍的元素的轨道表示式为
③Cu原子的结构示意图为
(3)某元素+3价离子的电子排布式为1s22s22p63s23p63d3,该元素在周期表中的
(4)已知下列四种酸①CH3CBr2COOH②CH3CF2COOH③CH3CH2COOH④CH3COOH酸性由弱到强的顺序为
您最近一年使用:0次
名校
解题方法
2 . 二氯化二硫 可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点
可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点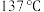 ,在潮湿的空气中剧烈水解而发烟,
,在潮湿的空气中剧烈水解而发烟, 可通过硫与少量氯气在
可通过硫与少量氯气在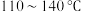 反应制得。
反应制得。
(1)有关 的下列说法正确的是___________。
的下列说法正确的是___________。
(2)选用以下装置制取少量 (夹持装置略):
(夹持装置略):
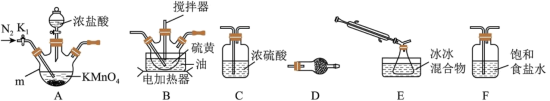
①A中反应的离子方程式为___________ 。
②装置连接顺序:A→___________ 。
③仪器D的名称为___________ ,D中的最佳试剂是___________ (选填序号)。
a.碱石灰 b. c.无水氯化钙
c.无水氯化钙
④实验前打开 ,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是
,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___________ 。
⑤为了提高 的纯度,实验的关键是控制好温度和
的纯度,实验的关键是控制好温度和___________ 。
(3) 遇水会生成
遇水会生成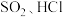 两种气体,某同学设计了如下实验方案来测定该混合气体中
两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。
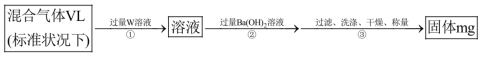
①W溶液可以是下列溶液中的___________ (填标号);
a. 溶液 b.酸性
溶液 b.酸性 溶液 c.氯水
溶液 c.氯水
②该混合气体中二氧化硫的体积分数为___________ (含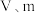 的代数式表示),若去掉①步骤,则所得结果
的代数式表示),若去掉①步骤,则所得结果___________ (填偏大、偏小或不变)。
 可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点
可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点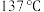 ,在潮湿的空气中剧烈水解而发烟,
,在潮湿的空气中剧烈水解而发烟, 可通过硫与少量氯气在
可通过硫与少量氯气在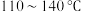 反应制得。
反应制得。(1)有关
 的下列说法正确的是___________。
的下列说法正确的是___________。A.固态时 属于共价晶体 属于共价晶体 |
B. 中 中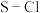 键的键能大于 键的键能大于 键的键能 键的键能 |
C.第一电离能、电负性均为: |
D. 是既有极性键又有非极性键的非极性分子 是既有极性键又有非极性键的非极性分子 |
 (夹持装置略):
(夹持装置略):
①A中反应的离子方程式为
②装置连接顺序:A→
③仪器D的名称为
a.碱石灰 b.
 c.无水氯化钙
c.无水氯化钙④实验前打开
 ,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是
,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是⑤为了提高
 的纯度,实验的关键是控制好温度和
的纯度,实验的关键是控制好温度和(3)
 遇水会生成
遇水会生成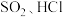 两种气体,某同学设计了如下实验方案来测定该混合气体中
两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。
①W溶液可以是下列溶液中的
a.
 溶液 b.酸性
溶液 b.酸性 溶液 c.氯水
溶液 c.氯水②该混合气体中二氧化硫的体积分数为
 的代数式表示),若去掉①步骤,则所得结果
的代数式表示),若去掉①步骤,则所得结果
您最近一年使用:0次
名校
3 . A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态; B、C的价电子层中未成对电子数都是2;B、C、D同周期; 核外的 s、p能级的电子总数相等; F与E同周期且第一电离能比E小; G的
核外的 s、p能级的电子总数相等; F与E同周期且第一电离能比E小; G的  价离子
价离子 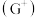 的各层电子全充满。回答下列问题:(相关问题用元素符号表示)
的各层电子全充满。回答下列问题:(相关问题用元素符号表示)
(1)写出 E的 L层电子排布式___________ 。
(2)B与 C可形成化合物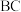 和
和 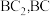 的结构式为
的结构式为___________ ; 属于
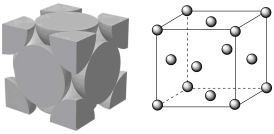
属于___________ (填“极性”或非极性”)分子, 晶胞如图所示,已知晶胞参数为
晶胞如图所示,已知晶胞参数为 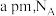 为阿伏加德罗常数,则
为阿伏加德罗常数,则  的密度
的密度  表达式为
表达式为___________  。
。
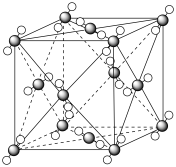
(3)由元素 A、C、G组成的离子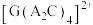 在水溶液中显天蓝色,该离子的空间构型为
在水溶液中显天蓝色,该离子的空间构型为_____ ,加入过量的氨水,溶液变为深蓝色,再加入少量乙醇,用玻璃棒摩擦容器内壁,析出深蓝色晶体。请比较两种配离子的稳定性,并解释原因:______ 。
(4)测定 A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的原因是_____ 。
(5)D离子与 离子不共存,生成一种含配位键的阴离子,该离子的化学式为
离子不共存,生成一种含配位键的阴离子,该离子的化学式为___________ 。
(6)G的晶胞结构如图,G的配位数为______ ,求算该晶体的空间利用率为_______ (用含  的代数式表示)。
的代数式表示)。
 核外的 s、p能级的电子总数相等; F与E同周期且第一电离能比E小; G的
核外的 s、p能级的电子总数相等; F与E同周期且第一电离能比E小; G的  价离子
价离子 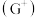 的各层电子全充满。回答下列问题:(相关问题用元素符号表示)
的各层电子全充满。回答下列问题:(相关问题用元素符号表示)(1)写出 E的 L层电子排布式
(2)B与 C可形成化合物
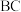 和
和 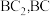 的结构式为
的结构式为 属于
属于 晶胞如图所示,已知晶胞参数为
晶胞如图所示,已知晶胞参数为 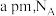 为阿伏加德罗常数,则
为阿伏加德罗常数,则  的密度
的密度  表达式为
表达式为 。
。
(3)由元素 A、C、G组成的离子
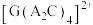 在水溶液中显天蓝色,该离子的空间构型为
在水溶液中显天蓝色,该离子的空间构型为(4)测定 A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的原因是
(5)D离子与
 离子不共存,生成一种含配位键的阴离子,该离子的化学式为
离子不共存,生成一种含配位键的阴离子,该离子的化学式为(6)G的晶胞结构如图,G的配位数为
 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
4 . 工业上制备纯碱的原理为:NaCl+CO2+NH3+H2O=NH4Cl+NaHCO3,请回答下列问题:
(1)上述反应体系中出现的几种短周期元素中,第二周期元素原子半径由大到小的顺序是___________ 。
(2)反应体系中出现的非金属元素,可形成多种化合物,其中和铵根离子空间构型相同,且属于有机物的电子式是___________ ,该分子为___________ (填“极性”或“非极性”)分子。
(3)化合物FeF3熔点高于1000℃而Fe(CO)5的熔点却低于0℃,FeF3熔点远高于Fe(CO)5的原因可能是___________ 。
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。
①FeO立方晶胞结构如图甲所示,则Fe2+的配位数为___________ ,与O2-紧邻的所有Fe2+构成的几何构型为___________ 。
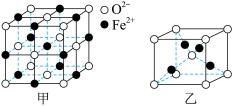
②Cu2O立方晶胞结构如图乙所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为___________ g·cm-3(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)。
(1)上述反应体系中出现的几种短周期元素中,第二周期元素原子半径由大到小的顺序是
(2)反应体系中出现的非金属元素,可形成多种化合物,其中和铵根离子空间构型相同,且属于有机物的电子式是
(3)化合物FeF3熔点高于1000℃而Fe(CO)5的熔点却低于0℃,FeF3熔点远高于Fe(CO)5的原因可能是
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。
①FeO立方晶胞结构如图甲所示,则Fe2+的配位数为

②Cu2O立方晶胞结构如图乙所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为
您最近一年使用:0次
2023-11-10更新
|
140次组卷
|
2卷引用:黑龙江省鹤岗市第一中学2022-2023学年高二下学期3月月考化学试题
名校
5 . 下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼 的是:___________ (填元素符号),检验太阳光中是否含有该元素的方法是___________ 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是___________ ,碱性最强的化合物的电子式 是:___________ 。
(3)⑩简单氢化物的VSEPR构型是___________ 形,①⑥形成的化合物可作溶剂,该分子中心原子杂化轨道是___________ ,分子构型___________ 形。
(4)用电子式表示元素④与⑥的化合物的形成过程:___________
(5)表示①与⑦的化合物的电子式___________ ,该化合物是___________ 分子(填“极性”“非极性”)的理由:___________ 。
(6)试用一个离子方程式说明②和③的简单氢化物结合Cu2+的能力___________ 。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ⑧ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是
(3)⑩简单氢化物的VSEPR构型是
(4)用电子式表示元素④与⑥的化合物的形成过程:
(5)表示①与⑦的化合物的电子式
(6)试用一个离子方程式说明②和③的简单氢化物结合Cu2+的能力
您最近一年使用:0次
名校
6 . 下表为周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)③基态原子的核外电子轨道表示式是___________ 。
(2)写出元素⑩的一价离子的核外电子排布式:___________ ,该元素属于___________ 区元素。
(3)由元素④构成的三原子分子的空间结构为___________ 。
(4)元素④⑥⑦的气态氢化物热稳定性由强到弱的顺序为:___________ (填化学式)。
(5)③与①以原子个数比为 形成的化合物X可用于火箭发射的燃料,其中③的杂化轨道类型为
形成的化合物X可用于火箭发射的燃料,其中③的杂化轨道类型为___________ ,X为___________ (极性分子或非极性分子)
(6)已知周期表中存在对角相似规则,如②与⑤在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑨的氢氧化物反应的化学方程式___________ 。
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑨ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||||
| ⑩ | |||||||||||||||||
(1)③基态原子的核外电子轨道表示式是
(2)写出元素⑩的一价离子的核外电子排布式:
(3)由元素④构成的三原子分子的空间结构为
(4)元素④⑥⑦的气态氢化物热稳定性由强到弱的顺序为:
(5)③与①以原子个数比为
 形成的化合物X可用于火箭发射的燃料,其中③的杂化轨道类型为
形成的化合物X可用于火箭发射的燃料,其中③的杂化轨道类型为(6)已知周期表中存在对角相似规则,如②与⑤在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑨的氢氧化物反应的化学方程式
您最近一年使用:0次
名校
7 . 有A、B、C、D、E、F、G7种元素,它们的核电荷数依次增大,且A~E都为短周期元素。其中G元素是1826年一位法国青年科学家发现的,他在研究海水制盐时向剩余的副产物(苦卤)中通入氯气后发现溶液的颜色变深,经过一步提取可得红棕色液体,有刺激性气味;A为非金属元素,A和F属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上的电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)写出下列元素的名称:A:_____ ,C:_____ ,E:_____ ,G:_____ 。
(2)G元素在周期表中的位置为:______ ;其价电子排布图为:______ 。
(3)由A、B、C、D、F五种元素组成的一种化合物为______ (写化学式),并写出该物质的一种用途______ 。
(4)已知由D和E形成的一种化合物D2E2是一种橙黄色液体遇水剧烈反应,产生能使品红溶液褪色的气体。
①D2E2中E为_____ 价;且该物质为_____ (填”极性”或“非极性”)分子。
②写出D2E2与水反应的化学方程式______ 。
(1)写出下列元素的名称:A:
(2)G元素在周期表中的位置为:
(3)由A、B、C、D、F五种元素组成的一种化合物为
(4)已知由D和E形成的一种化合物D2E2是一种橙黄色液体遇水剧烈反应,产生能使品红溶液褪色的气体。
①D2E2中E为
②写出D2E2与水反应的化学方程式
您最近一年使用:0次
名校
解题方法
8 . 生产生活中处处有化学,结合物质与结构的相关知识,回答下列问题:
(1)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示
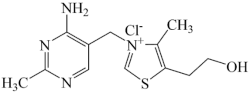
①C元素基态原子核外电子有_______ 种运动状态,其中电子占据能量最高的能级符号为_______ 。
②维生素B1晶体溶于水的过程中要克服的微粒间的作用力有_______ 。(填序号)
a.离子键、共价键 b.离子键、氢键、共价键
c.氢键、范德华力 d.离子键、氢键、范德华力
③维生素B1燃烧可生成N2、NH3、CO2、SO2、H2O、HCl等物质,这些物质中属于非极性分子的化合物有_______ 。(填化学式)
(2)液氨常被用作制冷剂,若不断地升高温度,实现“液氨→氨气→氮气和氢气→氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的主要相互作用是①_______ ;②极性键;③_______ 。
(3)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应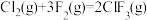 △H=-313 kJ/mol,F-F键的键能为159 kJ/mol,Cl-Cl键的键能为242 kJ/mol,则ClF3中Cl-F键的平均键能为
△H=-313 kJ/mol,F-F键的键能为159 kJ/mol,Cl-Cl键的键能为242 kJ/mol,则ClF3中Cl-F键的平均键能为_______ kJ/mol。ClF3的熔、沸点比BrF3的_______ (填“高”或“低”)。
(4)TiCl4稳定性比CCl4差,极易水解,试从结构分析其原因_______ 。
(5)氯丙烯分子(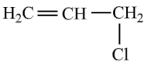 )中碳原子轨道杂化类型是
)中碳原子轨道杂化类型是_______ 。
(6)铁能与三氮唑(Bipy,结构如图)形成多种化合物。
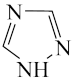
1 mol Bipy中含有σ键_______ mol。
(1)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示

①C元素基态原子核外电子有
②维生素B1晶体溶于水的过程中要克服的微粒间的作用力有
a.离子键、共价键 b.离子键、氢键、共价键
c.氢键、范德华力 d.离子键、氢键、范德华力
③维生素B1燃烧可生成N2、NH3、CO2、SO2、H2O、HCl等物质,这些物质中属于非极性分子的化合物有
(2)液氨常被用作制冷剂,若不断地升高温度,实现“液氨→氨气→氮气和氢气→氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的主要相互作用是①
(3)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应
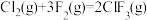 △H=-313 kJ/mol,F-F键的键能为159 kJ/mol,Cl-Cl键的键能为242 kJ/mol,则ClF3中Cl-F键的平均键能为
△H=-313 kJ/mol,F-F键的键能为159 kJ/mol,Cl-Cl键的键能为242 kJ/mol,则ClF3中Cl-F键的平均键能为(4)TiCl4稳定性比CCl4差,极易水解,试从结构分析其原因
(5)氯丙烯分子(
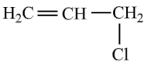 )中碳原子轨道杂化类型是
)中碳原子轨道杂化类型是(6)铁能与三氮唑(Bipy,结构如图)形成多种化合物。

1 mol Bipy中含有σ键
您最近一年使用:0次
名校
9 . I.以下物质中:①HF ②Cl2 ③H2O ④N2 ⑤C2H4
(1)既有极性键又有非极性键的是_______ 。
(2)只含有σ键的是_______ 。
(3)属于极性分子的是_______ 。
(4)属于非极性分子的是_______ 。
II.COCl2分子的结构式为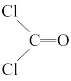
(5)COCl2分子内含有_______(填选项字母)。
III.超氧化钾的晶胞结构如图所示。

(6)则与K+等距离且最近的K+个数为_______ 。
(1)既有极性键又有非极性键的是
(2)只含有σ键的是
(3)属于极性分子的是
(4)属于非极性分子的是
II.COCl2分子的结构式为

(5)COCl2分子内含有_______(填选项字母)。
| A.4个σ键 | B.2个σ键、2个π键 |
| C.2个σ键、1个π键 | D.3个σ键、1个π键 |
III.超氧化钾的晶胞结构如图所示。

(6)则与K+等距离且最近的K+个数为
您最近一年使用:0次
名校
解题方法
10 . 有以下10种微粒:①CCl4 ②BeCl2 ③CH≡CH ④NH3 ⑤NH ⑥BF3 ⑦HCHO ⑧H2O ⑨H2O2 ⑩SiH4
⑥BF3 ⑦HCHO ⑧H2O ⑨H2O2 ⑩SiH4
(1)空间结构呈正四面体的是_______ (填序号,下同)
(2)中心原子采用sp2杂化方式的是_______ 。
(3)所有原子共平面的是_______ 。
(4)含有极性键的极性分子是_______ 。
 ⑥BF3 ⑦HCHO ⑧H2O ⑨H2O2 ⑩SiH4
⑥BF3 ⑦HCHO ⑧H2O ⑨H2O2 ⑩SiH4(1)空间结构呈正四面体的是
(2)中心原子采用sp2杂化方式的是
(3)所有原子共平面的是
(4)含有极性键的极性分子是
您最近一年使用:0次



