1 . A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B元素原子最外层电子数比次外层多2;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;D和E的原子序数和为30;在元素周期表中,C是E的不同周期邻族元素。五种元素两两形成的化合物有甲、乙、两、丁四种分子中原子个数比如下表:
(1)写出元素符号:B___________ ,E___________ 。
(2)A元素某原子核内中子数比质子数多1,则该核素的组成符号为___________ 。物质丁的分子为___________ 分子(填“极性”或“非极性”)。
(3)向甲的水溶液中加入MnO2,氧化产物是___________ 。
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量气体和难溶物,有关离子方程式为___________ 。
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个比 | A∶C=1∶1 | B∶A=1∶2 | D∶E=1∶3 | B∶E=1∶4 |
(1)写出元素符号:B
(2)A元素某原子核内中子数比质子数多1,则该核素的组成符号为
(3)向甲的水溶液中加入MnO2,氧化产物是
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量气体和难溶物,有关离子方程式为
您最近一年使用:0次
解题方法
2 . 钛是20世纪50年代发展起来的一种重要的结构金属,钛合金因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。回答下列问题:
(1)钛元素在元素周期表中的位置_____ 。与钛同周期且未成对电子数最多的元素,其价层电子排布图为_____ 。
(2)二氧化钛与 (光气)、
(光气)、 (二氯亚砜)等氯化试剂反应可用于制取四氯化钛。
(二氯亚砜)等氯化试剂反应可用于制取四氯化钛。
① 的空间构型为
的空间构型为_____ , 中
中 键和
键和 键的数目比为
键的数目比为_____ 。
② 是
是_____ 分子。(填“极性”或“非极性”)
(3)钛的某配合物可用于催化环烯烃聚合,其结构如下图所示:
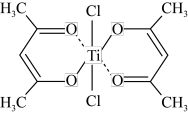
该配合物中存在的化学键有_____ (填字母)。
a.离子键 b.配位键 c.金属键 d.共价键 e.氢键
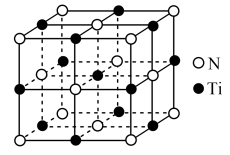
(4)氮化钛晶体的晶胞结构如图所示,该晶体结构中与 原子距离最近且相等的
原子距离最近且相等的 原子有
原子有_____ 个;若该晶胞的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞中
,则晶胞中 原子与
原子与 原子的最近距离为
原子的最近距离为_____  。(用含
。(用含 、
、 的代数式表示,
的代数式表示, 的相对原子质量48)
的相对原子质量48)
(5)在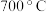 左右,将
左右,将 通过二氧化钛和炭粉的混合物可生成
通过二氧化钛和炭粉的混合物可生成 和一种含碳元素的气体,写出该反应的化学方程式
和一种含碳元素的气体,写出该反应的化学方程式_____ 。
(1)钛元素在元素周期表中的位置
(2)二氧化钛与
 (光气)、
(光气)、 (二氯亚砜)等氯化试剂反应可用于制取四氯化钛。
(二氯亚砜)等氯化试剂反应可用于制取四氯化钛。①
 的空间构型为
的空间构型为 中
中 键和
键和 键的数目比为
键的数目比为②
 是
是(3)钛的某配合物可用于催化环烯烃聚合,其结构如下图所示:

该配合物中存在的化学键有
a.离子键 b.配位键 c.金属键 d.共价键 e.氢键
(4)氮化钛晶体的晶胞结构如图所示,该晶体结构中与
 原子距离最近且相等的
原子距离最近且相等的 原子有
原子有 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞中
,则晶胞中 原子与
原子与 原子的最近距离为
原子的最近距离为 。(用含
。(用含 、
、 的代数式表示,
的代数式表示, 的相对原子质量48)
的相对原子质量48)
(5)在
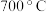 左右,将
左右,将 通过二氧化钛和炭粉的混合物可生成
通过二氧化钛和炭粉的混合物可生成 和一种含碳元素的气体,写出该反应的化学方程式
和一种含碳元素的气体,写出该反应的化学方程式
您最近一年使用:0次
解题方法
3 . 硼是一种用途广泛的工业原料,除了用于生产硼砂、硼酸和硼的各种化合物外,在制备储氢材料方面也有重要的用途,试回答下列问题:
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为___________ , 的价层电子对数是
的价层电子对数是___________ 。
(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为___________ ;基态Q原子核外成对电子数和未成对电子数之比为___________ 。
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(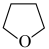 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: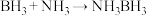 。
。
①测定晶体结构最常用的方法为___________ 。
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是___________ 。_
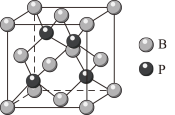
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有___________ 个;每个晶胞中的原子总数为___________ 。
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为
 的价层电子对数是
的价层电子对数是(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(
 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: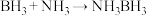 。
。①测定晶体结构最常用的方法为
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有

您最近一年使用:0次
4 . 火法冶炼是以黄铜矿(CuFeS2)为主要原料,下图是一种火法制备高纯度铜的工艺。

(1)黄铜矿熔炼过程中会发生反应:2CuFeS2+O2=Cu2S+2FeS+SO2.若2 mol CuFeS2参与反应,转移电子数目为_______ 。在上述反应中,SO2是_______ 。
A.氧化剂 B.还原剂 C.还原产物 D.氧化产物
(2)吹炼过程中,向熔融的冰铜中加入SiO2的目的是_______ 。
(3)粗铜经电解精炼可获得高纯度铜,下列说法正确的是
(4)关于SO2的说法正确的是
(5)煤中掺入一定量的生石灰,能减少煤燃烧排放的SO2,体现SO2具有
(6)冶铜烟气可以作为工业制硫酸为原料。下列的说法正确的是
(7)蔗糖遇浓硫酸会变成“黑面包”状,下列说法正确的是

(1)黄铜矿熔炼过程中会发生反应:2CuFeS2+O2=Cu2S+2FeS+SO2.若2 mol CuFeS2参与反应,转移电子数目为
A.氧化剂 B.还原剂 C.还原产物 D.氧化产物
(2)吹炼过程中,向熔融的冰铜中加入SiO2的目的是
(3)粗铜经电解精炼可获得高纯度铜,下列说法正确的是
| A.粗铜做阴极,发生氧化反应 |
| B.电解质溶液中铜离子向阴极移动 |
| C.利用阳极泥可回收Ag、Zn、Au等金属 |
| D.当电路中通过的电子数为NA时,阳极的质量变化一定是32 g |
(4)关于SO2的说法正确的是
| A.中心原子的杂化类型为sp2 | B.电负性:O<S |
| C.属于非极性分子 | D.价层电子对的空间结构为平面三角形 |
(5)煤中掺入一定量的生石灰,能减少煤燃烧排放的SO2,体现SO2具有
| A.漂白性 | B.酸性氧化物的性质 |
| C.氧化性 | D.还原性 |
(6)冶铜烟气可以作为工业制硫酸为原料。下列的说法正确的是
| A.500℃左右,转化器中反应的平衡转化率最大 |
| B.使用以铁为主的催化剂 |
| C.冶炼烟气在进入转化器之前,必须进行除尘、干燥等净化操作,防止催化剂中毒 |
| D.压强一般采用20~50MPa |
(7)蔗糖遇浓硫酸会变成“黑面包”状,下列说法正确的是
| A.蔗糖属于多糖 |
| B.在水浴条件下,蔗糖能与银氨溶液反应产生“银镜” |
| C.浓硫酸表现出脱水性、氧化性 |
| D.产生的气体通入品红溶液,溶液会褪色 |
您最近一年使用:0次
5 . 在某温度下,5L密闭容器内发生如下反应:CH4(g)+H2O (g) CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0
(1)反应中的非极性分子为:______ 、______ 。
(2)一个可逆反应的平衡常数只随温度而变化,请写出该反应的平衡常数表达式______ ,当温度升高,该平衡常数______ (填“增大”、“减小”或“不变”)。
(3)反应20min后生成了18g氢气,甲烷的平均反应速率为______ 。
(4)下列选项中的物理量不变时,一定可以判断反应达到平衡的是______(双选)。
(5)在某一时刻,v正=v逆=v,此时反应达到平衡。若改变一条件,可使得v正<v逆<v,指出可以改变的条件______ ,并说明理由:__________________ 。
A.升高温度 B.增大压强 C.降低温度 D.降低压强
(6)已知CO与H2合成CH3OH是可逆反应:CO+2H2 CH3OH。试求:当投料比n(CO):n(H2)=
CH3OH。试求:当投料比n(CO):n(H2)= ______ 时,平衡时CO与H2的转化率相同。
 CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0(1)反应中的非极性分子为:
(2)一个可逆反应的平衡常数只随温度而变化,请写出该反应的平衡常数表达式
(3)反应20min后生成了18g氢气,甲烷的平均反应速率为
(4)下列选项中的物理量不变时,一定可以判断反应达到平衡的是______(双选)。
| A.氢元素的质量分数 | B.容器内的压强 |
| C.反应的平衡常数 | D.容器内气体的平均分子量 |
A.升高温度 B.增大压强 C.降低温度 D.降低压强
(6)已知CO与H2合成CH3OH是可逆反应:CO+2H2
 CH3OH。试求:当投料比n(CO):n(H2)=
CH3OH。试求:当投料比n(CO):n(H2)=
您最近一年使用:0次
6 . 盐酸羟胺 是一种还原剂和显像剂,其化学性质与
是一种还原剂和显像剂,其化学性质与 类似。
类似。
(1) 被
被 取代可形成羟胺
取代可形成羟胺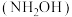 ,羟胺水溶液显碱性,用相关离子方程式解释原因
,羟胺水溶液显碱性,用相关离子方程式解释原因___________ 。
(2)已知氮原子上电子云密度越大则碱性越强,实验测得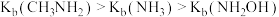 ,请解释原因:
,请解释原因:___________ 。
(3)采用原电池原理制备盐酸羟胺的装置如下图所示:

①含铁催化电极发生的电极反应式为___________ 。
②盐酸初始浓度相同,假设两侧溶液体积均为 且保持不变,理论上电路中通过
且保持不变,理论上电路中通过 电子时,左右两侧
电子时,左右两侧 浓度相差
浓度相差___________  。
。
 是一种还原剂和显像剂,其化学性质与
是一种还原剂和显像剂,其化学性质与 类似。
类似。(1)
 被
被 取代可形成羟胺
取代可形成羟胺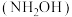 ,羟胺水溶液显碱性,用相关离子方程式解释原因
,羟胺水溶液显碱性,用相关离子方程式解释原因(2)已知氮原子上电子云密度越大则碱性越强,实验测得
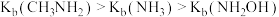 ,请解释原因:
,请解释原因:(3)采用原电池原理制备盐酸羟胺的装置如下图所示:

①含铁催化电极发生的电极反应式为
②盐酸初始浓度相同,假设两侧溶液体积均为
 且保持不变,理论上电路中通过
且保持不变,理论上电路中通过 电子时,左右两侧
电子时,左右两侧 浓度相差
浓度相差 。
。
您最近一年使用:0次
7 . 硼元素在地壳中的含量仅为 ,但它却有着种类繁多的化合物。
,但它却有着种类繁多的化合物。
(1)基态 原子的电子排布式为
原子的电子排布式为___________ ;基态 原子的核外电子运动状态有
原子的核外电子运动状态有___________ 种。
(2)根据 的解离反应:
的解离反应: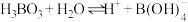 ,
,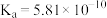 ,可判断
,可判断 是
是___________ 酸, 离子的VSEPR模型为
离子的VSEPR模型为___________ ,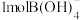 离子中含有
离子中含有___________  键。
键。
(3)分子式为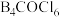 的化合物的结构如图,其中
的化合物的结构如图,其中 原子的杂化类型是
原子的杂化类型是___________ ,B-B-B键的键角___________ 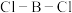 的键角(填“>”“<”或“=”)。
的键角(填“>”“<”或“=”)。

(4)在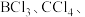 和
和 三种分子中,属于极性分子的是
三种分子中,属于极性分子的是___________ ,多原子分子中各原子若在同一平面,且有相互平行的 轨道,则
轨道,则 电子可在多个原子间运动,形成“离域
电子可在多个原子间运动,形成“离域 键”,上述三种分子中存在“离域
键”,上述三种分子中存在“离域 键”的是
键”的是___________ 。
 ,但它却有着种类繁多的化合物。
,但它却有着种类繁多的化合物。(1)基态
 原子的电子排布式为
原子的电子排布式为 原子的核外电子运动状态有
原子的核外电子运动状态有(2)根据
 的解离反应:
的解离反应: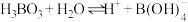 ,
,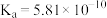 ,可判断
,可判断 是
是 离子的VSEPR模型为
离子的VSEPR模型为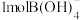 离子中含有
离子中含有 键。
键。(3)分子式为
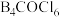 的化合物的结构如图,其中
的化合物的结构如图,其中 原子的杂化类型是
原子的杂化类型是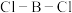 的键角(填“>”“<”或“=”)。
的键角(填“>”“<”或“=”)。
(4)在
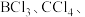 和
和 三种分子中,属于极性分子的是
三种分子中,属于极性分子的是 轨道,则
轨道,则 电子可在多个原子间运动,形成“离域
电子可在多个原子间运动,形成“离域 键”,上述三种分子中存在“离域
键”,上述三种分子中存在“离域 键”的是
键”的是
您最近一年使用:0次
名校
解题方法
8 .  是9种中学化学中常见的元素。
是9种中学化学中常见的元素。
(1)原子结构与元素性质
①基态氢原子中,核外电子的电子云轮廓图形状为________ 。
②3种元素 中,离子半径最小的是
中,离子半径最小的是______ (填离子符号)。
③基态 的价层电子轨道表示式为
的价层电子轨道表示式为________ 。
(2)微粒间相互作用与物质性质
①胆矾( )的结构示意图如下所示。
)的结构示意图如下所示。 与
与 与
与 的作用力分别为
的作用力分别为______ 和______ 。
② 的VSEPR模型为
的VSEPR模型为______ , 的分子空间构型为
的分子空间构型为________ , 是
是________ (填“极性”或“非极性”)分子。
③写出 电子式:
电子式:________ , 形成过程的电子式:
形成过程的电子式:______ 。
④比较 分子中的键角大小并给出相应解释:
分子中的键角大小并给出相应解释:_______ 。
⑤相同条件下, 在水中的溶解度大于
在水中的溶解度大于 的,理由是
的,理由是_________ 。
 是9种中学化学中常见的元素。
是9种中学化学中常见的元素。(1)原子结构与元素性质
①基态氢原子中,核外电子的电子云轮廓图形状为
②3种元素
 中,离子半径最小的是
中,离子半径最小的是③基态
 的价层电子轨道表示式为
的价层电子轨道表示式为(2)微粒间相互作用与物质性质
①胆矾(
 )的结构示意图如下所示。
)的结构示意图如下所示。
 与
与 与
与 的作用力分别为
的作用力分别为②
 的VSEPR模型为
的VSEPR模型为 的分子空间构型为
的分子空间构型为 是
是③写出
 电子式:
电子式: 形成过程的电子式:
形成过程的电子式:④比较
 分子中的键角大小并给出相应解释:
分子中的键角大小并给出相应解释:⑤相同条件下,
 在水中的溶解度大于
在水中的溶解度大于 的,理由是
的,理由是
您最近一年使用:0次
名校
解题方法
9 . 化学反应中既有物质变化,也有能量变化。这些变化与化学反应的条件、限度、速率等因素有关。
(1)已知NH4F溶液呈酸性,则水解程度
___________ F-(填“>”、“<”或“=”),稀释后溶液中 的值将会
的值将会 ___________ (填“增大”、“减小”或“不变”)。
(2)某温度下,在体积为5L的密闭容器内发生如下反应:
CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH>0
①在上述反应的反应物与生成物中,非极性分子为:___________ 。
②上述反应中各物质反应速率之间的关系为:___________ 。
③若反应20min后气体总物质的量增加了10mol,则甲烷的平均反应速率为___________ 。
④下列选项中的物理量不变时,一定可以判断反应达到平衡的是___________ 。
A.容器内氢元素的质量分数
B.容器内气体的密度
C.容器内气体的压强
D.容器内气体的平均相对分子质量
⑤在某一时刻,v正=v逆=v0,反应若改变某一条件,可使得v正<v逆<v0,指出可以改变的条件___________ 。
⑥已知CO与H2合成CH3OH是可逆反应:CO+2H2⇌CH3OH,若上述反应达到平衡时CO与H2的转化率相同,则投料比n(CO):n(H2)=___________ 。
(1)已知NH4F溶液呈酸性,则水解程度

 的值将会
的值将会 (2)某温度下,在体积为5L的密闭容器内发生如下反应:
CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH>0
①在上述反应的反应物与生成物中,非极性分子为:
②上述反应中各物质反应速率之间的关系为:
③若反应20min后气体总物质的量增加了10mol,则甲烷的平均反应速率为
④下列选项中的物理量不变时,一定可以判断反应达到平衡的是
A.容器内氢元素的质量分数
B.容器内气体的密度
C.容器内气体的压强
D.容器内气体的平均相对分子质量
⑤在某一时刻,v正=v逆=v0,反应若改变某一条件,可使得v正<v逆<v0,指出可以改变的条件
⑥已知CO与H2合成CH3OH是可逆反应:CO+2H2⇌CH3OH,若上述反应达到平衡时CO与H2的转化率相同,则投料比n(CO):n(H2)=
您最近一年使用:0次
名校
解题方法
10 . 氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的关键环节。
Ⅰ. 可用作储存氢气的材料,结构如下图所示。
可用作储存氢气的材料,结构如下图所示。
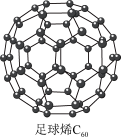
(1)继 后,科学家合成了
后,科学家合成了 、
、 ,三者结构相似。下列说法正确的是
,三者结构相似。下列说法正确的是_______ (填序号)
A. 、
、 、
、 都属于共价晶体
都属于共价晶体
B.由于N-N键能小于 ,故
,故 的稳定性弱于
的稳定性弱于
C.由于C-C键长小于Si-Si键,所以 熔沸点低于
熔沸点低于
Ⅱ.是储氢材料,已知其由 和
和 构成,释放氢气的原理为
构成,释放氢气的原理为 。
。
(2) 中不存在的作用力有
中不存在的作用力有___________ (填序号)。
A.离子键 B.共价键 C.分子间作用力
(3)氢化锂(LiH)是离子化合物,写出其电子式___________ ,LiH中离子半径较大的是___________ ,其原因是___________ 。
Ⅲ.汽车安全气囊中的填充物有 (叠氮酸钠)、
(叠氮酸钠)、 、
、 等物质,
等物质, 遇撞击时能生成金属钠和氮气。完成下列填空:
遇撞击时能生成金属钠和氮气。完成下列填空:
(4)写出 的电子式:
的电子式:___________ 。
(5) 和
和 是两种不同的化合物,
是两种不同的化合物, 是由一种单原子离子和一种多原子离子以1:1的比例构成的化合物。
是由一种单原子离子和一种多原子离子以1:1的比例构成的化合物。 晶体中存在的化学键类型有
晶体中存在的化学键类型有___________ , 遇
遇 会水解而产生
会水解而产生 和
和 ,
, 晶体中存在的化学键类型有
晶体中存在的化学键类型有___________ 。
(6)汽车安全气囊填充物的三种物质中属于共价化合物的是___________ (填写化学式),所涉及的5种元素中,原子半径最大的是___________ (填写元素符号)。
(7)该题中出现的极性分子有___________ 。
(8)渗氮工艺已经成为钢材处理的重要手段,已知一种磁性氮化铁晶胞如下图,该物质的化学式是___________ 。

Ⅰ.
 可用作储存氢气的材料,结构如下图所示。
可用作储存氢气的材料,结构如下图所示。
(1)继
 后,科学家合成了
后,科学家合成了 、
、 ,三者结构相似。下列说法正确的是
,三者结构相似。下列说法正确的是A.
 、
、 、
、 都属于共价晶体
都属于共价晶体B.由于N-N键能小于
 ,故
,故 的稳定性弱于
的稳定性弱于
C.由于C-C键长小于Si-Si键,所以
 熔沸点低于
熔沸点低于
Ⅱ.是储氢材料,已知其由
 和
和 构成,释放氢气的原理为
构成,释放氢气的原理为 。
。(2)
 中不存在的作用力有
中不存在的作用力有A.离子键 B.共价键 C.分子间作用力
(3)氢化锂(LiH)是离子化合物,写出其电子式
Ⅲ.汽车安全气囊中的填充物有
 (叠氮酸钠)、
(叠氮酸钠)、 、
、 等物质,
等物质, 遇撞击时能生成金属钠和氮气。完成下列填空:
遇撞击时能生成金属钠和氮气。完成下列填空:(4)写出
 的电子式:
的电子式:(5)
 和
和 是两种不同的化合物,
是两种不同的化合物, 是由一种单原子离子和一种多原子离子以1:1的比例构成的化合物。
是由一种单原子离子和一种多原子离子以1:1的比例构成的化合物。 晶体中存在的化学键类型有
晶体中存在的化学键类型有 遇
遇 会水解而产生
会水解而产生 和
和 ,
, 晶体中存在的化学键类型有
晶体中存在的化学键类型有(6)汽车安全气囊填充物的三种物质中属于共价化合物的是
(7)该题中出现的极性分子有
(8)渗氮工艺已经成为钢材处理的重要手段,已知一种磁性氮化铁晶胞如下图,该物质的化学式是

您最近一年使用:0次



