1 . 一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe四种金属元素组成。请回答下列问题:
(1)基态铁原子的核外电子排布式为_______ ,从结构角度来看,Fe2+易被氧化成Fe3+的原因是_______ 。
(2)SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①硫氰酸分子中硫原子的杂化方式为_______ 。
②异硫氰酸的沸点比硫氰酸高的原因是_______ 。
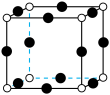
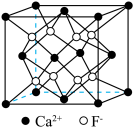
(3)AlF3的熔点为1090℃,远高于AlCl3的熔点192℃,原因为_______ 。AlF3结构属立方晶系,其晶胞如图1所示,F的配位数为_______ 。_______ cm(用含有ρ、NA的代数式表示)。_______ ;若晶胞的底面边长为apm,高为bpm,阿伏加德罗常数为NA,则该晶体的密度为_______ g·cm-3(用含有a、b、NA的代数式表示)。
(1)基态铁原子的核外电子排布式为
(2)SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①硫氰酸分子中硫原子的杂化方式为
②异硫氰酸的沸点比硫氰酸高的原因是
(3)AlF3的熔点为1090℃,远高于AlCl3的熔点192℃,原因为
您最近一年使用:0次
名校
解题方法
2 .  是重要的半导体材料,
是重要的半导体材料, (镓)、P、
(镓)、P、 (砷)都是形成化合物半导体材料的重要元素.回答下列问题:
(砷)都是形成化合物半导体材料的重要元素.回答下列问题:
(1) 基态原子的电子占据了
基态原子的电子占据了_____________ 个能层,最高能级的电子排布式为_____________ ;
(2)元素周期表中,与P紧邻的4种元素中电负性最大的是_____________ (填元素符号)。 、P、S三种元素的第一电离能由大到小的顺序是
、P、S三种元素的第一电离能由大到小的顺序是_____________ ;
(3) 三者的沸点由高到低的顺序是
三者的沸点由高到低的顺序是__________________ ,原因是____________________________ ;
(4)白磷是由 分子形成的分子晶体,
分子形成的分子晶体, 分子呈正四面体结构,P原子位于正四面体的四个顶点.白磷易溶于
分子呈正四面体结构,P原子位于正四面体的四个顶点.白磷易溶于 ,难溶于水,原因是
,难溶于水,原因是________________________ ;
(5)采用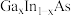 (镓铟砷)等材料,可提高太阳能电池的效率。
(镓铟砷)等材料,可提高太阳能电池的效率。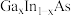 立方体形晶胞中每个顶点和面心都有一个原子,晶胞内部有4个原子,则该晶胞中含有
立方体形晶胞中每个顶点和面心都有一个原子,晶胞内部有4个原子,则该晶胞中含有_____________ 个砷原子;
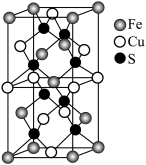
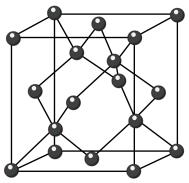
(6) 晶体的晶胞结构与金刚石相似(如图),设晶胞的边长为
晶体的晶胞结构与金刚石相似(如图),设晶胞的边长为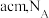 表示阿伏加德罗常数,则该晶体的密度为
表示阿伏加德罗常数,则该晶体的密度为_____________  。
。
 是重要的半导体材料,
是重要的半导体材料, (镓)、P、
(镓)、P、 (砷)都是形成化合物半导体材料的重要元素.回答下列问题:
(砷)都是形成化合物半导体材料的重要元素.回答下列问题:(1)
 基态原子的电子占据了
基态原子的电子占据了(2)元素周期表中,与P紧邻的4种元素中电负性最大的是
 、P、S三种元素的第一电离能由大到小的顺序是
、P、S三种元素的第一电离能由大到小的顺序是(3)
 三者的沸点由高到低的顺序是
三者的沸点由高到低的顺序是(4)白磷是由
 分子形成的分子晶体,
分子形成的分子晶体, 分子呈正四面体结构,P原子位于正四面体的四个顶点.白磷易溶于
分子呈正四面体结构,P原子位于正四面体的四个顶点.白磷易溶于 ,难溶于水,原因是
,难溶于水,原因是(5)采用
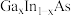 (镓铟砷)等材料,可提高太阳能电池的效率。
(镓铟砷)等材料,可提高太阳能电池的效率。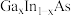 立方体形晶胞中每个顶点和面心都有一个原子,晶胞内部有4个原子,则该晶胞中含有
立方体形晶胞中每个顶点和面心都有一个原子,晶胞内部有4个原子,则该晶胞中含有(6)
 晶体的晶胞结构与金刚石相似(如图),设晶胞的边长为
晶体的晶胞结构与金刚石相似(如图),设晶胞的边长为 表示阿伏加德罗常数,则该晶体的密度为
表示阿伏加德罗常数,则该晶体的密度为 。
。
您最近一年使用:0次
2024-05-02更新
|
86次组卷
|
2卷引用:陕西省汉中市洋县中学2023-2024学年高二下学期期中考试化学试题
名校
3 . 下列有关结构和性质的说法正确的是
| A.O3分子中存在非极性共价键,所以O3为非极性分子 |
| B.邻羟基苯甲醛能形成分子内氢键,而对羟基苯甲醛能形成分子间氢键,所以前者的熔点高于后者 |
| C.乙烯分子中两个碳原子间以sp2杂化轨道形成的σ键较稳定,未杂化的2p轨道形成的π键易断裂,所以易发生加成反应 |
| D.金属Li中的金属键比金属K中的金属键强,所以单质Li的还原性比K强 |
您最近一年使用:0次
2024-05-02更新
|
175次组卷
|
2卷引用:陕西省汉中市洋县中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
4 . 下列叙述中正确的有句
①离子键没有方向性和饱和性,而共价键有方向性和饱和性
②配位键在形成时,是由成键双方各提供一个电子形成共用电子对
③金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
④在冰晶体中,既有极性键、非极性键,又有氢键
⑤化合物NH4Cl和CuSO4·5H2O都存在配位键
⑥NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同
①离子键没有方向性和饱和性,而共价键有方向性和饱和性
②配位键在形成时,是由成键双方各提供一个电子形成共用电子对
③金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
④在冰晶体中,既有极性键、非极性键,又有氢键
⑤化合物NH4Cl和CuSO4·5H2O都存在配位键
⑥NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同
| A.2句 | B.3句 | C.4句 | D.5句 |
您最近一年使用:0次
2024-05-02更新
|
119次组卷
|
2卷引用:陕西省汉中市洋县中学2023-2024学年高二下学期期中考试化学试题
名校
5 . 下列说法中正确的有
①由原子构成的晶体不一定是共价晶体
②水结成冰密度减小与水分子之间能形成氢键有关
③HF、HCl、HBr、HI的热稳定性和还原性依次减弱
④共价键的强弱决定分子晶体熔、沸点的高低
⑤ 、
、 、
、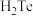 的热稳定性依次减弱,熔沸点依次升高
的热稳定性依次减弱,熔沸点依次升高
⑥硬度由大到小:金刚石>碳化硅>晶体硅
①由原子构成的晶体不一定是共价晶体
②水结成冰密度减小与水分子之间能形成氢键有关
③HF、HCl、HBr、HI的热稳定性和还原性依次减弱
④共价键的强弱决定分子晶体熔、沸点的高低
⑤
 、
、 、
、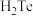 的热稳定性依次减弱,熔沸点依次升高
的热稳定性依次减弱,熔沸点依次升高⑥硬度由大到小:金刚石>碳化硅>晶体硅
| A.②③④⑥ | B.①②③⑥ | C.①②④⑤ | D.①②⑤⑥ |
您最近一年使用:0次
2024-04-25更新
|
271次组卷
|
4卷引用:陕西省咸阳市武功县普集高级中学2023-2024学年高二下学期3月第一次月考化学试题
名校
6 . 下列对实验事实或物质用途的解释正确的是
| 实验事实或物质用途 | 解释 | |
| A | 用红热的铁针刺水晶柱表面凝固的石蜡,石蜡在不同方向熔化的快慢不同 | 水晶内部质点排列有序,导热性各向异性 |
| B | 工业上常用液氨作制冷剂 | 断裂NH3中H—N需要吸收能量 |
| C | 蔗糖易溶于水,难溶于四氯化碳 | 蔗糖和四氯化碳都是有机物,这违背了“相似相溶”规律 |
| D | 紫红色碘的四氯化碳溶液中,加入浓碘化钾水溶液,紫色变浅 | 碘在水中溶解性比碘在四氯化碳中溶解性好 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-22更新
|
120次组卷
|
2卷引用:陕西省汉中市多校联考2023-2024学年高二下学期期中考试化学试卷
名校
7 . 卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)拟卤素 、
、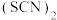 与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。
与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。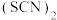 对应的酸有两种,测得硫氰酸
对应的酸有两种,测得硫氰酸 的沸点低于异硫氰酸
的沸点低于异硫氰酸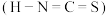 ,其原因是
,其原因是_______ 。
(2) 可与
可与 互溶,从微观角度解释其原因为
互溶,从微观角度解释其原因为_______ ; 属于多卤素阳离子,其空间构型为
属于多卤素阳离子,其空间构型为_______ 。
(3)卤素互化物如IBr、ICl等与卤素单质结构和性质相似。 、IBr、ICl沸点由高到低的顺序为
、IBr、ICl沸点由高到低的顺序为_______ 。
(4)气态 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图(a)所示,二聚体中Al的轨道杂化类型为
的形式存在,其空间结构如图(a)所示,二聚体中Al的轨道杂化类型为_______ 。 的熔点为1090℃,远高于的192℃,由此可以判断铝氟之间的化学键为
的熔点为1090℃,远高于的192℃,由此可以判断铝氟之间的化学键为_______ 键。 结构属立方晶系,晶胞参数为apm,晶胞如图(b)所示。该晶体中与
结构属立方晶系,晶胞参数为apm,晶胞如图(b)所示。该晶体中与 距离最近且相等的
距离最近且相等的 有
有_______ 个,相邻2个 的核间距为
的核间距为_______ pm。

(5)已知干冰是面心立方最密堆积,晶胞参数是apm,晶胞结构如图所示,试计算该晶体的密度是
_______  (列出计算式,设阿伏加德罗常数的值为
(列出计算式,设阿伏加德罗常数的值为 )。
)。

(1)拟卤素
 、
、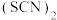 与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。
与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。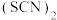 对应的酸有两种,测得硫氰酸
对应的酸有两种,测得硫氰酸 的沸点低于异硫氰酸
的沸点低于异硫氰酸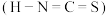 ,其原因是
,其原因是(2)
 可与
可与 互溶,从微观角度解释其原因为
互溶,从微观角度解释其原因为 属于多卤素阳离子,其空间构型为
属于多卤素阳离子,其空间构型为(3)卤素互化物如IBr、ICl等与卤素单质结构和性质相似。
 、IBr、ICl沸点由高到低的顺序为
、IBr、ICl沸点由高到低的顺序为(4)气态
 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图(a)所示,二聚体中Al的轨道杂化类型为
的形式存在,其空间结构如图(a)所示,二聚体中Al的轨道杂化类型为 的熔点为1090℃,远高于的192℃,由此可以判断铝氟之间的化学键为
的熔点为1090℃,远高于的192℃,由此可以判断铝氟之间的化学键为 结构属立方晶系,晶胞参数为apm,晶胞如图(b)所示。该晶体中与
结构属立方晶系,晶胞参数为apm,晶胞如图(b)所示。该晶体中与 距离最近且相等的
距离最近且相等的 有
有 的核间距为
的核间距为
(5)已知干冰是面心立方最密堆积,晶胞参数是apm,晶胞结构如图所示,试计算该晶体的密度是

 (列出计算式,设阿伏加德罗常数的值为
(列出计算式,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
2024-04-01更新
|
79次组卷
|
2卷引用:陕西省咸阳市武功县普集高级中学2023-2024学年高二下学期3月第一次月考化学试题
名校
8 . 元素F、Cl、Br、I位于周期表VIIA族。下列事实不能通过比较元素电负性解释的是
A. 键的键能小于 键的键能小于 键的键能 键的键能 |
| B.ClBr与水发生反应的产物是HCl和HBrO |
C. 属于离子化合物, 属于离子化合物, 属于共价化合物 属于共价化合物 |
D.气态氟化氢中存在 ,而气态氯化氢中是HCl分子 ,而气态氯化氢中是HCl分子 |
您最近一年使用:0次
2024-04-01更新
|
53次组卷
|
2卷引用:陕西省咸阳市武功县普集高级中学2023-2024学年高二下学期3月第一次月考化学试题
名校
9 . 下列物质性质的比较,与氢键无关的是
A.水溶性: |
B.熔点: |
C.沸点: |
D.与碱基 配对的能力: 配对的能力: |
您最近一年使用:0次
2024-04-01更新
|
59次组卷
|
2卷引用:陕西省咸阳市武功县普集高级中学2023-2024学年高二下学期3月第一次月考化学试题
解题方法
10 . 阿散酸(X6W8QYZ3)被用作畜禽饲料的抗菌剂,所含W、X、Y、Z、Q是核电荷数依次增大的前四周期主族元素,其中X、Y、Z同周期,Y、Q同主族,Q的最高能层为N层,基态X原子s轨道上的电子数是p轨道上的电子数2倍,且与基态Z原子具有相同的未成对电子数,下列说法不正确的是
| A.X、Y、Q的最高价氧化物对应水化物的酸性,Y的最强 |
| B.X、Y、Z第一电离能大小顺序为:Z>Y>X |
| C.X、Y、Z分别与W形成的化合物可能均含极性键和非极性键 |
| D.简单氢化物的沸点高低顺序为:Z>Y>X |
您最近一年使用:0次
2024-03-27更新
|
251次组卷
|
2卷引用:陕西省韩城市象山中学2023-2024学年高二下学期第一次月考化学试题



