名校
解题方法
1 .  及其化合物在生产生活方面都有重要的用途.回答下列问题:
及其化合物在生产生活方面都有重要的用途.回答下列问题:
(1)基态铁原子的核外电子排布式为:______ , 比
比 更稳定的原因是:
更稳定的原因是:______ 。
(2) 中铁元素的配位数是
中铁元素的配位数是______ , 中含有的
中含有的 键的数目为
键的数目为______ , 中C原子的杂化方式为
中C原子的杂化方式为______ 。
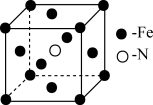
(3)铁和氨在 可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:
可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:______ 。
(4)血红素铁用作铁强化剂,其吸收率比一般铁剂高3倍,图中画出 与N原子间的化学键(若是配位键,需要用箭头加以表示)
与N原子间的化学键(若是配位键,需要用箭头加以表示)______ 。

 及其化合物在生产生活方面都有重要的用途.回答下列问题:
及其化合物在生产生活方面都有重要的用途.回答下列问题:(1)基态铁原子的核外电子排布式为:
 比
比 更稳定的原因是:
更稳定的原因是:(2)
 中铁元素的配位数是
中铁元素的配位数是 中含有的
中含有的 键的数目为
键的数目为 中C原子的杂化方式为
中C原子的杂化方式为(3)铁和氨在
 可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:
可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:
(4)血红素铁用作铁强化剂,其吸收率比一般铁剂高3倍,图中画出
 与N原子间的化学键(若是配位键,需要用箭头加以表示)
与N原子间的化学键(若是配位键,需要用箭头加以表示)
您最近一年使用:0次
解题方法
2 . 锰、铬、钴、铁的单质及其化合物在科研和生产中有着重要用途。回答下列问题:
(1)基态锰原子的价电子排布式为_______ 。
(2) 和
和 均为离子化合物,
均为离子化合物, 的熔点高于
的熔点高于 熔点的原因为
熔点的原因为_______ 。
(3)化学式为 的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色。在三种化合物中,
的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色。在三种化合物中, 的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量
的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量 溶液,所得
溶液,所得 沉淀的物质的量之比为3∶2∶1。
沉淀的物质的量之比为3∶2∶1。
①呈暗绿色的配合物,其内界的离子符号为_______ 。
② 分子的
分子的 模型为
模型为_______ 。
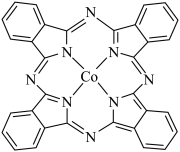
(4)如图为酞菁钴分子的平面结构,下列说法正确的是_______(填标号)。
(5)如图是一种由Y(与 同族)、Fe、Ba、O组成的晶体,晶胞棱上的球代表Ba,顶点的球代表Y,四方锥中心和八面体中心的球代表Fe,其余小球代表O。
同族)、Fe、Ba、O组成的晶体,晶胞棱上的球代表Ba,顶点的球代表Y,四方锥中心和八面体中心的球代表Fe,其余小球代表O。
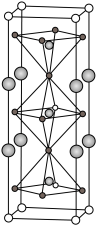
①该晶体的化学式为_______ 。
②其中Y的配位数为_______ 。
③在氧气气氛中该晶体可被部分氧化,氧原子进入晶格而使晶体呈现深紫色。新进入的氧原子在晶胞中的位置是_______ 。
(1)基态锰原子的价电子排布式为
(2)
 和
和 均为离子化合物,
均为离子化合物, 的熔点高于
的熔点高于 熔点的原因为
熔点的原因为(3)化学式为
 的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色。在三种化合物中,
的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色。在三种化合物中, 的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量
的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量 溶液,所得
溶液,所得 沉淀的物质的量之比为3∶2∶1。
沉淀的物质的量之比为3∶2∶1。①呈暗绿色的配合物,其内界的离子符号为
②
 分子的
分子的 模型为
模型为(4)如图为酞菁钴分子的平面结构,下列说法正确的是_______(填标号)。

A.电负性: | B.4个N原子均与 形成配位键 形成配位键 |
C.分子中N的杂化轨道类型均为 | D.第一电离能: |
 同族)、Fe、Ba、O组成的晶体,晶胞棱上的球代表Ba,顶点的球代表Y,四方锥中心和八面体中心的球代表Fe,其余小球代表O。
同族)、Fe、Ba、O组成的晶体,晶胞棱上的球代表Ba,顶点的球代表Y,四方锥中心和八面体中心的球代表Fe,其余小球代表O。
①该晶体的化学式为
②其中Y的配位数为
③在氧气气氛中该晶体可被部分氧化,氧原子进入晶格而使晶体呈现深紫色。新进入的氧原子在晶胞中的位置是
您最近一年使用:0次
名校
解题方法
3 . 氮及其化合物在工、农业生产中用途广泛。
(1)基态氮原子的核外电子排布式为_______ ;与N同周期的主族元素中,电负性大于N的有 _______ 种。
(2)NaN3在强烈撞击的情况下快速分解并产生大量氮气,可用于汽车安全气囊的制造。写出一种与N 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:_______ ,N 的空间构型为
的空间构型为 _______ 。
(3)据报道,美国科学家卡尔•克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是_______ 。
(4)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。

①分子中的大π键可用符号Π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π ),已知N
),已知N 为平面结构且含有大π键,则N
为平面结构且含有大π键,则N 中的大π键应表示为
中的大π键应表示为 _______ 。
②图中虚线代表氢键,其表示式为(NH )N﹣H•••Cl、
)N﹣H•••Cl、_______ 、_______ 。
(5)氮化硼(BN)和碳一样可以形成像石墨那样的平面六角形的层状结构,如图1所示,其中B原子的杂化方式为_______ 。该氮化硼晶体具有良好的润滑性,其原因是 _______ 。
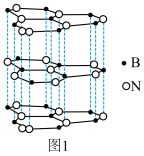
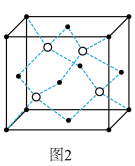
(6)一定条件下,层型BN可转变为立方氮化硼,其晶胞结构如图2所示。一个晶胞中所含B原子的数目为_______ ;已知晶体的密度为dg•cm﹣3,NA为阿伏加德罗常数的值,则晶胞边长为 _______ pm(用含d、NA的代数式表示)。
(1)基态氮原子的核外电子排布式为
(2)NaN3在强烈撞击的情况下快速分解并产生大量氮气,可用于汽车安全气囊的制造。写出一种与N
 互为等电子体的分子的化学式:
互为等电子体的分子的化学式: 的空间构型为
的空间构型为 (3)据报道,美国科学家卡尔•克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是
(4)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。

①分子中的大π键可用符号Π
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π ),已知N
),已知N 为平面结构且含有大π键,则N
为平面结构且含有大π键,则N 中的大π键应表示为
中的大π键应表示为 ②图中虚线代表氢键,其表示式为(NH
 )N﹣H•••Cl、
)N﹣H•••Cl、(5)氮化硼(BN)和碳一样可以形成像石墨那样的平面六角形的层状结构,如图1所示,其中B原子的杂化方式为

(6)一定条件下,层型BN可转变为立方氮化硼,其晶胞结构如图2所示。一个晶胞中所含B原子的数目为

您最近一年使用:0次
解题方法
4 . 镍及其化合物在工业生产和科研领域有着重要的用途。回答下列问题:
(1)基态 原子价层电子的电子排布图(轨道表达式)为
原子价层电子的电子排布图(轨道表达式)为___________ 。
(2)醋酸镍晶体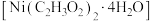 在电镀中有广泛应用,其中
在电镀中有广泛应用,其中 中O原子的杂化轨道类型为
中O原子的杂化轨道类型为___________ ,若该晶胞构型为四方双锥,则中心 原子的配位数为
原子的配位数为___________ 。
(3)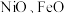 的晶体结构类型均与氯化钠的相同,已知熔点:
的晶体结构类型均与氯化钠的相同,已知熔点: ,则离子半径:
,则离子半径: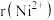
___________ (填“<”或“>”)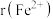 ;天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为
;天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为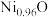 ,其中
,其中 元素只有
元素只有 和
和 两种价态,
两种价态, 与
与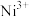 的数目之比为
的数目之比为___________ 。
(4)四羰基镍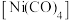 是由路德维希·蒙德所发现。
是由路德维希·蒙德所发现。 作配体时配位原子是C而不是O,其原因是
作配体时配位原子是C而不是O,其原因是___________ ; 分子内
分子内 键与
键与 键个数之比为
键个数之比为___________ 。
(5)金属镍与镧( )形成的合金是一种良好的储氢材料,其晶胞结构如图所示。若阿伏加德罗常数的值为
)形成的合金是一种良好的储氢材料,其晶胞结构如图所示。若阿伏加德罗常数的值为 ,晶胞棱长为
,晶胞棱长为 ,则该晶体的密度为
,则该晶体的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。

(1)基态
 原子价层电子的电子排布图(轨道表达式)为
原子价层电子的电子排布图(轨道表达式)为(2)醋酸镍晶体
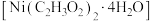 在电镀中有广泛应用,其中
在电镀中有广泛应用,其中 中O原子的杂化轨道类型为
中O原子的杂化轨道类型为 原子的配位数为
原子的配位数为(3)
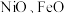 的晶体结构类型均与氯化钠的相同,已知熔点:
的晶体结构类型均与氯化钠的相同,已知熔点: ,则离子半径:
,则离子半径: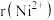
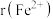 ;天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为
;天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为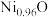 ,其中
,其中 元素只有
元素只有 和
和 两种价态,
两种价态, 与
与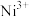 的数目之比为
的数目之比为(4)四羰基镍
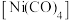 是由路德维希·蒙德所发现。
是由路德维希·蒙德所发现。 作配体时配位原子是C而不是O,其原因是
作配体时配位原子是C而不是O,其原因是 分子内
分子内 键与
键与 键个数之比为
键个数之比为(5)金属镍与镧(
 )形成的合金是一种良好的储氢材料,其晶胞结构如图所示。若阿伏加德罗常数的值为
)形成的合金是一种良好的储氢材料,其晶胞结构如图所示。若阿伏加德罗常数的值为 ,晶胞棱长为
,晶胞棱长为 ,则该晶体的密度为
,则该晶体的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
5 . 第VIII族元素(Fe、Co、Ni等)在生产、生活中用途广泛。回答下列问题:
(1)第四周期基态原子与基态Ni3+未成对电子数相同的元素有_______ 种。
(2)邻二氮菲(phen,结构如图)能通过N原子与Fe2+形成稳定的配合物[Fe(phen)3]2+,该配合物的特征颜色可用于测定Fe2+的浓度。[Fe(phen)3]2+中Fe2+的配位数为_______ ;实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,其原因是_______ 。

(3)草酸亚铁是生产磷酸铁锂动力电池的原料,可由草酸与硫酸亚铁铵反应制得。草酸与甲酸酸性相对强弱:草酸_______ 甲酸(填“>”“<”或“=”),其原因是_______ 。
(4)Fe3O4晶胞具有反尖晶石结构,氧离子和不同价态铁离子构成A、B两种结构,如图所示,其晶胞可以看作是由4个A型和4个B型小单元交替并置而成。

①Fe3+填充在O2-围成的_______ 空隙处(填“正四面体”或“正八面体”)。
②纳米材料的量子尺寸效应可以显著改变材料电磁性能,材料表面原子(或离子)占总原子(或离子)数的比例是重要的影响因素。假设某Fe3O4纳米颗粒恰好是一个Fe3O4晶胞,该颗粒表面离子与总离子数的最简整数比为_______ 。
(1)第四周期基态原子与基态Ni3+未成对电子数相同的元素有
(2)邻二氮菲(phen,结构如图)能通过N原子与Fe2+形成稳定的配合物[Fe(phen)3]2+,该配合物的特征颜色可用于测定Fe2+的浓度。[Fe(phen)3]2+中Fe2+的配位数为

(3)草酸亚铁是生产磷酸铁锂动力电池的原料,可由草酸与硫酸亚铁铵反应制得。草酸与甲酸酸性相对强弱:草酸
(4)Fe3O4晶胞具有反尖晶石结构,氧离子和不同价态铁离子构成A、B两种结构,如图所示,其晶胞可以看作是由4个A型和4个B型小单元交替并置而成。

①Fe3+填充在O2-围成的
②纳米材料的量子尺寸效应可以显著改变材料电磁性能,材料表面原子(或离子)占总原子(或离子)数的比例是重要的影响因素。假设某Fe3O4纳米颗粒恰好是一个Fe3O4晶胞,该颗粒表面离子与总离子数的最简整数比为
您最近一年使用:0次
名校
解题方法
6 . 铜及其化合物在科学研究和工业生产中具有许多用途,请回答下列问题:
(1)写出基态Cu原子的价电子排布式_______ 。
(2)已知高温下 比CuO稳定,从核外电子排布角度解释高温下
比CuO稳定,从核外电子排布角度解释高温下 更稳定的原因
更稳定的原因_______ 。
(3)配合物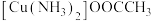 中碳原子的杂化类型是
中碳原子的杂化类型是_______ ,配体的空间构型为_______ 。配合物所含元素的电负性由大到小的顺序是_______ (用元素符号表示)。
(4)M原子的价电子排布式为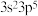 ,铜与M形成化合物的晶胞如图所示。
,铜与M形成化合物的晶胞如图所示。
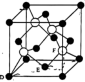
①原子坐标参数,表示晶胞内部各原子的相对位置。上图晶胞中,其中原子坐标参数D为(0,0,0),E为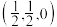 ,则F原子的坐标参数为
,则F原子的坐标参数为_______ 。
②已知该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体中Cu原子和M原子之间的最短距离为
,则该晶体中Cu原子和M原子之间的最短距离为_______ pm(写出计算式)。
(1)写出基态Cu原子的价电子排布式
(2)已知高温下
 比CuO稳定,从核外电子排布角度解释高温下
比CuO稳定,从核外电子排布角度解释高温下 更稳定的原因
更稳定的原因(3)配合物
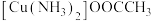 中碳原子的杂化类型是
中碳原子的杂化类型是(4)M原子的价电子排布式为
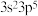 ,铜与M形成化合物的晶胞如图所示。
,铜与M形成化合物的晶胞如图所示。
①原子坐标参数,表示晶胞内部各原子的相对位置。上图晶胞中,其中原子坐标参数D为(0,0,0),E为
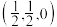 ,则F原子的坐标参数为
,则F原子的坐标参数为②已知该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体中Cu原子和M原子之间的最短距离为
,则该晶体中Cu原子和M原子之间的最短距离为
您最近一年使用:0次
2022-10-12更新
|
459次组卷
|
4卷引用:辽宁省实验中学2023届高三上学期第一次阶段测试化学试题
解题方法
7 . 碳是地球上组成生命的最基本元素之一 ,不仅能形成丰富多彩的有机化合物,还能形成多种无机化合物,碳及其化合物的用途广泛。根据要求回答下列问题:
(1)在基态14C原子中,核外存在_______ 对自旋相反的电子;第二周期的元素中,第一电离能介于B和C之间的是_______ (写 元素符号)。
(2)下图中分别代表了碳单质的两种常见晶体,图1晶体中C原子的杂化方式为_______ ,图2晶体中,每个六元环占有_______ 个C原子。
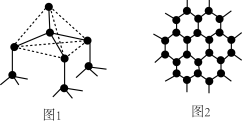
(3)碳可以形成多种有机化合物,如图3所示是一种吡咯的结构,分子中所有原子都在一个平面上。吡咯中所有元素的电负性由大到小的顺序为_______ 。
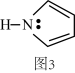
(4)碳可形成CO、CO2等多种无机化合物,在CO转化成CO2的反应过程中,下列说法正确的是_______。
(5)中外科学家团队共同合成了碳的一种新型同素异形体: T- 碳。T-碳的结构是:将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,形成碳的一种新型三维立方晶体结构(如图4)。已知T-碳晶胞参数为apm,阿伏加德罗常数为NA,则T-碳的密度为_______ g· cm -3(列出计算式)。

(1)在基态14C原子中,核外存在
(2)下图中分别代表了碳单质的两种常见晶体,图1晶体中C原子的杂化方式为

(3)碳可以形成多种有机化合物,如图3所示是一种吡咯的结构,分子中所有原子都在一个平面上。吡咯中所有元素的电负性由大到小的顺序为

(4)碳可形成CO、CO2等多种无机化合物,在CO转化成CO2的反应过程中,下列说法正确的是_______。
| A.分子极性发生变化 | B.分子中孤对电子数不变 |
| C.原子间成键方式改变 | D.分子的熔沸点升高 |

您最近一年使用:0次
解题方法
8 . 在元素周期表中,铜副族(IB族)包括铜、银、金等元素,在生产、生活和科研中都有着广泛用途和重要的研究价值。
(1)Ag元素在元素周期表分区中属于_______ 区,基态Ag原子的价电子排布式为_______ 。
(2)硫代硫酸银(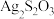 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成 等络阴离子。
等络阴离子。
①依据 理论推测
理论推测 的空间构型为
的空间构型为_______ ,中心原子S的杂化方式为_______ 。
②在 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是_______ 。
(3)碘化银常用于做人工增雨剂。其中碘元素形成的最高价氧化物对应水化物有 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性
_______  (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是_______ 。
(4)在离子晶体中,当 (阳离子)∶r(阴离子)
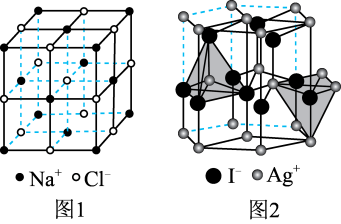
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为_______ ,造成AgI晶体结构不同于NaCl晶体结构的原因不可能是_______ (填标号)。
a.几何因素 b.电荷因素 c.键性因素
(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______ ;若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______ (储氢能力 )
)
(1)Ag元素在元素周期表分区中属于
(2)硫代硫酸银(
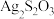 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成 等络阴离子。
等络阴离子。①依据
 理论推测
理论推测 的空间构型为
的空间构型为②在
 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是(3)碘化银常用于做人工增雨剂。其中碘元素形成的最高价氧化物对应水化物有
 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性
 (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是(4)在离子晶体中,当
 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为a.几何因素 b.电荷因素 c.键性因素

(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为
 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为 )
)
您最近一年使用:0次
2022-04-25更新
|
1258次组卷
|
4卷引用:内蒙古包头市2022届高三第二次模拟考试理综试卷化学试题
内蒙古包头市2022届高三第二次模拟考试理综试卷化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)【直抵名校】01-备战2022年高考化学名校进阶模拟卷(通用版)河南省南阳市2021-2022学年高二下学期期末考试化学试题
解题方法
9 . 过渡元素 等在生产、生活和科研中都有着广泛用途和重要的研究价值。回答下列问题:
等在生产、生活和科研中都有着广泛用途和重要的研究价值。回答下列问题:
(1)基态Co原子中,核外电子占据的最高能层符号为_______ ;基态 的价电子排布式为
的价电子排布式为_______ 。
(2)Ag元素在元素周期表中与Cu处于相邻周期,则Ag元素在元素周期表分区中属于_______ 区。
(3)① 有顺式和反式两种结构,则
有顺式和反式两种结构,则 分子的空间构型为
分子的空间构型为_______ (填“平面四方”或“正四面体”)形,其中心原子杂化方式推断合理的是_______ (填标号)。
A.sp B. C.
C. D.
D.
②电子亲和能反映的是元素的气态原子结合电子的难易程度。N、Cl的第一电子亲和能:N_______ Cl(填“>”或“<”)。
(4) 熔点为
熔点为 ,
, 熔点为
熔点为 ,
, 熔点更高的原因是
熔点更高的原因是_______ 。
(5)一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(x、y方向的夹角为 ,z方向垂直于x、y方向,底面棱长均为anm,侧面棱长为cnm),其晶胞结构如图甲所示;晶胞中碳原子的投影位置如图乙所示。
,z方向垂直于x、y方向,底面棱长均为anm,侧面棱长为cnm),其晶胞结构如图甲所示;晶胞中碳原子的投影位置如图乙所示。
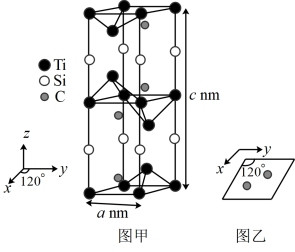
①该钛硅碳新型材料的化学式为_______ 。
②已知该新型材料的摩尔质量为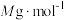 ,密度为
,密度为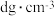 ,阿伏加德罗常数的值用
,阿伏加德罗常数的值用 表示,则c的长度为
表示,则c的长度为_______ nm(用含a、b、 的计算式表示)。
的计算式表示)。
 等在生产、生活和科研中都有着广泛用途和重要的研究价值。回答下列问题:
等在生产、生活和科研中都有着广泛用途和重要的研究价值。回答下列问题:(1)基态Co原子中,核外电子占据的最高能层符号为
 的价电子排布式为
的价电子排布式为(2)Ag元素在元素周期表中与Cu处于相邻周期,则Ag元素在元素周期表分区中属于
(3)①
 有顺式和反式两种结构,则
有顺式和反式两种结构,则 分子的空间构型为
分子的空间构型为A.sp B.
 C.
C. D.
D.
②电子亲和能反映的是元素的气态原子结合电子的难易程度。N、Cl的第一电子亲和能:N
(4)
 熔点为
熔点为 ,
, 熔点为
熔点为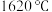 ,
, 熔点更高的原因是
熔点更高的原因是(5)一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(x、y方向的夹角为
 ,z方向垂直于x、y方向,底面棱长均为anm,侧面棱长为cnm),其晶胞结构如图甲所示;晶胞中碳原子的投影位置如图乙所示。
,z方向垂直于x、y方向,底面棱长均为anm,侧面棱长为cnm),其晶胞结构如图甲所示;晶胞中碳原子的投影位置如图乙所示。
①该钛硅碳新型材料的化学式为
②已知该新型材料的摩尔质量为
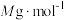 ,密度为
,密度为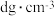 ,阿伏加德罗常数的值用
,阿伏加德罗常数的值用 表示,则c的长度为
表示,则c的长度为 的计算式表示)。
的计算式表示)。
您最近一年使用:0次
解题方法
10 . 钛及其化合物在生产、生活中有着广泛的用途。回答下列问题:
(1)Ti(BH4)3是一种储氢材料。BH 的空间构型为
的空间构型为_______ ;Ti 、B、H元素的电负性由大到小排列顺序为_______ 。
(2)已知Ti3+易形成多种配合物,[TiCl( H2O)5]Cl2· H2O是其中的一种。
①1 mol该配合物中含有_______ molσ键。
②中心离子杂化方式为_______ (填标号)。
a.sp2 b.sp3 c.sp3d d.sp3d2
③Ti3+具有较强还原性的原因是_______ 。
(3)研究表明,TiO2通过氮掺杂反应可生成TiO2-x Ny,能使TiO2对可见光具有活性,反应如图所示。

①上图TiO2晶胞中钛原子占据_______ 个氧原子围成的八面体空隙。
②已知所有的Ti-O键键长为rpm,B点原子的分数坐标为( ,
, ,
, ),则A点原子的分数坐标为
),则A点原子的分数坐标为_______ ;晶胞中A、B间距离为_______ pm;TiO2晶体密度为_______ g·cm-3(设NA为阿伏加德罗常数的值)。
③TiO2-x Ny晶体中x=_______ 。
(1)Ti(BH4)3是一种储氢材料。BH
 的空间构型为
的空间构型为(2)已知Ti3+易形成多种配合物,[TiCl( H2O)5]Cl2· H2O是其中的一种。
①1 mol该配合物中含有
②中心离子杂化方式为
a.sp2 b.sp3 c.sp3d d.sp3d2
③Ti3+具有较强还原性的原因是
(3)研究表明,TiO2通过氮掺杂反应可生成TiO2-x Ny,能使TiO2对可见光具有活性,反应如图所示。

①上图TiO2晶胞中钛原子占据
②已知所有的Ti-O键键长为rpm,B点原子的分数坐标为(
 ,
, ,
, ),则A点原子的分数坐标为
),则A点原子的分数坐标为③TiO2-x Ny晶体中x=
您最近一年使用:0次



