名校
1 . 下列有关物质性质与应用的对应关系正确的是
| 选项 | 性质 | 实际应用 |
| A | 小苏打不稳定,受热分解生成CO2 | 用于泡沫灭火器 |
| B | 聚乙炔是无限延伸的线状结构 | 用于导电材料 |
| C | Al(OH)3受热分解,生成高熔点物质和水 | 用作塑料的阻燃剂 |
| D | 石墨是混合型晶体,含大π键 | 用作润滑剂 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-22更新
|
1373次组卷
|
7卷引用:山东省济南市2022届高三3月高考模拟考试(一模)化学试题
山东省济南市2022届高三3月高考模拟考试(一模)化学试题(已下线)秘籍02 化学与STSE-备战2022年高考化学抢分秘籍(全国通用)湖北省随州市曾都区第一中学2022届高三下学期第二次学业水平选择性模拟考试化学试题(已下线)专项06 元素及其化合物-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)专题05 元素及其化合物-三年(2020-2022)高考真题分项汇编河北省五个一联盟2022-2023学年高三上学期12月联考化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题1-5)
2 . I.次磷酸( )是一种精细化工产品。
)是一种精细化工产品。
(1) 溶液中的含磷微粒只有
溶液中的含磷微粒只有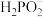 和
和 ,则该溶液呈
,则该溶液呈_______ 性(填“酸”“碱”或“中”)。
(2)25℃时, 溶液和盐酸的物质的量浓度相同。加水稀释至相同的pH,此时加入
溶液和盐酸的物质的量浓度相同。加水稀释至相同的pH,此时加入 溶液中水的体积
溶液中水的体积_______ (填“大于”“小于”或“等于”)加入盐酸中水的体积。
II.
(3)硅元素可形成多种晶体。
①硅与氯、溴结合能形成 、
、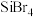 ,沸点较高的是
,沸点较高的是_______ 。
②晶体Si和晶体SiC结构相似,熔点较低的是_______ 。
(4)某化合物具有超导性,其晶胞结构如图所示,则该化合物的化学式为_______ ,1个Mg与_______ 个Ni等距离且最近。

III.为了达到碳中和,研发二氧化碳、烃类等物质的利用技术已成为科研热点。
(5)



则

_______ (用 、
、 表示)。
表示)。
(6)已知反应:
 。将1molCO和2mol
。将1molCO和2mol 充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
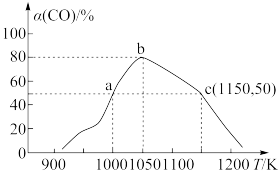
①试求温度为1000K条件下,反应开始至2min时,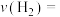
_______ 。
②已知c点时容器内的压强为p,则在1150K温度下该反应的压强平衡常数 为
为_______ ( 是用各气体物质的分压替代浓度来计算的平衡常数)。
是用各气体物质的分压替代浓度来计算的平衡常数)。
 )是一种精细化工产品。
)是一种精细化工产品。(1)
 溶液中的含磷微粒只有
溶液中的含磷微粒只有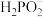 和
和 ,则该溶液呈
,则该溶液呈(2)25℃时,
 溶液和盐酸的物质的量浓度相同。加水稀释至相同的pH,此时加入
溶液和盐酸的物质的量浓度相同。加水稀释至相同的pH,此时加入 溶液中水的体积
溶液中水的体积II.
(3)硅元素可形成多种晶体。
①硅与氯、溴结合能形成
 、
、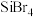 ,沸点较高的是
,沸点较高的是②晶体Si和晶体SiC结构相似,熔点较低的是
(4)某化合物具有超导性,其晶胞结构如图所示,则该化合物的化学式为

III.为了达到碳中和,研发二氧化碳、烃类等物质的利用技术已成为科研热点。
(5)




则


 、
、 表示)。
表示)。(6)已知反应:

 。将1molCO和2mol
。将1molCO和2mol 充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
①试求温度为1000K条件下,反应开始至2min时,
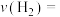
②已知c点时容器内的压强为p,则在1150K温度下该反应的压强平衡常数
 为
为 是用各气体物质的分压替代浓度来计算的平衡常数)。
是用各气体物质的分压替代浓度来计算的平衡常数)。
您最近一年使用:0次
解题方法
3 . 科幻电影《阿凡达》中外星人流的是蓝色的血液,其实血液的颜色主要是由血蛋白中含有的金属元素决定的,如含铁元素的为常见红色血液、含铜元素的为蓝色血液、含钒元素的为绿色血液等,铜、铁、钒在科学研究和工农业生产中有许多用途。回答下列问题:
(1)基态V的核外电子排布式为_______ 。
(2) 溶液常用作农业杀菌剂,溶液中存在
溶液常用作农业杀菌剂,溶液中存在 。该离子中存在的化学键有
。该离子中存在的化学键有_______ (填字母)。
A.共价键 B.离子键 C.氢键 D.范德华力 E.配位键
(3) 与氨基吡啶形成的配合物(结构如图1)是很好的磁性材料。该配合物分子中碳与氧原子间形成的
与氨基吡啶形成的配合物(结构如图1)是很好的磁性材料。该配合物分子中碳与氧原子间形成的 键和π键的个数比为
键和π键的个数比为_______ ,其中C原子的杂化轨道类型为_______ 。

(4)铜的氧化物、氮化物都广泛应用于光信息存储和高速集成电路领域。
①Cu、O、N的电负性由大到小的顺序为_______ 。
②已知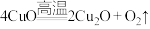 ,从铜离子的价层电子结构角度分析,高温下能转化生成
,从铜离子的价层电子结构角度分析,高温下能转化生成 的主要原因是
的主要原因是_______ 。
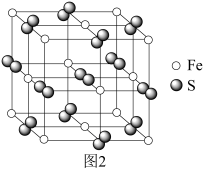
(5)铁与硫能形成多种化合物,某种化合物的晶胞结构如图2所示。该化合物的化学式是_______ ;若该晶胞边长为 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为_______  。
。
(1)基态V的核外电子排布式为
(2)
 溶液常用作农业杀菌剂,溶液中存在
溶液常用作农业杀菌剂,溶液中存在 。该离子中存在的化学键有
。该离子中存在的化学键有A.共价键 B.离子键 C.氢键 D.范德华力 E.配位键
(3)
 与氨基吡啶形成的配合物(结构如图1)是很好的磁性材料。该配合物分子中碳与氧原子间形成的
与氨基吡啶形成的配合物(结构如图1)是很好的磁性材料。该配合物分子中碳与氧原子间形成的 键和π键的个数比为
键和π键的个数比为
(4)铜的氧化物、氮化物都广泛应用于光信息存储和高速集成电路领域。
①Cu、O、N的电负性由大到小的顺序为
②已知
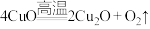 ,从铜离子的价层电子结构角度分析,高温下能转化生成
,从铜离子的价层电子结构角度分析,高温下能转化生成 的主要原因是
的主要原因是(5)铁与硫能形成多种化合物,某种化合物的晶胞结构如图2所示。该化合物的化学式是
 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 。
。
您最近一年使用:0次
4 . 硼及其化合物在新材料、工农业生产等方面用途、广泛。
(1)写出基态B原子的轨道表达式___________ 。
(2)已知:硼酸的电离方程式可表示为H3BO3+H2O⇌[B(OH)4]-+H+。
①根据以上信息,下列说法正确的是_________ 。(填序号)
a.硼酸是一元酸
b.硼酸在电离的过程中,B原子的杂化类型发生了变化
c.硼酸与过量NaOH反应,能观察到白色沉淀逐渐消失
②从化学键的角度表述由H3BO3,形成[B(OH)4]-的过程__________ 。
(3)B与N可以形成不同类型的晶体,如六方氮化硼、立方氮化硼等,其结构如图。
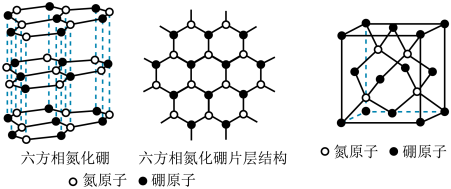
①六方氮化硼的晶体结构类似石墨,每一个B或N的杂化类型是__________ 。
②立方氮化硼因其硬度高、耐磨性好,在机械加工行业广泛用作切削工具。立方氮化硼可在高温高压的条件下由六方氮化硼转化而成。如图,立方氮化硼的晶体类型为___________ ,立方氮化硼的密度为dg⋅cm-3,阿伏加德罗常数为NA,B与N的相对原子质量分别为m和n,则立方晶胞边长a=______________ cm。

(1)写出基态B原子的轨道表达式
(2)已知:硼酸的电离方程式可表示为H3BO3+H2O⇌[B(OH)4]-+H+。
①根据以上信息,下列说法正确的是
a.硼酸是一元酸
b.硼酸在电离的过程中,B原子的杂化类型发生了变化
c.硼酸与过量NaOH反应,能观察到白色沉淀逐渐消失
②从化学键的角度表述由H3BO3,形成[B(OH)4]-的过程
(3)B与N可以形成不同类型的晶体,如六方氮化硼、立方氮化硼等,其结构如图。

①六方氮化硼的晶体结构类似石墨,每一个B或N的杂化类型是
②立方氮化硼因其硬度高、耐磨性好,在机械加工行业广泛用作切削工具。立方氮化硼可在高温高压的条件下由六方氮化硼转化而成。如图,立方氮化硼的晶体类型为
您最近一年使用:0次
解题方法
5 . 硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
(1) 的立体构型是
的立体构型是___________
(2) 为一元酸,与足量NaOH溶液反应得到
为一元酸,与足量NaOH溶液反应得到 ,
, 和
和 中B的杂化轨道类型分别为
中B的杂化轨道类型分别为___________ 、___________ 。
(3) 被认为是有机化学上的“万能还原剂”,
被认为是有机化学上的“万能还原剂”, 的电子式为
的电子式为___________ ,其中三种元素的电负性由大到小的顺序是___________ 。
(4)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作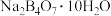 ,实际上它的结构单元是由两个
,实际上它的结构单元是由两个 和两个
和两个 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成 ,其结构如图1所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
,其结构如图1所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是___________ (填选项字母)。
A.离子键 B.共价键 C.金属键
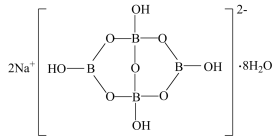
(5)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为 ,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中的位置如图2所示,其堆积方式为
,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中的位置如图2所示,其堆积方式为___________ , 占据阴离子组成的所有最小正四面体中心,该化合物的化学式为
占据阴离子组成的所有最小正四面体中心,该化合物的化学式为___________ (用最简整数比表示)。假设晶胞边长为a pm,用 代表阿伏加德罗常数的值,则该晶胞的密度为
代表阿伏加德罗常数的值,则该晶胞的密度为___________  (用含a,
(用含a, 的代数式表示)
的代数式表示)
(1)
 的立体构型是
的立体构型是(2)
 为一元酸,与足量NaOH溶液反应得到
为一元酸,与足量NaOH溶液反应得到 ,
, 和
和 中B的杂化轨道类型分别为
中B的杂化轨道类型分别为(3)
 被认为是有机化学上的“万能还原剂”,
被认为是有机化学上的“万能还原剂”, 的电子式为
的电子式为(4)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作
 ,实际上它的结构单元是由两个
,实际上它的结构单元是由两个 和两个
和两个 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成 ,其结构如图1所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
,其结构如图1所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是A.离子键 B.共价键 C.金属键

(5)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为
 ,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中的位置如图2所示,其堆积方式为
,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中的位置如图2所示,其堆积方式为 占据阴离子组成的所有最小正四面体中心,该化合物的化学式为
占据阴离子组成的所有最小正四面体中心,该化合物的化学式为 代表阿伏加德罗常数的值,则该晶胞的密度为
代表阿伏加德罗常数的值,则该晶胞的密度为 (用含a,
(用含a, 的代数式表示)
的代数式表示)
您最近一年使用:0次
6 . 铌是汽车和飞机制造业特别重要的材料,具有良好的耐腐蚀、冷热加工等性能,以高钛渣(含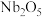 、
、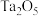 、
、 、CaO)为原料制取单质的流程如图甲所示:
、CaO)为原料制取单质的流程如图甲所示:


已知:①MIBK为甲基异丁基酮;②钽铌液中含有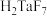 、
、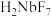 均为弱酸;③
均为弱酸;③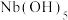 难溶于水。
难溶于水。
(1)酸溶时,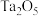 发生的反应的离子方程式为
发生的反应的离子方程式为_______ 。
(2)酸溶时,HF的浓度对铌、钽的浸出率的影响如图丙所示,则HF的最佳浓度为_______  。
。
(3)沉铌时,发生的反应的化学方程式为_______ 。
(4)电解制备铌的原理如图乙所示,阴极发生的电极反应为_______ 。
(5)铌(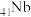 )和镍合金的用途非常广泛,Nb、Ni互化物的晶胞结构如图所示:
)和镍合金的用途非常广泛,Nb、Ni互化物的晶胞结构如图所示:

①铌元素位于周期表中的位置是_______ 。
②图中Nb原子与Ni原子的最短距离为_______ nm。
③Nb、Ni互化物晶体的密度为_______ 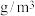 (列出计算式)。
(列出计算式)。
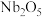 、
、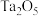 、
、 、CaO)为原料制取单质的流程如图甲所示:
、CaO)为原料制取单质的流程如图甲所示:

已知:①MIBK为甲基异丁基酮;②钽铌液中含有
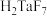 、
、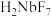 均为弱酸;③
均为弱酸;③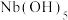 难溶于水。
难溶于水。(1)酸溶时,
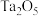 发生的反应的离子方程式为
发生的反应的离子方程式为(2)酸溶时,HF的浓度对铌、钽的浸出率的影响如图丙所示,则HF的最佳浓度为
 。
。(3)沉铌时,发生的反应的化学方程式为
(4)电解制备铌的原理如图乙所示,阴极发生的电极反应为
(5)铌(
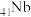 )和镍合金的用途非常广泛,Nb、Ni互化物的晶胞结构如图所示:
)和镍合金的用途非常广泛,Nb、Ni互化物的晶胞结构如图所示:
①铌元素位于周期表中的位置是
②图中Nb原子与Ni原子的最短距离为
③Nb、Ni互化物晶体的密度为
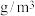 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
解题方法
7 . 钛是一种稀有金属,具有密度小、强度高、耐腐蚀等特点,钛和钛的化合物在航天、化工、建筑、日常生活中都有着广泛的用途。已知:阿伏加德罗常数的值为NA。
(1)基态钛原子价电子排布式为_______ ;与钛同周期的元素中,基态原子的未成对电子数与钛相同的还有_______ 种。
(2)钛的一种常见化合物是[Ti(H2O)6]Cl3,1mol该物质中含有σ键的数目为_______ ,配体H2O的VSEPR模型名称是_______ ,其沸点高于H2S,原因是_______ 。
(3)TO2与光气(COCl2)、氯化亚砜(SOCl2)等反应可以制得TiCl4,用于制造虹彩剂、烟雾、颜料等。
①氯化亚砜中心原子的杂化方式为_______ 杂化;
②光气是_______ 分子(填“极性”或“非极性”)。
(4)铁与钛同周期,某离子型铁氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为_______ 。已知该晶体的晶胞参数为a pm,阿伏加德罗常数的值为NA,则该晶体的密度d=_______  (用含a和NA的代数式表示)。
(用含a和NA的代数式表示)。

(1)基态钛原子价电子排布式为
(2)钛的一种常见化合物是[Ti(H2O)6]Cl3,1mol该物质中含有σ键的数目为
(3)TO2与光气(COCl2)、氯化亚砜(SOCl2)等反应可以制得TiCl4,用于制造虹彩剂、烟雾、颜料等。
①氯化亚砜中心原子的杂化方式为
②光气是
(4)铁与钛同周期,某离子型铁氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为
 (用含a和NA的代数式表示)。
(用含a和NA的代数式表示)。
您最近一年使用:0次
名校
8 . A、B、C、D、E是原子序数依次增大的五种常见的短周期主族元素,其中A、B、C、D四种元素的原子序数之和为E元素原子序数的2倍。E是短周期中原子半径最大的元素。A、B、C、D四种元素形成的化合物 有多种用途,可用来合成纳米管,还可作杀虫剂、催化剂、助熔剂、阻燃剂等,其结构如图所示。下列说法错误的是
有多种用途,可用来合成纳米管,还可作杀虫剂、催化剂、助熔剂、阻燃剂等,其结构如图所示。下列说法错误的是

 有多种用途,可用来合成纳米管,还可作杀虫剂、催化剂、助熔剂、阻燃剂等,其结构如图所示。下列说法错误的是
有多种用途,可用来合成纳米管,还可作杀虫剂、催化剂、助熔剂、阻燃剂等,其结构如图所示。下列说法错误的是
| A.第一电离能:D>C>B |
| B.离子半径:C>D>E |
| C.元素B、D形成的最简化合物为非极性分子 |
D.化合物 中各原子均满足8电子稳定结构 中各原子均满足8电子稳定结构 |
您最近一年使用:0次
2022-11-19更新
|
405次组卷
|
3卷引用:湖北省荆荆宜三校2022-2023学年高三上学期11月联考化学试题
9 . 科学研究表明,物质含有许多种聚集状态,下列关于物质聚集状态的描述错误的是
| A.等离子体的用途之一是可以制造等离子体显示器 |
| B.超分子具有分子识别与自组装的特征 |
| C.液晶和液态是物质的同一种聚集状态 |
| D.同一种金属元素构成的纳米材料的某些性质具有很大的差异 |
您最近一年使用:0次
2023-06-24更新
|
107次组卷
|
3卷引用:广东省广州市第六中学2021-2022学年高二下学期期中测试化学试题
名校
解题方法
10 . Fe、Ni均为Ⅷ族元素,与C、N、O、P等组成的化合物有广泛的用途。回答下列问题:
(1)基态 的价层电子轨道表达式为
的价层电子轨道表达式为_______ ,C、N、O的第一电离能从小到大的顺序为_______ 。
(2)N、P可形成一些复杂离子,如 、
、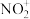 、
、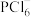 等。
等。 中N原子的杂化类型为
中N原子的杂化类型为_______ , 的空间构型为
的空间构型为_______ 。
(3)Fe、Ni易与CO形成配合物,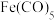 中σ键与π键个数比为
中σ键与π键个数比为_______ , 熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂,
熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂, 为
为_______ 晶体。
(4)FeO、NiO的晶体类型与结构和NaCl相同。
①熔点FeO_______ NiO(填“>”、“<”或“=”)。
②FeO晶胞如图, 的配位数为
的配位数为_______ 。

(1)基态
 的价层电子轨道表达式为
的价层电子轨道表达式为(2)N、P可形成一些复杂离子,如
 、
、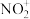 、
、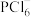 等。
等。 中N原子的杂化类型为
中N原子的杂化类型为 的空间构型为
的空间构型为(3)Fe、Ni易与CO形成配合物,
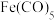 中σ键与π键个数比为
中σ键与π键个数比为 熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂,
熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂, 为
为(4)FeO、NiO的晶体类型与结构和NaCl相同。
①熔点FeO
②FeO晶胞如图,
 的配位数为
的配位数为
您最近一年使用:0次



