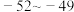名校
1 . 实现废钨-镍型加氢催化剂(主要成分为 、Ni、
、Ni、 ,还含有Fe、
,还含有Fe、 和少量含S有机物)中有价值金属回收的工艺流程如下。
和少量含S有机物)中有价值金属回收的工艺流程如下。
(1)基态Ni的价层电子排布式为______________ 。
(2) “氧化”的目的为______________________ 和将金属单质氧化至相应的价态。
(3)“钠化焙烧”中生成 的化学方程式为
的化学方程式为_____________ 。
(4)“酸化沉钨”后过滤,所得滤饼的主要成分为_______________ (填化学式)。
(5)“调pH”除铁和铝,溶液的pH范围应调节为____________ 。
(6)资料显示,硫酸镍结晶水合物的形态与温度有如表关系。
“一系列操作”依次是_____________ 、及时过滤、洗涤、干燥。
(7)强碱溶液中NaClO氧化 ,可沉淀出用作电池正极材料的NiOOH,该反应的离子方程式为:
,可沉淀出用作电池正极材料的NiOOH,该反应的离子方程式为:_______________________ 。
(8)某笼形络合物M[ ]结构中,镍离子与
]结构中,镍离子与 连接形成平面层,两个平面层通过
连接形成平面层,两个平面层通过 分子连接,所有N原子均参与形成配位键,中间的空隙填充大小合适的分子(如
分子连接,所有N原子均参与形成配位键,中间的空隙填充大小合适的分子(如 ),其基本结构如图(H原子未画出)。回答下列问题:
),其基本结构如图(H原子未画出)。回答下列问题:_______ 。
②晶胞的密度为___________  (用代数式表示)。
(用代数式表示)。
 、Ni、
、Ni、 ,还含有Fe、
,还含有Fe、 和少量含S有机物)中有价值金属回收的工艺流程如下。
和少量含S有机物)中有价值金属回收的工艺流程如下。
(1)基态Ni的价层电子排布式为
(2) “氧化”的目的为
(3)“钠化焙烧”中生成
 的化学方程式为
的化学方程式为(4)“酸化沉钨”后过滤,所得滤饼的主要成分为
(5)“调pH”除铁和铝,溶液的pH范围应调节为
(6)资料显示,硫酸镍结晶水合物的形态与温度有如表关系。
温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
晶体形态 |
|
| 多种结晶水合物 |
|
(7)强碱溶液中NaClO氧化
 ,可沉淀出用作电池正极材料的NiOOH,该反应的离子方程式为:
,可沉淀出用作电池正极材料的NiOOH,该反应的离子方程式为:(8)某笼形络合物M[
 ]结构中,镍离子与
]结构中,镍离子与 连接形成平面层,两个平面层通过
连接形成平面层,两个平面层通过 分子连接,所有N原子均参与形成配位键,中间的空隙填充大小合适的分子(如
分子连接,所有N原子均参与形成配位键,中间的空隙填充大小合适的分子(如 ),其基本结构如图(H原子未画出)。回答下列问题:
),其基本结构如图(H原子未画出)。回答下列问题:
②晶胞的密度为
 (用代数式表示)。
(用代数式表示)。
您最近一年使用:0次
2 .  均是重要的战略性金属。从处理后的矿石硝酸浸取液(含
均是重要的战略性金属。从处理后的矿石硝酸浸取液(含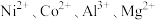 )中,利用氨浸工艺可提取
)中,利用氨浸工艺可提取 ,并获得高附加值化工产品。工艺流程如下:
,并获得高附加值化工产品。工艺流程如下: 、
、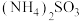 和
和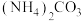 配制。常温下,
配制。常温下,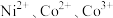 与
与 形成可溶于水的配离子:lgKb(NH3·H2O)=-4.7;
形成可溶于水的配离子:lgKb(NH3·H2O)=-4.7; 易被空气氧化为
易被空气氧化为 ;部分氢氧化物的
;部分氢氧化物的 如下表。回答下列问题:
如下表。回答下列问题:
(1)活性 可与水反应,化学方程式为
可与水反应,化学方程式为_______ 。
(2)常温下, 的氨性溶液中,
的氨性溶液中,
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)“氨浸”时,由 转化为
转化为 的离子方程式为
的离子方程式为_______ 。
(4)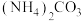 会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了
会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了 的明锐衍射峰。
的明锐衍射峰。
① 属于
属于_______ (填“晶体”或“非晶体”)。
②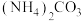 提高了
提高了 的浸取速率,其原因是
的浸取速率,其原因是_______ 。
(5)①“析晶”过程中通入的酸性气体A为_______ 。 溶液中
溶液中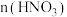 与
与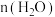 的比值,理论上最高为
的比值,理论上最高为_______ 。
②“热解”对于从矿石提取 工艺的意义,上面工艺中可重复利用的物质
工艺的意义,上面工艺中可重复利用的物质_______ 和_______ (填化学式)。
 均是重要的战略性金属。从处理后的矿石硝酸浸取液(含
均是重要的战略性金属。从处理后的矿石硝酸浸取液(含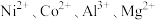 )中,利用氨浸工艺可提取
)中,利用氨浸工艺可提取 ,并获得高附加值化工产品。工艺流程如下:
,并获得高附加值化工产品。工艺流程如下:
 、
、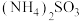 和
和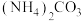 配制。常温下,
配制。常温下,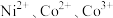 与
与 形成可溶于水的配离子:lgKb(NH3·H2O)=-4.7;
形成可溶于水的配离子:lgKb(NH3·H2O)=-4.7; 易被空气氧化为
易被空气氧化为 ;部分氢氧化物的
;部分氢氧化物的 如下表。回答下列问题:
如下表。回答下列问题:| 氢氧化物 |  |  |  |  |  |
 | 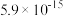 |  |  | 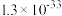 | 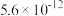 |
(1)活性
 可与水反应,化学方程式为
可与水反应,化学方程式为(2)常温下,
 的氨性溶液中,
的氨性溶液中,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)“氨浸”时,由
 转化为
转化为 的离子方程式为
的离子方程式为(4)
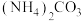 会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了
会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了 的明锐衍射峰。
的明锐衍射峰。①
 属于
属于②
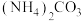 提高了
提高了 的浸取速率,其原因是
的浸取速率,其原因是(5)①“析晶”过程中通入的酸性气体A为
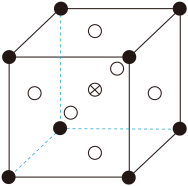
②由 可制备
可制备 晶体,其立方晶胞如图。
晶体,其立方晶胞如图。 与
与 最小间距小于
最小间距小于 与
与 最小间距,x、y为整数,则
最小间距,x、y为整数,则 在晶胞中的位置为
在晶胞中的位置为 周围与其最近的
周围与其最近的 的个数为
的个数为
 溶液中
溶液中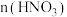 与
与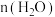 的比值,理论上最高为
的比值,理论上最高为②“热解”对于从矿石提取
 工艺的意义,上面工艺中可重复利用的物质
工艺的意义,上面工艺中可重复利用的物质
您最近一年使用:0次
名校
解题方法
3 . 高砷烟尘(主要成分有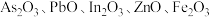 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;
② 在
在 易分解为
易分解为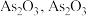 难溶于水;
难溶于水;
③ 。
。
回答下列问题:
(1)滤渣的主要成分为_______ (填化学式)。
(2)“高压酸浸”时, 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为_______ 。 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。已知 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为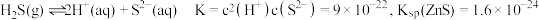 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
_______ 。
(4)“还原”后溶液酸性增强,主要原因是_______ (用离子方程式表示)。
(5)“结晶”操作为_______ 、过滤、洗涤、干燥。
(6)“萃余液”中含有的金属阳离子为_______ (填离子符号),将 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为_______ 。
(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用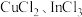 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是_______ ,该晶胞的六个面均为矩形,上、下底面的晶胞参数为 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为_______ (用含a、b、d的式子表示)。
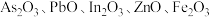 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: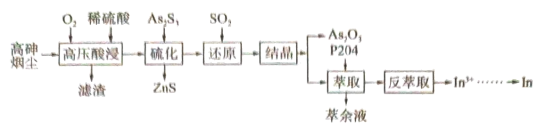
 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;②
 在
在 易分解为
易分解为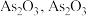 难溶于水;
难溶于水;③
 。
。回答下列问题:
(1)滤渣的主要成分为
(2)“高压酸浸”时,
 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为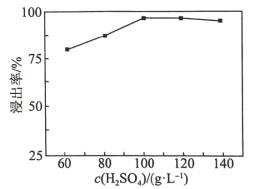
 ,发生反应的离子方程式为
,发生反应的离子方程式为 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为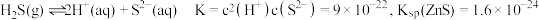 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
(4)“还原”后溶液酸性增强,主要原因是
(5)“结晶”操作为
(6)“萃余液”中含有的金属阳离子为
 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、
 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用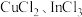 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
2024-05-31更新
|
167次组卷
|
5卷引用:广东省梅州市部分学校2024届高三下学期5月联考化学试卷
解题方法
4 . 如图是元素周期表的一部分,根据元素在周期表中的位置,回答下列问题:_______ ,其最高能层的电子占据的原子轨道电子云轮廓为_______ 形。若将其最高价氧化物的水化物溶于氨水中可得到一种透明的深蓝色溶液,写出反应的化学方程式为:_______ 。
(2)第二周期所有元素中第一电离能介于⑤⑦之间的有_______ 种。由②③④形成的简单离子半径由小到大顺序是_______ (填化学用语)。
(3)元素⑦⑧可形成原子个数比为1:1的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式_______ ,该分子为_______ (填“极性分子”或“非极性分子”。
(4)元素②⑥可形成的化合物是一种性质优良的无机非金属材料,根据元素周期律知识,写出其化学式_______ ,它的熔点高,硬度大,电绝缘性好,化学性质稳定,它的晶体类型是_______ 。
(5)下列有关性质的比较正确且能用元素周期律解释的是_______(填标号)。
(6)一种由②和⑤两种元素形成化合物的晶胞如图所示,该晶胞的化学式为_______ 。

(2)第二周期所有元素中第一电离能介于⑤⑦之间的有
(3)元素⑦⑧可形成原子个数比为1:1的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式
(4)元素②⑥可形成的化合物是一种性质优良的无机非金属材料,根据元素周期律知识,写出其化学式
(5)下列有关性质的比较正确且能用元素周期律解释的是_______(填标号)。
| A.第一电离能:②>③ |
| B.单质的氧化性:⑦>⑧ |
| C.最高价氧化物对应的水化物的碱性:④>⑤ |
| D.氢化物的沸点:③>⑦ |
(6)一种由②和⑤两种元素形成化合物的晶胞如图所示,该晶胞的化学式为

您最近一年使用:0次
5 . 有关晶体的结构如图所示。下列说法错误的是

| A.在1mol冰中,存在2mol氢键 |
| B.图乙表示的分子式为EF或FE |
| C.在CO2晶体中,CO2分子共有4种取向,一个CO2分子紧邻12个CO2分子 |
| D.在1个NaCl晶胞中,平均含有4个Na+和4个Cl- |
您最近一年使用:0次
6 . 已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,A的p能级电子数是s能级的一半,C的基态原子 轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能层均排满,且最外层电子数为1。
轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能层均排满,且最外层电子数为1。
请回答下列问题。
(1)C原子基态时电子排布式为______________________________ 。
(2)B、C两种元素第一电离能为__________ >__________(用元素符号表示)。试解释其原因:____________________ 。
(3)任写一种与 离子互为等电子体的离子
离子互为等电子体的离子__________ 。
(4)B与C形成的四原子阴离子的立体构型为__________ ,其中B原子的杂化类型是__________ 。
(5) 难溶于水,易溶于氨水,写出其溶于氨水的离子方程式
难溶于水,易溶于氨水,写出其溶于氨水的离子方程式____________________ 。
(6)D和E形成的化合物的晶胞结构如图,其化学式为____________________ ;
__________ 。已知晶体的密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞边长
,则晶胞边长
_________  。(用
。(用 、
、 的计算式表示)
的计算式表示)
 轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能层均排满,且最外层电子数为1。
轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能层均排满,且最外层电子数为1。请回答下列问题。
(1)C原子基态时电子排布式为
(2)B、C两种元素第一电离能为
(3)任写一种与
 离子互为等电子体的离子
离子互为等电子体的离子(4)B与C形成的四原子阴离子的立体构型为
(5)
 难溶于水,易溶于氨水,写出其溶于氨水的离子方程式
难溶于水,易溶于氨水,写出其溶于氨水的离子方程式(6)D和E形成的化合物的晶胞结构如图,其化学式为

 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞边长
,则晶胞边长
 。(用
。(用 、
、 的计算式表示)
的计算式表示)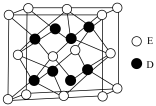
您最近一年使用:0次
7 . 硼氢化钠在室温下是α型的立方晶体,晶胞如图甲所示,在一定条件下转变为四方晶体,晶胞结构和晶胞参数如图乙所示,下列说法错误的是
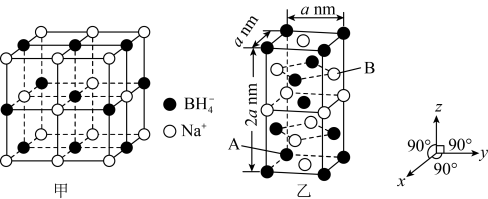
A.硼氢化钠α型的立方晶体中离 最近的 最近的 有12个 有12个 |
B.α型的立方晶体中 填充在 填充在 围成的正八面体的空隙中 围成的正八面体的空隙中 |
C.若A点的坐标为 ,则B点坐标为 ,则B点坐标为 |
D.硼氢化钠四方晶体的晶胞中A和B之间的距离为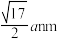 |
您最近一年使用:0次
2024-05-27更新
|
112次组卷
|
2卷引用:广东省名校教研联盟2023-2024学年高三下学期5月测试化学试题
解题方法
8 . 钒主要用于钢铁工业,钒钢用于国防尖端工业。钒钛磁铁矿精矿中主要有用物相为 ,主要杂质为
,主要杂质为 和
和 ,用钒钛磁铁矿精矿制备五氧化二钒的流程如图所示:
,用钒钛磁铁矿精矿制备五氧化二钒的流程如图所示:
(1) 中V的化合价为
中V的化合价为____________ 价;基态V原子的价层电子排布式为______________ 。
(2)在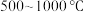 进行钠化焙烧时,钒转化为水溶性的偏钒酸钠
进行钠化焙烧时,钒转化为水溶性的偏钒酸钠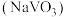 ,写出“焙烧”时生成偏钒酸钠的化学方程式:
,写出“焙烧”时生成偏钒酸钠的化学方程式:______________ 。
(3)常温下,在钒液中加入 和
和 溶液,通过两者的比例不同,调节适当的
溶液,通过两者的比例不同,调节适当的 值进行沉钒,“沉钒”过程中不涉及氧化还原反应,“沉钒”时发生反应的离子方程式为
值进行沉钒,“沉钒”过程中不涉及氧化还原反应,“沉钒”时发生反应的离子方程式为_______________ ;结合图中信息,获得偏钒酸铵晶体的最佳温度和 为
为_______________ 。 ,则晶胞中距离A点最远的白球的坐标参数为
,则晶胞中距离A点最远的白球的坐标参数为_______________ ;若晶胞的棱长为 ,设阿伏加德罗常数的数值为
,设阿伏加德罗常数的数值为 ,则该氮化钛的密度为
,则该氮化钛的密度为________________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。 发生还原反应生成
发生还原反应生成 ,写出该电池正极的电极反应式:
,写出该电池正极的电极反应式:________________ 。
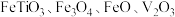 ,主要杂质为
,主要杂质为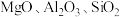 和
和 ,用钒钛磁铁矿精矿制备五氧化二钒的流程如图所示:
,用钒钛磁铁矿精矿制备五氧化二钒的流程如图所示: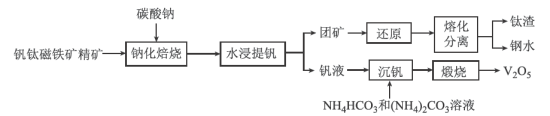
(1)
 中V的化合价为
中V的化合价为(2)在
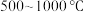 进行钠化焙烧时,钒转化为水溶性的偏钒酸钠
进行钠化焙烧时,钒转化为水溶性的偏钒酸钠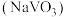 ,写出“焙烧”时生成偏钒酸钠的化学方程式:
,写出“焙烧”时生成偏钒酸钠的化学方程式:(3)常温下,在钒液中加入
 和
和 溶液,通过两者的比例不同,调节适当的
溶液,通过两者的比例不同,调节适当的 值进行沉钒,“沉钒”过程中不涉及氧化还原反应,“沉钒”时发生反应的离子方程式为
值进行沉钒,“沉钒”过程中不涉及氧化还原反应,“沉钒”时发生反应的离子方程式为 为
为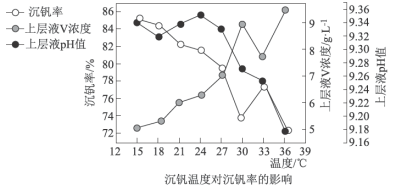
 ,则晶胞中距离A点最远的白球的坐标参数为
,则晶胞中距离A点最远的白球的坐标参数为 ,设阿伏加德罗常数的数值为
,设阿伏加德罗常数的数值为 ,则该氮化钛的密度为
,则该氮化钛的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。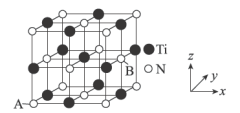
 发生还原反应生成
发生还原反应生成 ,写出该电池正极的电极反应式:
,写出该电池正极的电极反应式:
您最近一年使用:0次
2024-05-24更新
|
111次组卷
|
2卷引用:广东省部分学校2024届高三下学期5月份大联考化学试题
9 . Zn为常用金属,In(铟)、Ge、Bi(铋)是重要的战略性金属。从某种冶炼金属锌的废渣[含 、
、 (少量)、
(少量)、 、
、 、
、 ]中利用酸浸方法提取上述金属或其化合物,其工艺流程如下:
]中利用酸浸方法提取上述金属或其化合物,其工艺流程如下: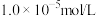 时,可认为目标离子沉淀完全。
时,可认为目标离子沉淀完全。
(1)“酸浸1”的目的是________________________ 。
(2)“含铋浸渣”中含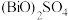 ,该操作中Bi元素由氧化物转化为
,该操作中Bi元素由氧化物转化为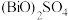 的离子方程式为
的离子方程式为________________________ 。
(3)测得常温时,“酸浸1”后的滤液中 。“除铁”操作需调整pH在3~6之间,计算
。“除铁”操作需调整pH在3~6之间,计算
________ 。“浓缩、结晶”得 后的滤液中,
后的滤液中,
________ (填“=”“>”或“<”) 。
。
(4)加盐酸进行“反萃取”前后的“有机相1”和“有机相2”的主要成分分别为:________ ,“水相”中加入锌粉制备金属In的离子方程式是________________________ 。
(5)In与La、Co等金属形成某种合金 ,该合金的晶胞结构如下图所示,该晶胞中In位于
,该合金的晶胞结构如下图所示,该晶胞中In位于________ 。晶胞为长方体,底边边长均为 ,高为
,高为 ,该合金密度为
,该合金密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
________ 。 的部分性质如下:
的部分性质如下:
温度为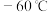 时,
时, 属于
属于________ 晶体(填晶体类型),气体的单分子 的空间构型是
的空间构型是________ 。
 、
、 (少量)、
(少量)、 、
、 、
、 ]中利用酸浸方法提取上述金属或其化合物,其工艺流程如下:
]中利用酸浸方法提取上述金属或其化合物,其工艺流程如下: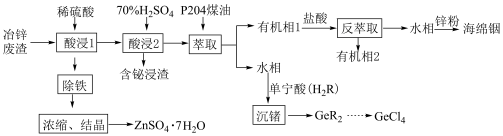
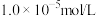 时,可认为目标离子沉淀完全。
时,可认为目标离子沉淀完全。(1)“酸浸1”的目的是
(2)“含铋浸渣”中含
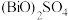 ,该操作中Bi元素由氧化物转化为
,该操作中Bi元素由氧化物转化为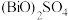 的离子方程式为
的离子方程式为(3)测得常温时,“酸浸1”后的滤液中
 。“除铁”操作需调整pH在3~6之间,计算
。“除铁”操作需调整pH在3~6之间,计算
 后的滤液中,
后的滤液中,
 。
。(4)加盐酸进行“反萃取”前后的“有机相1”和“有机相2”的主要成分分别为:
(5)In与La、Co等金属形成某种合金
 ,该合金的晶胞结构如下图所示,该晶胞中In位于
,该合金的晶胞结构如下图所示,该晶胞中In位于 ,高为
,高为 ,该合金密度为
,该合金密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数

 的部分性质如下:
的部分性质如下:熔点/℃ | 沸点/℃ | 密度/( | 颜色状态 | 溶解性 |
| 84 | 1.8622 | 无色液体 | 溶于苯、乙醇、乙醚等有机溶剂 |
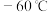 时,
时, 属于
属于 的空间构型是
的空间构型是
您最近一年使用:0次
10 . 如图为几种晶体或晶胞的结构示意图。
(1)CaCl2晶体属于___________ 晶体。
(2)微粒之间以共价键结合而形成晶体的是___________ (填写晶体名称)。
(3)冰、金刚石、MgO、碘单质四种晶体的熔点由高到低的顺序为___________ 。
(4)NaCl晶胞与MgO晶胞结构相同,而NaCl晶体的熔点小于MgO晶体的熔点,原因是___________ 。
(5)GaN是很好的半导体材料,晶体类型与金刚石晶体类似,晶胞结构如图1所示,已知六棱柱底边边长为acm。从GaN晶体中分割出的平行六面体如图2。若该平行六面体的体积为 a3cm3,GaN晶体的密度为
a3cm3,GaN晶体的密度为___________ g·cm-3(用a、NA表示,近似相对原子量:Ga70;N14)

(1)CaCl2晶体属于
(2)微粒之间以共价键结合而形成晶体的是
(3)冰、金刚石、MgO、碘单质四种晶体的熔点由高到低的顺序为
(4)NaCl晶胞与MgO晶胞结构相同,而NaCl晶体的熔点小于MgO晶体的熔点,原因是
(5)GaN是很好的半导体材料,晶体类型与金刚石晶体类似,晶胞结构如图1所示,已知六棱柱底边边长为acm。从GaN晶体中分割出的平行六面体如图2。若该平行六面体的体积为
 a3cm3,GaN晶体的密度为
a3cm3,GaN晶体的密度为
您最近一年使用:0次



 )
)