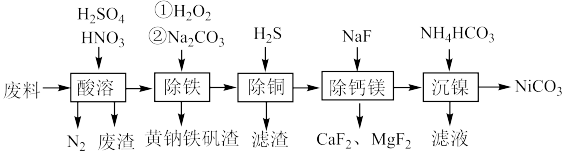
1 . 碳酸镍是合成纳米镍的一种前驱体。一种用铁镍合金废料(还含有少量铜、钙、镁、硅的氧化物)制备纯度较高的碳酸镍的工艺流程如图: 的电离常数
的电离常数 。
。
回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸;
①金属镍溶解的离子方程式是______ 。
②“酸溶”时产生的废渣成分有______ 。
③该过程控制温度 的原因是
的原因是______ 。
(2)“除铜”后,溶液中 ,溶液中
,溶液中
______  列计算式)才不会使
列计算式)才不会使 形成
形成 沉淀。
沉淀。
(3)“沉镍”时,若用 溶液做沉淀剂,产物容易不纯,该杂质的化学式为
溶液做沉淀剂,产物容易不纯,该杂质的化学式为______ 。
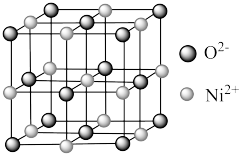
(4)镍是一种应用范围广泛的金属元素,其价层电子排布式为______ 。镍的氧化物也常用作催化剂,立方 晶体的结构如图所示。该晶体中
晶体的结构如图所示。该晶体中 周围与其等距离且最近的
周围与其等距离且最近的 有
有______ 个,其晶胞边长为 ,列式表示
,列式表示 晶体的密度为
晶体的密度为______ 。 (不必计算出结果,阿伏加德罗常数的值为
(不必计算出结果,阿伏加德罗常数的值为 )。
)。
 的电离常数
的电离常数 。
。回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸;
①金属镍溶解的离子方程式是
②“酸溶”时产生的废渣成分有
③该过程控制温度
 的原因是
的原因是(2)“除铜”后,溶液中
 ,溶液中
,溶液中
 列计算式)才不会使
列计算式)才不会使 形成
形成 沉淀。
沉淀。(3)“沉镍”时,若用
 溶液做沉淀剂,产物容易不纯,该杂质的化学式为
溶液做沉淀剂,产物容易不纯,该杂质的化学式为(4)镍是一种应用范围广泛的金属元素,其价层电子排布式为
 晶体的结构如图所示。该晶体中
晶体的结构如图所示。该晶体中 周围与其等距离且最近的
周围与其等距离且最近的 有
有 ,列式表示
,列式表示 晶体的密度为
晶体的密度为 (不必计算出结果,阿伏加德罗常数的值为
(不必计算出结果,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
解题方法
2 . 钴广泛应用于新能源、航空航天等领域,一种萃铜余液(主要存在 等金属阳离子)中提取钴并制得
等金属阳离子)中提取钴并制得 的工艺流程如下:
的工艺流程如下: 。相关金属离子
。相关金属离子 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:
回答下列问题:
(1) 的价电子排布图为
的价电子排布图为___________ 。
(2)“除杂”时,将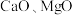 按一定比例同时加入萃铜余液中,调节溶液
按一定比例同时加入萃铜余液中,调节溶液 ,充分反应后过滤。
,充分反应后过滤。
①滤渣的主要成分是___________ 。
②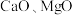 加入量过大时,钴的损耗增大,其原因是
加入量过大时,钴的损耗增大,其原因是___________ 。
(3)“萃取”时,用硫酸调节溶液的 至2.5左右,加入萃取剂
至2.5左右,加入萃取剂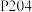 ,发生萃取反应:
,发生萃取反应: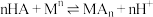 (其中HA为萃取剂P204,
(其中HA为萃取剂P204, 为金属离子)。萃取剂P204在不同
为金属离子)。萃取剂P204在不同 下对金属离子萃取率的影响如图所示。
下对金属离子萃取率的影响如图所示。___________ (填金属离子的符号)。
②往“萃取”所得有机层中加入___________ (选填“ ”或“
”或“ ”),可将其中金属离子反萃取至水中。反萃取后,有机萃取剂可循环使用。
”),可将其中金属离子反萃取至水中。反萃取后,有机萃取剂可循环使用。
(4)“沉钴”时,往萃余液中加入 ,调节溶液
,调节溶液 ,过滤得到
,过滤得到 沉淀。当
沉淀。当 恰好沉淀完全时,溶液中
恰好沉淀完全时,溶液中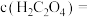
___________  。
。
(5)“煅烧”时 完全转化为
完全转化为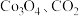 和
和 ,制得
,制得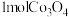 需消耗
需消耗___________ 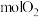 。
。
(6)含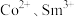 的溶液经电沉积可制备Sm-Co水磁合金,一种Sm-Co水磁合金的六方晶胞结构如图1所示,晶胞中Co原子的投影位置如图2所示。晶胞参数
的溶液经电沉积可制备Sm-Co水磁合金,一种Sm-Co水磁合金的六方晶胞结构如图1所示,晶胞中Co原子的投影位置如图2所示。晶胞参数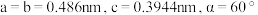 ,
, 。
。___________ 。
②设 为阿伏加德罗常数的值,合金最简式的式量为
为阿伏加德罗常数的值,合金最简式的式量为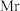 ,则该合金的密度
,则该合金的密度
___________  (列出计算式)。
(列出计算式)。
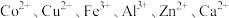 等金属阳离子)中提取钴并制得
等金属阳离子)中提取钴并制得 的工艺流程如下:
的工艺流程如下: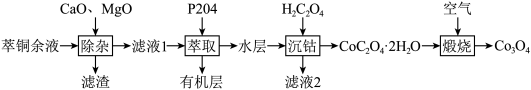
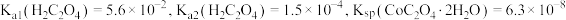 。相关金属离子
。相关金属离子 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:| 金属离子 |  |  |  |  |  |  |
开始沉淀的 | 7.4 | 4.7 | 1.5 | 3.4 | 8.9 | 6.2 |
沉淀完全 的 的 | 9.4 | 6.7 | 2.8 | 4.7 | 10.9 | 8.2 |
(1)
 的价电子排布图为
的价电子排布图为(2)“除杂”时,将
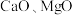 按一定比例同时加入萃铜余液中,调节溶液
按一定比例同时加入萃铜余液中,调节溶液 ,充分反应后过滤。
,充分反应后过滤。①滤渣的主要成分是
②
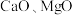 加入量过大时,钴的损耗增大,其原因是
加入量过大时,钴的损耗增大,其原因是(3)“萃取”时,用硫酸调节溶液的
 至2.5左右,加入萃取剂
至2.5左右,加入萃取剂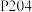 ,发生萃取反应:
,发生萃取反应: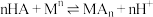 (其中HA为萃取剂P204,
(其中HA为萃取剂P204, 为金属离子)。萃取剂P204在不同
为金属离子)。萃取剂P204在不同 下对金属离子萃取率的影响如图所示。
下对金属离子萃取率的影响如图所示。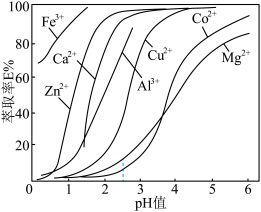
②往“萃取”所得有机层中加入
 ”或“
”或“ ”),可将其中金属离子反萃取至水中。反萃取后,有机萃取剂可循环使用。
”),可将其中金属离子反萃取至水中。反萃取后,有机萃取剂可循环使用。(4)“沉钴”时,往萃余液中加入
 ,调节溶液
,调节溶液 ,过滤得到
,过滤得到 沉淀。当
沉淀。当 恰好沉淀完全时,溶液中
恰好沉淀完全时,溶液中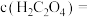
 。
。(5)“煅烧”时
 完全转化为
完全转化为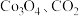 和
和 ,制得
,制得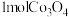 需消耗
需消耗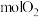 。
。(6)含
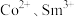 的溶液经电沉积可制备Sm-Co水磁合金,一种Sm-Co水磁合金的六方晶胞结构如图1所示,晶胞中Co原子的投影位置如图2所示。晶胞参数
的溶液经电沉积可制备Sm-Co水磁合金,一种Sm-Co水磁合金的六方晶胞结构如图1所示,晶胞中Co原子的投影位置如图2所示。晶胞参数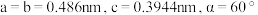 ,
, 。
。
②设
 为阿伏加德罗常数的值,合金最简式的式量为
为阿伏加德罗常数的值,合金最简式的式量为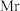 ,则该合金的密度
,则该合金的密度
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
解题方法
3 . 甲为碳单质的一种晶体,其二维结构图如图,乙为C、K原子构成的一种晶体,其二维结构图如图。下列叙述错误的是


| A.甲、乙的二维材料都具有良好的导电性 |
B.甲、乙中碳原子都是 杂化 杂化 |
C.乙的化学式为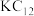 |
D.甲中碳原子数与 键数之比为2:3 键数之比为2:3 |
您最近一年使用:0次
解题方法
4 . 锰酸锂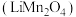 是锂电池的正极材料,有望取代
是锂电池的正极材料,有望取代 。一种以废旧电池正极材料(主要成分为
。一种以废旧电池正极材料(主要成分为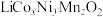 ,其中Co为+3价,还含少量铝箔、炭黑和有机黏合剂)为原料制备
,其中Co为+3价,还含少量铝箔、炭黑和有机黏合剂)为原料制备 的流程如下:
的流程如下:
(1)Ni位于元素周期表中_______ 区;基态Mn原子的价层电子轨道表示式为________ 。
(2)“灼烧”的目的是________ 。
(3)根据“酸浸”前后物质价态的变化,推测双氧水的作用是________ 。
(4)“沉锰”过程中,溶液先变为紫红色,一段时间后紫红色褪去。溶液变为紫红色的原因是___________ (用离子方程式表示,加入 溶液之前,锰以
溶液之前,锰以 形式存在)。“紫红色褪去”后,还可能有的实验现象是
形式存在)。“紫红色褪去”后,还可能有的实验现象是___________ 。
(5) 材料在脱锂过程中形成的某种晶体为六方晶系,结构如图,晶胞底面边长为
材料在脱锂过程中形成的某种晶体为六方晶系,结构如图,晶胞底面边长为 、高为
、高为 ,
,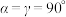 ,
,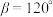 ,设
,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。___________ 。
②该晶体的密度为___________  。
。
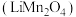 是锂电池的正极材料,有望取代
是锂电池的正极材料,有望取代 。一种以废旧电池正极材料(主要成分为
。一种以废旧电池正极材料(主要成分为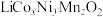 ,其中Co为+3价,还含少量铝箔、炭黑和有机黏合剂)为原料制备
,其中Co为+3价,还含少量铝箔、炭黑和有机黏合剂)为原料制备 的流程如下:
的流程如下: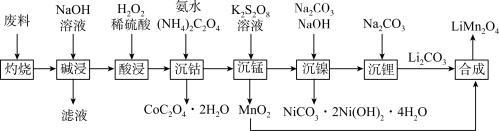
(1)Ni位于元素周期表中
(2)“灼烧”的目的是
(3)根据“酸浸”前后物质价态的变化,推测双氧水的作用是
(4)“沉锰”过程中,溶液先变为紫红色,一段时间后紫红色褪去。溶液变为紫红色的原因是
 溶液之前,锰以
溶液之前,锰以 形式存在)。“紫红色褪去”后,还可能有的实验现象是
形式存在)。“紫红色褪去”后,还可能有的实验现象是(5)
 材料在脱锂过程中形成的某种晶体为六方晶系,结构如图,晶胞底面边长为
材料在脱锂过程中形成的某种晶体为六方晶系,结构如图,晶胞底面边长为 、高为
、高为 ,
,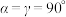 ,
,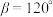 ,设
,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
②该晶体的密度为
 。
。
您最近一年使用:0次
5 . 硫酸镍在电镀、镍电池、催化剂以及制取其他镍盐等领域有着十分重要的应用。从某镀镍厂排放的粗硫酸镍废弃物(含Cu2+、Fe3+、Mg2+、Zn2+、Ca2+等杂质)中对资源进行回收利用,提取硫酸镍晶体(NiSO4·6H2O)的工艺流程如图所示。
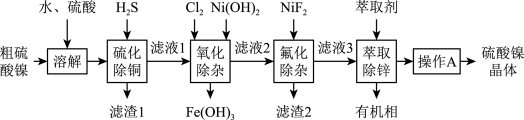
已知:常温下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
(1)提高“溶解”速率的措施是___________ 。(任写两点)
(2)“硫化除铜”过程中含铁微粒发生的离子反应方程式___________ 。
(3)“滤渣2”的主要成分是___________ 。(填化学式)
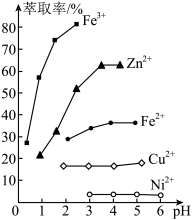
(4)“萃取除锌”时,室温下溶液pH对几种离子的萃取率的影响如图,则萃取锌时,应控制pH范围为3~4,请解释原因:___________ 。
(5)称取2.000g硫酸镍晶体(NiSO4·6H2O)样品溶于蒸馏水,定容至250mL,移取25.00mL溶液于锥形瓶中,用0.0200mol·L-1的EDTA(Na2H2Y)标准溶液滴定至终点。重复实验,3次平均消耗EDTA标准溶液20.00mL。已知滴定反应:Ni2+ + H2Y2- = NiY2- + 2H+,计算样品纯度为___________ 。(保留四位有效数字)
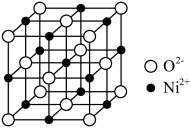
(6)镍的氧化物常用作催化剂,NiO的晶胞结构如下图所示,O2-的配位数是___________ ;若晶胞中两个O2-的最近距离为a nm,晶体密度ρ=___________ g·cm-3.(列出计算式,NA为阿伏加德罗常数的值)

已知:常温下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Ni2+ | Fe3+ | Fe2+ |
| 开始沉淀时(c = 0.01 mol·L-1)的pH | 7.2 | 2.2 | 7.5 |
| 沉淀完全时(c = 1.0×10-5 mol·L-1)的pH | 8.7 | 3.2 | 9.0 |
(1)提高“溶解”速率的措施是
(2)“硫化除铜”过程中含铁微粒发生的离子反应方程式
(3)“滤渣2”的主要成分是
(4)“萃取除锌”时,室温下溶液pH对几种离子的萃取率的影响如图,则萃取锌时,应控制pH范围为3~4,请解释原因:

(5)称取2.000g硫酸镍晶体(NiSO4·6H2O)样品溶于蒸馏水,定容至250mL,移取25.00mL溶液于锥形瓶中,用0.0200mol·L-1的EDTA(Na2H2Y)标准溶液滴定至终点。重复实验,3次平均消耗EDTA标准溶液20.00mL。已知滴定反应:Ni2+ + H2Y2- = NiY2- + 2H+,计算样品纯度为
(6)镍的氧化物常用作催化剂,NiO的晶胞结构如下图所示,O2-的配位数是

您最近一年使用:0次
名校
解题方法
6 . ZnS的晶胞结构如图所示,其晶胞参数为a nm,以晶胞参数建立坐标系,1号原子的坐标为(0,0,0),3号原子的坐标为(1,1,1)。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是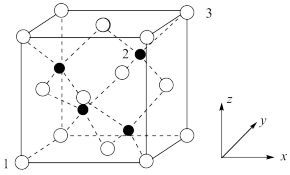
| A.可以用质谱仪测定ZnS晶体结构 |
B.97 g ZnS晶体含有的晶胞数目为 |
C.2号和3号原子之间的距离为 nm nm |
D.2号原子的坐标为(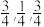 ) ) |
您最近一年使用:0次
2024-01-25更新
|
500次组卷
|
5卷引用:广东省深圳市高级中学2023-2024学年高二上学期期末考试化学试题
7 . 某钴土矿主要含有镍(Ni)、钴(Co)、铁(Fe)、铝(Al)、钙(Ca)、硅(Si)等元素的氧化物,一种综合回收利用钴土矿的部分流程如下:

已知:①25℃时,相关金属离子 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:
②氧化前后,溶液中 、
、 元素的化合价均为+2价。
元素的化合价均为+2价。
(1)“酸浸”时,滤渣的主要成分为___________ (填化学式)。
(2)“除铁、铝”时,应控制溶液 范围为
范围为___________ ,使用 溶液可将滤渣2中铁、铝元素分离,涉及化学方程式为
溶液可将滤渣2中铁、铝元素分离,涉及化学方程式为___________ 。
(3)“沉钴”时,滤渣3的成分为亚硝酸钴钾 ,同时有无色气体(遇空气变为红棕色)生成,写出“沉钴”步骤的离子方程式
,同时有无色气体(遇空气变为红棕色)生成,写出“沉钴”步骤的离子方程式___________ 。
(4)亚硝酸钴钾 的中心离子的配位数为
的中心离子的配位数为___________ ,配体中配位原子 的杂化方式为
的杂化方式为___________ 。
(5) 的一种氧化物
的一种氧化物 是重要的化工原料。
是重要的化工原料。 晶体为尖晶石结构,其晶胞结构如下图所示。已知晶胞边长为
晶体为尖晶石结构,其晶胞结构如下图所示。已知晶胞边长为 ,设
,设 为阿伏加德罗常数的值,则该晶体中
为阿伏加德罗常数的值,则该晶体中 与
与 的个数比为
的个数比为___________ ,晶体的密度为___________  (列出计算式)。
(列出计算式)。


已知:①25℃时,相关金属离子
 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:| 金属离子 |  |  |  |  |  |
开始沉淀的 | 6.3 | 1.8 | 3.4 | 6.9 | 7.1 |
沉淀完全的 | 8.3 | 3.2 | 4.7 | 8.9 | 9.1 |
 、
、 元素的化合价均为+2价。
元素的化合价均为+2价。(1)“酸浸”时,滤渣的主要成分为
(2)“除铁、铝”时,应控制溶液
 范围为
范围为 溶液可将滤渣2中铁、铝元素分离,涉及化学方程式为
溶液可将滤渣2中铁、铝元素分离,涉及化学方程式为(3)“沉钴”时,滤渣3的成分为亚硝酸钴钾
 ,同时有无色气体(遇空气变为红棕色)生成,写出“沉钴”步骤的离子方程式
,同时有无色气体(遇空气变为红棕色)生成,写出“沉钴”步骤的离子方程式(4)亚硝酸钴钾
 的中心离子的配位数为
的中心离子的配位数为 的杂化方式为
的杂化方式为(5)
 的一种氧化物
的一种氧化物 是重要的化工原料。
是重要的化工原料。 晶体为尖晶石结构,其晶胞结构如下图所示。已知晶胞边长为
晶体为尖晶石结构,其晶胞结构如下图所示。已知晶胞边长为 ,设
,设 为阿伏加德罗常数的值,则该晶体中
为阿伏加德罗常数的值,则该晶体中 与
与 的个数比为
的个数比为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
解题方法
8 . 2023年杭州亚运会开幕式首次使用“零碳甲醇”作为主火炬塔燃料。
(1)CH3OH分子中O的杂化轨道类型为___________ 。
(2)以CO2为原料加氢可以合成甲醇 ,该反应能量变化如图。
,该反应能量变化如图。

①第___________ 步(填“1”或“2”)是上述反应的决速步。
②恒容时,下列措施中能使该平衡体系中 增大且加快化学反应速率的是
增大且加快化学反应速率的是___________ (填字母)。
A.充入He(g),使体系压强增大 B.升高温度
C.将H2O(g)从体系中分离出去 D.再充入H2
③干冰(CO2)的晶胞结构如图所示,若该晶胞边长为apm,则干冰晶体的密度为___________  。(已知:
。(已知: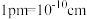 ;NA表示阿伏加德罗常数的值)
;NA表示阿伏加德罗常数的值)

(3)在体积为1L的恒容密闭容器中,充入1molCO2(g)和2molH2(g),一定条件下发生反应: ,测得CH3OH(g)浓度随时间的变化:
,测得CH3OH(g)浓度随时间的变化:
测得该条件下平衡时体系的压强为P,求该反应的
___________ (物质的分压=总压×物质的量分数)。
(4) 可催化
可催化 的氢化,体系中产生
的氢化,体系中产生 和CO。现将一定比例的CO2、H2以一定流速通过催化剂,某温度下,得到
和CO。现将一定比例的CO2、H2以一定流速通过催化剂,某温度下,得到 的转化率、
的转化率、 或CO的选择性[
或CO的选择性[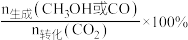 ]与催化剂中NiO质量分数的关系图:
]与催化剂中NiO质量分数的关系图:

①曲线___________ (填“X”或“Y”)表示 的转化率随催化剂中NiO的质量分数的变化。
的转化率随催化剂中NiO的质量分数的变化。
②有利于提高 选择性的反应条件是
选择性的反应条件是___________ (填标号)。
A.减小压强 B.使用更合适的催化剂 C.原料气中掺入适量的CO
(1)CH3OH分子中O的杂化轨道类型为
(2)以CO2为原料加氢可以合成甲醇
 ,该反应能量变化如图。
,该反应能量变化如图。
①第
②恒容时,下列措施中能使该平衡体系中
 增大且加快化学反应速率的是
增大且加快化学反应速率的是A.充入He(g),使体系压强增大 B.升高温度
C.将H2O(g)从体系中分离出去 D.再充入H2
③干冰(CO2)的晶胞结构如图所示,若该晶胞边长为apm,则干冰晶体的密度为
 。(已知:
。(已知: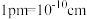 ;NA表示阿伏加德罗常数的值)
;NA表示阿伏加德罗常数的值)
(3)在体积为1L的恒容密闭容器中,充入1molCO2(g)和2molH2(g),一定条件下发生反应:
 ,测得CH3OH(g)浓度随时间的变化:
,测得CH3OH(g)浓度随时间的变化:| 时间/min | 0 | 3 | 5 | 10 | 15 |
浓度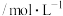 | 0 | 0.3 | 0.45 | 0.5 | 0.5 |

(4)
 可催化
可催化 的氢化,体系中产生
的氢化,体系中产生 和CO。现将一定比例的CO2、H2以一定流速通过催化剂,某温度下,得到
和CO。现将一定比例的CO2、H2以一定流速通过催化剂,某温度下,得到 的转化率、
的转化率、 或CO的选择性[
或CO的选择性[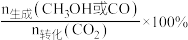 ]与催化剂中NiO质量分数的关系图:
]与催化剂中NiO质量分数的关系图:
①曲线
 的转化率随催化剂中NiO的质量分数的变化。
的转化率随催化剂中NiO的质量分数的变化。②有利于提高
 选择性的反应条件是
选择性的反应条件是A.减小压强 B.使用更合适的催化剂 C.原料气中掺入适量的CO
您最近一年使用:0次
名校
解题方法
9 . 铜的单质及其化合物在工农业、国防、科技等领域具有广泛应用。回答下列问题:
(1)基态Cu+的价层电子排布式为_______ 。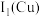
_______ (填“ ”或“
”或“ ”)
”)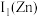 ,原因是
,原因是_______ 。
(2)研究发现,阳离子的颜色与未成对电子数有关。例如:Cu2+、Fe2+、Fe3+等。Cu+呈无色,其原因是_______ 。
(3)合成氨工业中,铜(I)氨溶液常用于除去原料气(N2和H2等)中少量的CO,发生的化学反应为: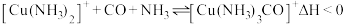 。
。
①NH3分子中N原子的杂化轨道类型是_______ ,NH3和[Cu(NH3)4]2+中H-N-H键角的大小:NH3_______ [Cu(NH3)4]2+ (填“ ”或“
”或“ ”)。
”)。
②铜(Ⅰ)氨液吸收CO适宜的生产条件是_______ (填序号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
③[Cu(NH3)3CO]+配离子中配体是_______ 。
(4)CuCl2与乙二胺(H2NCH2CH2NH2)可形成配离子[Cu(En)2]2+ (En是乙二胺的简写),其结构简式如图所示:
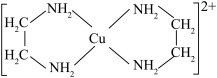
①H2NCH2CH2NH2 (乙二胺)和N(CH3)3(三甲胺)均属于胺,二者相对分子质量相近,但乙二胺的沸点比三甲胺的高得多,原因是_______ 。
②配合物[Cu(En)2]Cl2中不存在的作用力类型有_______ (填选项字母)。
A.配位键 B.极性键 C.离子键 D.非极性键 E.范德华力 F.金属键
(5)金属合金MgCux的结构可看作以Cu4四面体(相互共用顶点)替换立方金刚石结构中的碳原子,形成三维骨架,在晶胞空隙处,有序地放置Mg原子(四面体的4个顶点代表Cu原子,圆球代表Mg原子),结构如图所示。

①
_______ 。
②若Mg原子A的原子坐标为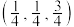 ,则C的原子坐标为
,则C的原子坐标为_______ 。
③晶胞参数为 ,则AB原子之间的距离为
,则AB原子之间的距离为_______ nm。
(1)基态Cu+的价层电子排布式为
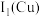
 ”或“
”或“ ”)
”)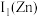 ,原因是
,原因是(2)研究发现,阳离子的颜色与未成对电子数有关。例如:Cu2+、Fe2+、Fe3+等。Cu+呈无色,其原因是
(3)合成氨工业中,铜(I)氨溶液常用于除去原料气(N2和H2等)中少量的CO,发生的化学反应为:
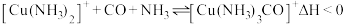 。
。①NH3分子中N原子的杂化轨道类型是
 ”或“
”或“ ”)。
”)。②铜(Ⅰ)氨液吸收CO适宜的生产条件是
A.高温高压 B.高温低压 C.低温高压 D.低温低压
③[Cu(NH3)3CO]+配离子中配体是
(4)CuCl2与乙二胺(H2NCH2CH2NH2)可形成配离子[Cu(En)2]2+ (En是乙二胺的简写),其结构简式如图所示:

①H2NCH2CH2NH2 (乙二胺)和N(CH3)3(三甲胺)均属于胺,二者相对分子质量相近,但乙二胺的沸点比三甲胺的高得多,原因是
②配合物[Cu(En)2]Cl2中不存在的作用力类型有
A.配位键 B.极性键 C.离子键 D.非极性键 E.范德华力 F.金属键
(5)金属合金MgCux的结构可看作以Cu4四面体(相互共用顶点)替换立方金刚石结构中的碳原子,形成三维骨架,在晶胞空隙处,有序地放置Mg原子(四面体的4个顶点代表Cu原子,圆球代表Mg原子),结构如图所示。

①

②若Mg原子A的原子坐标为
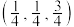 ,则C的原子坐标为
,则C的原子坐标为③晶胞参数为
 ,则AB原子之间的距离为
,则AB原子之间的距离为
您最近一年使用:0次
名校
解题方法
10 . 石墨烯可转化为富勒烯(C60),科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其立方晶胞结构如图所示,晶胞边长为a pm。下列说法不正确的是
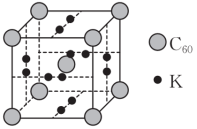
| A. C60和石墨烯互为同素异形体 | B.该富勒烯化合物的化学式为K3C60 |
| C. C60周围等距且距离最近的C60的数目为6 | D.该晶体的密度为 |
您最近一年使用:0次
2023-07-16更新
|
667次组卷
|
5卷引用:广东省广州市第二中学2022-2023学年高二下学期期末考试化学试题



