1 . 下列关于 和金刚石的叙述正确的是
和金刚石的叙述正确的是
 和金刚石的叙述正确的是
和金刚石的叙述正确的是A. 是共价晶体,它是自然界含量最高的固态二元化合物 是共价晶体,它是自然界含量最高的固态二元化合物 |
B.通常状况下,1mol 晶体中含有 晶体中含有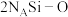 键( 键( 表示阿伏加德罗常数值) 表示阿伏加德罗常数值) |
| C.金刚石的网状结构中,由共价键形成的最小环上有6个碳原子,1个碳原子被6个六元环所共用 |
D.1mol金刚石中含有 个C-C键( 个C-C键( 表示阿伏加德罗常数的值) 表示阿伏加德罗常数的值) |
您最近一年使用:0次
2023-03-30更新
|
240次组卷
|
3卷引用:安徽省安庆市第九中学2022-2023学年高二下学期期中考试化学试题
名校
2 . 设NA为阿伏加德罗常数的值,下列有关叙述不正确的是
| A.标准状况下,2NA和NO与NA个O2充分反应后的气体体积为44.8L |
| B.14g乙烯(CH2=CH2)和丙烯(CH2=CHCH3)的混合气体质子数为8NA |
| C.常温下,4.5gSiO2晶体中所含有的硅氧键的数目为0.3NA |
| D.常温下,将5.6gFe放入含0.8molHNO3的浓硝酸中,反应转移的电子数小于0.3NA |
您最近一年使用:0次
解题方法
3 . 下列关于物质的结构或性质以及解释均正确的是
| 选项 | 物质的结构或性质 | 解释 |
| A | 键角:NH3>BF3 | NH3中N的孤电子对数比BF3中B的孤电子对数多 |
| B | 酸性:CH3COOH>CH3CH2COOH | 烃基(R-)越长推电子效应越大,使羧基中羟基的极性越小,羧酸的酸性越弱 |
| C | 熔点:碳化硅>金刚石 | C-Si键能大于C-C键能 |
| D | 稳定性:H2O>H2S | 水分子间存在氢键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-17更新
|
499次组卷
|
2卷引用:湖北省部分普通高中联盟2022-2023学年高二下学期期中联考化学试题
名校
解题方法
4 . 下列物质的熔、沸点高低顺序正确的是
| A.金刚石>晶体硅>碳化硅 | B.CI4>CBr4>CCl4>CF4 |
| C.MgO>CO2>H2O | D.金刚石>生铁>钠>纯铁 |
您最近一年使用:0次
2023-02-17更新
|
834次组卷
|
7卷引用:山东省滨州市惠民县2022-2023学年高二下学期4月期中质量检测化学试题
山东省滨州市惠民县2022-2023学年高二下学期4月期中质量检测化学试题(已下线)题型94 晶体微粒间作用力及晶体熔、沸点高低比较宁夏青铜峡市宁朔中学2022-2023学年高二下学期3月月考化学试题山西省运城市康杰中学2022-2023学年高二下学期3月月考化学试题(已下线)热点07 分子晶体与共价晶体江西省南昌市第十九中学2022-2023学年高二下学期3月第一次月考化学试卷 吉林省长春市第二实验中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
5 . 下列关于SiO2和金刚石的叙述正确的是
| A.SiO2的晶体结构中,每个Si原子与2个O原子直接相连 |
| B.通常状况下,1molSiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数的值) |
| C.金刚石的网状结构中,由共价键形成的最小环上有6个碳原子 |
| D.1mol金刚石中含有4NA个C-C键(NA表示阿伏加德罗常数的值) |
您最近一年使用:0次
2023-01-13更新
|
1424次组卷
|
12卷引用:四川省成都市龙泉驿区教育科学研究院2021-2022学年高二下学期期中考试化学试卷
四川省成都市龙泉驿区教育科学研究院2021-2022学年高二下学期期中考试化学试卷甘肃省武威市凉州区2022-2023学年高二下学期期中考试化学试题2014-2015学年辽宁实验中学等五校高二下期末化学试卷(人教版2019)选择性必修2 第三章 晶体结构与性质 第二节 分子晶体与共价晶体 课时2 共价晶体(已下线)第43练 分子晶体与共价晶体-2023年高考化学一轮复习小题多维练(全国通用)吉林省通化市梅河口市第五中学2022-2023学年高二上学期期末考试化学试题(已下线)3.2.2 共价晶体-同步学习必备知识湖南省株洲市第一中学2022-2023学年高二下学期第一次月考化学试题湖北省宜昌英杰学校2022-2023学年高二3月月考化学试题黑龙江省哈尔滨市第四中学校2022-2023学年高二下学期4月月考化学试题(已下线)热点07 分子晶体与共价晶体3.2.2 共价晶体-随堂练习
名校
6 . 目前,碳族元素按原子序数增大,依次为:碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)。请回答:
(1)锗原子的最外层电子排布式:________ ,锡原子的最外层电子云有______ 种伸展方向; 单质锗具有__________ (填字母)。
a.只有金属性 b.只有非金属性 c. 既有金属性,又有非金属性
(2)硅可存在二氧化硅和碳化硅两种晶体,请结合原子结构等相关知识判断二者的熔点:前者___________ (大于、小于)后者。你的依据是____________ 。
(3)某同学根据反应:SiO2 + 2C Si + 2CO↑,得出结论:碳的非金属性强于硅的反应。请对此给予评价并说明理由:
Si + 2CO↑,得出结论:碳的非金属性强于硅的反应。请对此给予评价并说明理由:___________________
(4)高温下,在2L容积固定的密闭容器中,用足量焦炭与一定量二氧化碳发生可逆反应C(s)+CO2(g) 2CO(g)-Q,回答以下题
2CO(g)-Q,回答以下题
①反应至10分钟后,混合气体质量增加了9.6g,则用这段时间内用CO表示的反应速率为____ 。
②反应达到平衡 后,下列各种说法一定正确的是______ 。
A.平衡时速率关系:2v(CO2)= v(CO)
B.压缩容器体积达新平衡,气体浓度增大的倍数:CO>CO2
C.升高温度转移电子数增多
D.改变某一条件,若焦炭量随之增多,则气体密度增大
③达到化学平衡之后,保持其他条件不变,移走少量CO,达到新的平衡时,下列选项中,增大的是___________ (填选项编号)。
A.CO2和CO浓度比 B.混合气体的密度 C.CO2转化率 D.CO的体积分数
(1)锗原子的最外层电子排布式:
a.只有金属性 b.只有非金属性 c. 既有金属性,又有非金属性
(2)硅可存在二氧化硅和碳化硅两种晶体,请结合原子结构等相关知识判断二者的熔点:前者
(3)某同学根据反应:SiO2 + 2C
 Si + 2CO↑,得出结论:碳的非金属性强于硅的反应。请对此给予评价并说明理由:
Si + 2CO↑,得出结论:碳的非金属性强于硅的反应。请对此给予评价并说明理由:(4)高温下,在2L容积固定的密闭容器中,用足量焦炭与一定量二氧化碳发生可逆反应C(s)+CO2(g)
 2CO(g)-Q,回答以下题
2CO(g)-Q,回答以下题①反应至10分钟后,混合气体质量增加了9.6g,则用这段时间内用CO表示的反应速率为
②反应
A.平衡时速率关系:2v(CO2)= v(CO)
B.压缩容器体积达新平衡,气体浓度增大的倍数:CO>CO2
C.升高温度转移电子数增多
D.改变某一条件,若焦炭量随之增多,则气体密度增大
③达到化学平衡之后,保持其他条件不变,移走少量CO,达到新的平衡时,下列选项中,增大的是
A.CO2和CO浓度比 B.混合气体的密度 C.CO2转化率 D.CO的体积分数
您最近一年使用:0次
7 . 化学反应过程中既有物质变化,又有能量变化。释放或吸收热量是化学反应中能量变化的主要形式之一
(1)甲烷具有较大的燃烧热( ),是常见燃料。请写出甲烷燃烧的热化学反应方程式
),是常见燃料。请写出甲烷燃烧的热化学反应方程式_______ 。
(2)①工业上高纯硅可通过下列反应制取: 该反应的反应热
该反应的反应热
_______  。
。
已知:
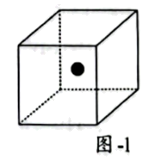
②硅晶体结构与金刚石类似。题图-1所示立方体体心的“●”表示晶体中的一个Si原子,请在立方体的顶点用“●”表示出与之紧邻的所有硅原子。________
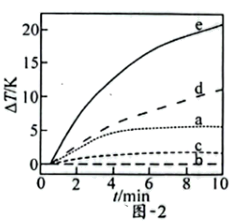
(3)自发热材料在生活中的应用日益广泛。某实验小组为探究“CaO-Al- ”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值(
”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值( )随时间(t)的变化曲线,如图-2所示。
)随时间(t)的变化曲线,如图-2所示。
已知:I.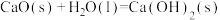
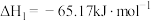
II.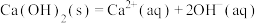
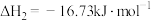
III.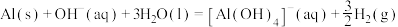
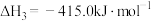
①实验b中,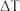 的变化说明Al粉与
的变化说明Al粉与 在该条件下
在该条件下_______ (填“反应”或“不反应”)。
②实验c中,前3min的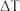 有变化,其原因是
有变化,其原因是_______ ;3min后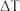 基本不变,其原因是
基本不变,其原因是_______ 。
③实验d在10min内温度持续升高的原因是_______ 。
④实验e中发生的总反应可表示为: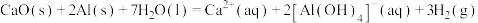 ,其
,其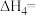
_______ 。
五组实验对比,e放热效果最好。
(1)甲烷具有较大的燃烧热(
 ),是常见燃料。请写出甲烷燃烧的热化学反应方程式
),是常见燃料。请写出甲烷燃烧的热化学反应方程式(2)①工业上高纯硅可通过下列反应制取:
 该反应的反应热
该反应的反应热
 。
。已知:
| 化学键 | Si-Cl | H-H | H-Cl | Si-Si |
键能/ | 360 | 436 | 431 | 176 |
②硅晶体结构与金刚石类似。题图-1所示立方体体心的“●”表示晶体中的一个Si原子,请在立方体的顶点用“●”表示出与之紧邻的所有硅原子。

(3)自发热材料在生活中的应用日益广泛。某实验小组为探究“CaO-Al-
 ”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值(
”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值(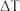 )随时间(t)的变化曲线,如图-2所示。
)随时间(t)的变化曲线,如图-2所示。| 实验编号 | 反应物组成 |
| a | 0.20gCaO粉末、5.0mL |
| b | 0.15gAl粉、5.0mL |
| c | 0.15gAl粉、5.0mL饱和石灰水 |
| d | 0.15gAl粉、5.0mL石灰乳 |
| e | 0.15gAl粉、0.20gCaO粉末 5.0mL |

已知:I.
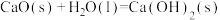
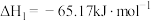
II.
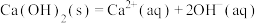
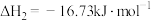
III.
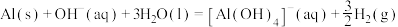
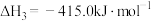
①实验b中,
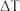 的变化说明Al粉与
的变化说明Al粉与 在该条件下
在该条件下②实验c中,前3min的
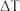 有变化,其原因是
有变化,其原因是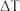 基本不变,其原因是
基本不变,其原因是③实验d在10min内温度持续升高的原因是
④实验e中发生的总反应可表示为:
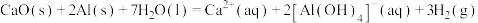 ,其
,其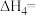
五组实验对比,e放热效果最好。
您最近一年使用:0次
名校
8 . 有关晶体的结构如图所示,下列说法错误的是
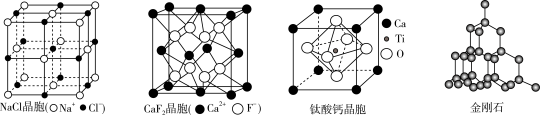

| A.在NaCl晶胞中,距Na+最近的Cl-有6个 |
B.在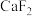 晶胞中,每个晶胞平均有4个 晶胞中,每个晶胞平均有4个 |
C.钛酸钙的化学式为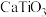 |
D.在金刚石晶体中,碳原子与碳碳键的个数之比为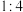 |
您最近一年使用:0次
2022-11-08更新
|
478次组卷
|
2卷引用:广东省广州市玉岩中学2022-2023学年高二下学期期中考试化学试题
12-13高二上·四川遂宁·期中
名校
解题方法
9 . 下列说法错误的是
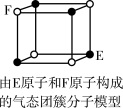
A.从CH4、 、 、 为正四面体结构,可推测PH 为正四面体结构,可推测PH 、 、 也为正四面体结构 也为正四面体结构 |
| B.1mol金刚石晶体中,平均含有2molC-C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
| D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
您最近一年使用:0次
2022-10-31更新
|
243次组卷
|
8卷引用:2012-2013学年四川省遂宁二中高二上学期期中考试化学试卷
名校
10 . 下列关于共价晶体、分子晶体的叙述中,正确的是
| A.金刚石为共价键三维骨架结构,晶体中的最小环上有6个碳原子 |
| B.分子晶体中一定存在共价键 |
| C.HI的相对分子质量大于HF,所以HI的沸点高于HF |
| D.在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键 |
您最近一年使用:0次
2022-09-27更新
|
571次组卷
|
3卷引用:湖北省武汉市钢城第四中学2021-2022学年高二下学期期中考试化学试题



