名校
1 . 硫脲 在药物制备、金属矿物浮选等方面有广泛应用。实验室中先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中先制备 ,然后
,然后 再与CaCN2合成
再与CaCN2合成 ,实验装置(夹持及加热装置略)如图所示。
,实验装置(夹持及加热装置略)如图所示。 易溶于水,易被氧化,受热时部分发生异构化生成NH4SCN。
易溶于水,易被氧化,受热时部分发生异构化生成NH4SCN。
回答下列问题:
(1)实验前先检查装置气密性,操作为:①在E中加水至浸没导管末端,……;②微热A处三颈烧瓶,观察到E处导管末端有气泡冒出,移走酒精灯;③一段时间后,E处导管末端形成一段水柱,且高度不变。将操作①补充完整_______ 。
(2)检查气密性后加入药品,装置A中的试剂最佳组合是_______ (填字母),打开K2。
A.FeS固体+浓硫酸 B.FeS固体+稀硝酸 C.FeS固体+稀盐酸
装置B中盛装的试剂为_______ 。待A中反应结束后关闭K2,打开K1通N2一段时间,目的是_______ 。
(3)撤走搅拌器,打开K3,水浴加热D处三颈烧瓶,在80℃时合成硫脲,同时生成一种常见的碱。控制温度在80℃的原因是_______ ,D处合成硫脲的化学方程式为_______ 。
(4)将装置D中液体过滤后,结晶得到粗产品。测定粗产品中硫脲纯度:称取mg产品,加水溶解配成500mL溶液,量取25mL于锥形瓶中,滴加一定量的稀硫酸使溶液显酸性,用cmol⋅L-1KMnO4标准溶液滴定,滴定至终点时消耗KMnO4标准溶液VmL。
①硫脲 中硫元素的化合价为
中硫元素的化合价为_______ 价。
②滴定时,硫脲转化为CO2、N2、 的离子方程式为
的离子方程式为_______ 。
③样品中硫脲的质量分数为_______ (用含“m,c、V”的式子表示)。
 在药物制备、金属矿物浮选等方面有广泛应用。实验室中先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中先制备 ,然后
,然后 再与CaCN2合成
再与CaCN2合成 ,实验装置(夹持及加热装置略)如图所示。
,实验装置(夹持及加热装置略)如图所示。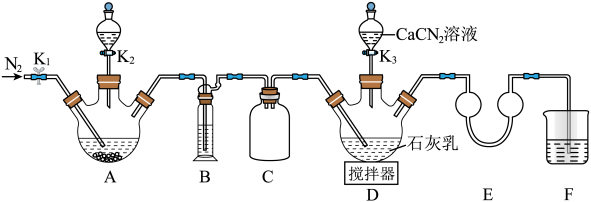
 易溶于水,易被氧化,受热时部分发生异构化生成NH4SCN。
易溶于水,易被氧化,受热时部分发生异构化生成NH4SCN。回答下列问题:
(1)实验前先检查装置气密性,操作为:①在E中加水至浸没导管末端,……;②微热A处三颈烧瓶,观察到E处导管末端有气泡冒出,移走酒精灯;③一段时间后,E处导管末端形成一段水柱,且高度不变。将操作①补充完整
(2)检查气密性后加入药品,装置A中的试剂最佳组合是
A.FeS固体+浓硫酸 B.FeS固体+稀硝酸 C.FeS固体+稀盐酸
装置B中盛装的试剂为
(3)撤走搅拌器,打开K3,水浴加热D处三颈烧瓶,在80℃时合成硫脲,同时生成一种常见的碱。控制温度在80℃的原因是
(4)将装置D中液体过滤后,结晶得到粗产品。测定粗产品中硫脲纯度:称取mg产品,加水溶解配成500mL溶液,量取25mL于锥形瓶中,滴加一定量的稀硫酸使溶液显酸性,用cmol⋅L-1KMnO4标准溶液滴定,滴定至终点时消耗KMnO4标准溶液VmL。
①硫脲
 中硫元素的化合价为
中硫元素的化合价为②滴定时,硫脲转化为CO2、N2、
 的离子方程式为
的离子方程式为③样品中硫脲的质量分数为
您最近一年使用:0次
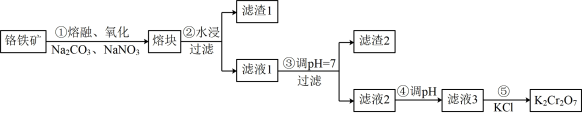
2 . 铬铁矿的主要成分为FeO▪Cr2O3, 制备K2Cr2O7流程如图所示:
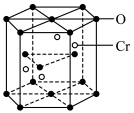
(1)基态Cr原子价电子轨道分布图为__________ ,铬位于元素周期表中__________ 区。
(2)配合物[Cr(NH3)4(H2O)2]Cl中提供电子对形成配位键的原子是__________ ,中心离子的配位数为_________ 。
(3)铬的一种氧化物晶胞结构如图所示,若六棱柱的底面边长为lnm,高为hnm,NA代表同伏加德罗常数的值,则该晶体的密度p=__________ g/cm3。 形式存在。则该步主要反应的方程为
形式存在。则该步主要反应的方程为__________ ,该步骤不能使用陶瓷容器,原因是__________ 。
(5)步骤④调滤液2的pH使之变__________ (填“大”或“小”)。原因是__________ (用离子方程式表示)。
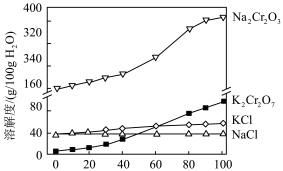
(6)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,分离得到K2Cr2O7固体的方法是__________ ,冷却到__________ (填标号)得到的K2Cr2O7固体产品最多。
(7)已知Ksp(Ag2CrO4 )=1.0×10-12、Ksp(AgCl)=2.0×10-10, 若用10LNaCl溶液溶解0.1mol的Ag2CrO4固体,则NaCl溶液的最初浓度不得低于__________ mol/L。
(1)基态Cr原子价电子轨道分布图为
(2)配合物[Cr(NH3)4(H2O)2]Cl中提供电子对形成配位键的原子是
(3)铬的一种氧化物晶胞结构如图所示,若六棱柱的底面边长为lnm,高为hnm,NA代表同伏加德罗常数的值,则该晶体的密度p=
 形式存在。则该步主要反应的方程为
形式存在。则该步主要反应的方程为(5)步骤④调滤液2的pH使之变
(6)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,分离得到K2Cr2O7固体的方法是
(7)已知Ksp(Ag2CrO4 )=1.0×10-12、Ksp(AgCl)=2.0×10-10, 若用10LNaCl溶液溶解0.1mol的Ag2CrO4固体,则NaCl溶液的最初浓度不得低于
您最近一年使用:0次
3 . 根据实验操作及现象,能得出相应结论的是
| 选项 | 实验操作及现象 | 结论 |
| A | 常温下将铁片插入浓硝酸中,无明显现象 | 铁片与浓硝酸不反应 |
| B | 向溴水中加入苯,充分振荡后静置,水层颜色变浅 | 溴与苯发生了取代反应 |
| C | 麦芽糖与稀硫酸共热后,加氢氧化钠溶液调至碱性,再加入新制氢氧化铜并加热,有砖红色沉淀生成 | 麦芽糖已发生水解 |
| D | 向硫酸四氨合铜溶液中加入无水乙醇,并用玻璃棒摩擦试管壁,有深蓝色晶体析出 | 乙醇极性小,降低了硫酸四氨合铜的溶解度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
4 . 东晋《华阳国志•南中志》已有白铜(铜镍合金)的记载,回答下列问题:
(1)镍元素基态原子的电子排布式为______ ,3d能级上的未成对的电子数为______ 。
(2)硫酸镍溶于氨水形成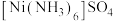 蓝色溶液,在
蓝色溶液,在 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为______ ,配位原子是______ , 中阴离子的立体构型是
中阴离子的立体构型是______ 。
(3)单质铜及镍都是由______ 键形成的晶体,元素铜与镍的第二电离能分别为: kJ⋅mol
kJ⋅mol ,
,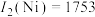 kJ⋅mol
kJ⋅mol ,
,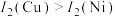 的原因是
的原因是____________ 。
(4)现有La、Ni合金是较为理想的储氢材料,其晶胞结构如图1所示:______ 。
②已知晶胞参数边长为a nm,高为b nm,设阿伏加德罗常数的值为 。若一个晶胞内可以储存18个氢原子,则储氢后的晶胞密度为
。若一个晶胞内可以储存18个氢原子,则储氢后的晶胞密度为______ g·cm 。
。
(5)用含镍废料(含镍、铝、氧化铁、碳等杂质)提取蓄电池材料 ,流程如图2所示:
,流程如图2所示: 易溶于水,
易溶于水, 不能氧化
不能氧化 。
。
①酸浸时镍的浸出率与温度的关系如图3所示,温度高于40℃时镍的浸出率开始下降,主要原因可能是____________ (从两个角度分析)。
②证明“沉镍”中, 已经沉淀完全的实验步骤及现象为
已经沉淀完全的实验步骤及现象为____________ 。
③电解过程产生的氯气在弱碱条件下生成了 ,再把二价镍氧化为三价镍,写出“氧化”反应的离子方程式
,再把二价镍氧化为三价镍,写出“氧化”反应的离子方程式____________ 。
(1)镍元素基态原子的电子排布式为
(2)硫酸镍溶于氨水形成
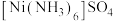 蓝色溶液,在
蓝色溶液,在 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为 中阴离子的立体构型是
中阴离子的立体构型是(3)单质铜及镍都是由
 kJ⋅mol
kJ⋅mol ,
,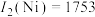 kJ⋅mol
kJ⋅mol ,
,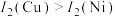 的原因是
的原因是(4)现有La、Ni合金是较为理想的储氢材料,其晶胞结构如图1所示:
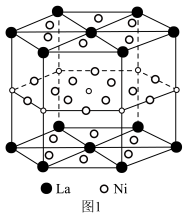
②已知晶胞参数边长为a nm,高为b nm,设阿伏加德罗常数的值为
 。若一个晶胞内可以储存18个氢原子,则储氢后的晶胞密度为
。若一个晶胞内可以储存18个氢原子,则储氢后的晶胞密度为 。
。(5)用含镍废料(含镍、铝、氧化铁、碳等杂质)提取蓄电池材料
 ,流程如图2所示:
,流程如图2所示: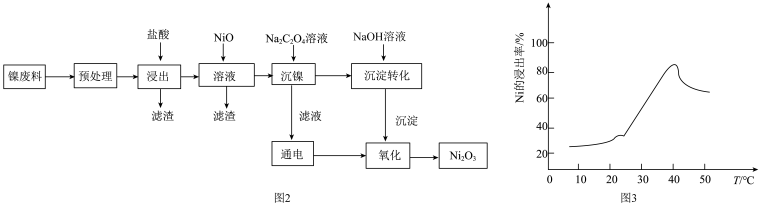
 易溶于水,
易溶于水, 不能氧化
不能氧化 。
。①酸浸时镍的浸出率与温度的关系如图3所示,温度高于40℃时镍的浸出率开始下降,主要原因可能是
②证明“沉镍”中,
 已经沉淀完全的实验步骤及现象为
已经沉淀完全的实验步骤及现象为③电解过程产生的氯气在弱碱条件下生成了
 ,再把二价镍氧化为三价镍,写出“氧化”反应的离子方程式
,再把二价镍氧化为三价镍,写出“氧化”反应的离子方程式
您最近一年使用:0次
解题方法
5 . 某废催化剂含SiO2、ZnO、ZnS和CuS,欲“变废为宝”,实验室中从该废催化剂中回收锌和铜的一种流程如下图所示。
(1)在步骤①浸出反应中,生成气体的化学品标识是________(填标号)。
(2)下列叙述中涉及到与该流程中的“操作②”相同操作的是________
A.《肘后备急方》中治疟疾:“青蒿一握,以水升渍,绞取汁,尽服之”
B.《开宝本草》中获取硝酸钾:“冬月地上有霜,扫取以水淋汁后,乃煎炼而成”
C.《本草衍义》中精制砒霜:“将生砒就置火上,以器覆之,令砒烟上飞着覆器”
(3)步骤④中,获得晶体的实验操作步骤是________________ 、______________ 、过滤、洗涤、干燥。
(4)向盛有滤渣1的反应器中加入稀硫酸和过氧化氢溶液加热浸出,该过程应先加入的试剂为_______ ,步骤③中生成单质硫,写出该反应的离子方程式_________________ ,生成的铜离子对于过氧化氢的分解具有催化作用,其化学反应方程式为__________________ 。
(5)设计如图装置测定一定质量的废催化剂中硫化锌的含量。室温下,向恒压分液漏斗中加入足量0.5 mol/L H2SO4溶液,乙丙连通管中盛有饱和NaHS溶液,乙管实验前对应气体体积读数为V1 mL,甲中完全反应后乙管气体体积读数为V2 mL(V2>V1)。________________ 。
②若实验结束时,未调平乙管和丙管的液面,且丙管的液面高于乙管,所测得产品中硫化锌的含量________________ (填“偏高”或“偏低”)。
(6)已知该废催化剂中含12%的CuS,实验中称取20.0 g废催化剂最终得到4.0 gCuSO4·5H2O(M=250g/mol),则铜的回收率为________________ 。

(1)在步骤①浸出反应中,生成气体的化学品标识是________(填标号)。
A. | B. | C. | D. |
(2)下列叙述中涉及到与该流程中的“操作②”相同操作的是
A.《肘后备急方》中治疟疾:“青蒿一握,以水升渍,绞取汁,尽服之”
B.《开宝本草》中获取硝酸钾:“冬月地上有霜,扫取以水淋汁后,乃煎炼而成”
C.《本草衍义》中精制砒霜:“将生砒就置火上,以器覆之,令砒烟上飞着覆器”
(3)步骤④中,获得晶体的实验操作步骤是
(4)向盛有滤渣1的反应器中加入稀硫酸和过氧化氢溶液加热浸出,该过程应先加入的试剂为
(5)设计如图装置测定一定质量的废催化剂中硫化锌的含量。室温下,向恒压分液漏斗中加入足量0.5 mol/L H2SO4溶液,乙丙连通管中盛有饱和NaHS溶液,乙管实验前对应气体体积读数为V1 mL,甲中完全反应后乙管气体体积读数为V2 mL(V2>V1)。

②若实验结束时,未调平乙管和丙管的液面,且丙管的液面高于乙管,所测得产品中硫化锌的含量
(6)已知该废催化剂中含12%的CuS,实验中称取20.0 g废催化剂最终得到4.0 gCuSO4·5H2O(M=250g/mol),则铜的回收率为
您最近一年使用:0次
解题方法
6 . 抗血栓药物氯吡格雷的重要中间体之一“2―噻吩乙醇”( )的制备步骤如下:
)的制备步骤如下: ,静置,过滤 ⑤进行________,分离出四氢呋喃、噻吩和液体X等杂质 ⑥得到ng产品。
,静置,过滤 ⑤进行________,分离出四氢呋喃、噻吩和液体X等杂质 ⑥得到ng产品。
按要求回答下列问题:
(1)步骤ⅰ中液体X可以选择_______ 。
a.水 b.甲苯 c.乙醇 d.苯酚
(2)写出步骤ⅰ制2-噻吩钠的化学方程式为_______ 。
(3)步骤ⅱ,加入溶液的方式为________ (填“缓慢加入”或“一次性加入”)。
(4)写出步骤ⅲ中用盐酸调节pH的化学方程式:________ 。加入无水 的作用为
的作用为___________ 。
(5)步骤ⅲ中⑤的操作的名称为_______ ;写出选择此分离提纯方法的理由是_______ 。
(6)产品“2―噻吩乙醇”( )的产率为
)的产率为_______ (用含m、n的代数式表示)。
(7)某次平行实验所得产品质量比ng低些,写出其中一种可能的原因:_______ 。
 )的制备步骤如下:
)的制备步骤如下: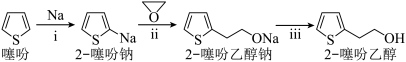
ⅱ.制噻吩乙醇钠:降温至−10℃,加入稍过量的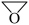 的四氢呋喃溶液,反应30min(四氢呋喃
的四氢呋喃溶液,反应30min(四氢呋喃 是有机溶剂,沸点66℃,可防止因反应放热而导致温度过高而引发副反应)。
是有机溶剂,沸点66℃,可防止因反应放热而导致温度过高而引发副反应)。
 ,静置,过滤 ⑤进行________,分离出四氢呋喃、噻吩和液体X等杂质 ⑥得到ng产品。
,静置,过滤 ⑤进行________,分离出四氢呋喃、噻吩和液体X等杂质 ⑥得到ng产品。按要求回答下列问题:
(1)步骤ⅰ中液体X可以选择
a.水 b.甲苯 c.乙醇 d.苯酚
(2)写出步骤ⅰ制2-噻吩钠的化学方程式为
(3)步骤ⅱ,加入溶液的方式为
(4)写出步骤ⅲ中用盐酸调节pH的化学方程式:
 的作用为
的作用为(5)步骤ⅲ中⑤的操作的名称为
(6)产品“2―噻吩乙醇”(
 )的产率为
)的产率为(7)某次平行实验所得产品质量比ng低些,写出其中一种可能的原因:
您最近一年使用:0次
7 . 下列装置可以实现对应实验目的的是
|
|
| A.验证吸氧腐蚀 | B.分离乙醇和 |
|
|
C.制备 | D.测量 体积 体积 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
8 . 柱色谱法包含两个相,一个是固定相,一个是流动相。当两相相对运动时,反复多次地利用混合物中所含各组分分配平衡性质的差异,最后达到彼此分离的目的。茉莉醛( )是一种合成香料、制备苯莉醛的工艺流程如图所示。下列说法正确的是
)是一种合成香料、制备苯莉醛的工艺流程如图所示。下列说法正确的是
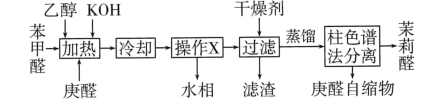
| A.乙醇的主要作用是助溶剂 |
| B.操作X为过滤 |
| C.可将最后两步“蒸馏”和“柱色谱法分离” 替换为“真空减压蒸馏” |
| D.可采用与浓硫酸共热的方法来除去产品中少量的庚醛自缩物 |
您最近一年使用:0次
9 . 四氧化三铁( )磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。
)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。
(1) 能和稀硫酸反应,生成的两种盐是
能和稀硫酸反应,生成的两种盐是___________ 。验证反应后溶液中含有 的最恰当的试剂是
的最恰当的试剂是___________ 。
A.氯水 B.酸性 溶液 C.KSCN溶液 D.NaOH溶液
溶液 C.KSCN溶液 D.NaOH溶液
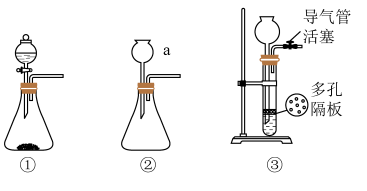
(2)铁粉在氧气中燃烧是制取 最为快捷的方法。A~D是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。
最为快捷的方法。A~D是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。___________ 。(从下图①、②、③中选择)
②在加入试剂之前,需对装置进行气密性检查。写出检查①的气密性的操作,___________ ,向分液漏斗中加足量水,塞紧玻璃塞,打开玻璃旋塞,过一会儿,水不再下滴,说明装置①的气密性良好。如果把分液漏斗改成恒压滴液漏斗,___________ (填“是”或“否”)可以用上述步骤检验装置的气密性?
③写出B装置中反应的化学方程式___________ 。
(3)氧化沉淀法也是制取 的一种常见方法,其制取流程如下图所示,
的一种常见方法,其制取流程如下图所示,___________ (填写化学式),由溶液N获得该副产品的操作是:加热浓缩→___________ →过滤洗涤→晶体加热至完全失去结晶水。
(4)某兴趣小组模仿上述流程制取 并测定其产率、具体操作如下:
并测定其产率、具体操作如下:
I.测定绿矾的含量:称取3.0g工业绿矾,配制成250.00mL溶液。量取25.00mL溶液于锥形瓶中,用0.01000 酸性
酸性 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的平均体积为20.00mL。写出滴定时发生反应的离子方程式为
溶液的平均体积为20.00mL。写出滴定时发生反应的离子方程式为___________ 。
Ⅱ.称取300g工业绿矾,通过上述流程最终制得:50g 计算产品
计算产品 的产率为
的产率为___________ 。(保留4位有效数字)
 )磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。
)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。(1)
 能和稀硫酸反应,生成的两种盐是
能和稀硫酸反应,生成的两种盐是 的最恰当的试剂是
的最恰当的试剂是A.氯水 B.酸性
 溶液 C.KSCN溶液 D.NaOH溶液
溶液 C.KSCN溶液 D.NaOH溶液(2)铁粉在氧气中燃烧是制取
 最为快捷的方法。A~D是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。
最为快捷的方法。A~D是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。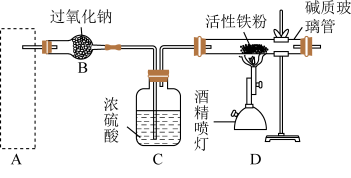
②在加入试剂之前,需对装置进行气密性检查。写出检查①的气密性的操作,
③写出B装置中反应的化学方程式
(3)氧化沉淀法也是制取
 的一种常见方法,其制取流程如下图所示,
的一种常见方法,其制取流程如下图所示,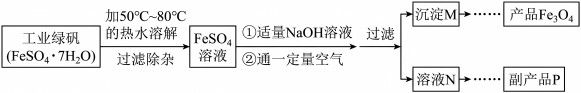
(4)某兴趣小组模仿上述流程制取
 并测定其产率、具体操作如下:
并测定其产率、具体操作如下:I.测定绿矾的含量:称取3.0g工业绿矾,配制成250.00mL溶液。量取25.00mL溶液于锥形瓶中,用0.01000
 酸性
酸性 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的平均体积为20.00mL。写出滴定时发生反应的离子方程式为
溶液的平均体积为20.00mL。写出滴定时发生反应的离子方程式为Ⅱ.称取300g工业绿矾,通过上述流程最终制得:50g
 计算产品
计算产品 的产率为
的产率为
您最近一年使用:0次
10 . 次氯酸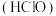 是极强氧化剂,在医疗、餐饮、家居清洁等方面有着重要应用,当前中国次氯酸产业规模庞大,位居全球前列。
是极强氧化剂,在医疗、餐饮、家居清洁等方面有着重要应用,当前中国次氯酸产业规模庞大,位居全球前列。
I.某学习小组设计下列装置制备 并验证其氧化性(夹持仪器及降温装置已省略)。
并验证其氧化性(夹持仪器及降温装置已省略)。
已知:①次氯酸的浓溶液呈黄色
② 为棕黄色气体,极易溶于水并迅速反应生成
为棕黄色气体,极易溶于水并迅速反应生成

回答下列问题:
(1) 中
中 元素的化合价为
元素的化合价为___________ , 的结构式为
的结构式为___________ , 俗称
俗称___________ (写出一个即可)。
(2)制备 时要打开
时要打开 ,关闭
,关闭 ,待装置
,待装置 中反应结束时再通入一段时间
中反应结束时再通入一段时间 。
。
①仪器 中制备
中制备 时,发生反应为
时,发生反应为 ,该反应的氧化剂为
,该反应的氧化剂为___________ (填化学式)。
②仪器B、D中的试剂分别为___________ (填字母)。
a.浓 b.饱和食盐水、
b.饱和食盐水、 c.饱和食盐水、浓
c.饱和食盐水、浓
③搅拌器的作用主要是___________ 。
(3)验证 的氧化性时要向
的氧化性时要向 中加入过量
中加入过量 并充分搅拌,待溶液变澄清时停止搅拌。反应结束时,
并充分搅拌,待溶液变澄清时停止搅拌。反应结束时, 的溶液中含有的离子主要有
的溶液中含有的离子主要有 ,写出反应的离子方程式
,写出反应的离子方程式___________ 。
II. 是次氯酸工业重要的衍生产品,某实验小组的同学测定
是次氯酸工业重要的衍生产品,某实验小组的同学测定 晶体的纯度过程如下:取样品
晶体的纯度过程如下:取样品 配制成
配制成 溶液,从中取出
溶液,从中取出 ,加入足量
,加入足量 固体和适量稀
固体和适量稀 ,再滴加几滴淀粉溶液,(已知:
,再滴加几滴淀粉溶液,(已知: ),然后用
),然后用 标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为
标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为 (已知:
(已知: )。
)。
(4)下列滴定操作会导致测量结果偏低的是___________ (填字母)。
a.锥形瓶洗涤后没有干燥 b.滴定时锥形瓶中有液体浅出
c.滴定终点时俯视读数 d.滴定管滴定前有气泡,滴定后气泡消失
(5)样品中 的纯度为
的纯度为___________ (用含 的代数式表示)。
的代数式表示)。
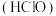 是极强氧化剂,在医疗、餐饮、家居清洁等方面有着重要应用,当前中国次氯酸产业规模庞大,位居全球前列。
是极强氧化剂,在医疗、餐饮、家居清洁等方面有着重要应用,当前中国次氯酸产业规模庞大,位居全球前列。I.某学习小组设计下列装置制备
 并验证其氧化性(夹持仪器及降温装置已省略)。
并验证其氧化性(夹持仪器及降温装置已省略)。已知:①次氯酸的浓溶液呈黄色
②
 为棕黄色气体,极易溶于水并迅速反应生成
为棕黄色气体,极易溶于水并迅速反应生成

回答下列问题:
(1)
 中
中 元素的化合价为
元素的化合价为 的结构式为
的结构式为 俗称
俗称(2)制备
 时要打开
时要打开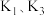 ,关闭
,关闭 ,待装置
,待装置 中反应结束时再通入一段时间
中反应结束时再通入一段时间 。
。①仪器
 中制备
中制备 时,发生反应为
时,发生反应为 ,该反应的氧化剂为
,该反应的氧化剂为②仪器B、D中的试剂分别为
a.浓
 b.饱和食盐水、
b.饱和食盐水、 c.饱和食盐水、浓
c.饱和食盐水、浓
③搅拌器的作用主要是
(3)验证
 的氧化性时要向
的氧化性时要向 中加入过量
中加入过量 并充分搅拌,待溶液变澄清时停止搅拌。反应结束时,
并充分搅拌,待溶液变澄清时停止搅拌。反应结束时, 的溶液中含有的离子主要有
的溶液中含有的离子主要有 ,写出反应的离子方程式
,写出反应的离子方程式II.
 是次氯酸工业重要的衍生产品,某实验小组的同学测定
是次氯酸工业重要的衍生产品,某实验小组的同学测定 晶体的纯度过程如下:取样品
晶体的纯度过程如下:取样品 配制成
配制成 溶液,从中取出
溶液,从中取出 ,加入足量
,加入足量 固体和适量稀
固体和适量稀 ,再滴加几滴淀粉溶液,(已知:
,再滴加几滴淀粉溶液,(已知: ),然后用
),然后用 标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为
标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为 (已知:
(已知: )。
)。(4)下列滴定操作会导致测量结果偏低的是
a.锥形瓶洗涤后没有干燥 b.滴定时锥形瓶中有液体浅出
c.滴定终点时俯视读数 d.滴定管滴定前有气泡,滴定后气泡消失
(5)样品中
 的纯度为
的纯度为 的代数式表示)。
的代数式表示)。
您最近一年使用:0次