解题方法
1 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe,还有少量其他不溶性物质。采用如图工艺流程回收其中的镍并制备硫酸镍晶体:
(1)“碱浸”中NaOH的作用有 ___________ 、___________ 。
(2)滤液②中含有的金属离子是 ___________。
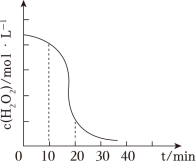
(3)“转化”步骤中H2O2的作用是 ___________ ,c(H2O2)随时间t的变化关系如图所示,反应开始10~20min内c(H2O2)迅速减小,原因可能是 ___________ 。(不考虑温度变化)
资料显示,硫酸镍结晶水合物的形态与温度有如表的关系:
(5)从滤液③中获得NiSO4•6H2O晶体的操作依次是 ___________ 、___________ 、过滤、洗涤、干燥。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其目的是___________ 。
实验室有一份NiSO4•xH2O样品,为测定其结晶水数目x,将4.188g样品加热至300℃充分反应,最终残留固体质量为2.328g。
(7)该样品中结晶水数目x为多少?___________ (结果精确至0.1,写出计算过程)
(8)再设计一种实验方案测定样品结晶水数目x(简述实验过程)。___________ 。

| 金属离子 | 开始沉淀时的pH | 沉淀完全时的pH |
| Ni2+ | 7.2 | 8.7 |
| Al3+ | 3.7 | 4.7 |
| Fe3+ | 2.2 | 3.2 |
| Fe2+ | 7.5 | 9.5 |
(2)滤液②中含有的金属离子是 ___________。
| A.Ni2+ | B.Al3+ | C.Fe3+ | D.Fe2+ |
| A.2.2 | B.3.2 | C.3.7 | D.4.7 |
资料显示,硫酸镍结晶水合物的形态与温度有如表的关系:
| 温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
| 晶体形态 | NiSO4•7H2O | NiSO4•6H2O | 多种结晶水合物 | NiSO4 |
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其目的是
实验室有一份NiSO4•xH2O样品,为测定其结晶水数目x,将4.188g样品加热至300℃充分反应,最终残留固体质量为2.328g。
(7)该样品中结晶水数目x为多少?
(8)再设计一种实验方案测定样品结晶水数目x(简述实验过程)。
您最近一年使用:0次
名校
解题方法
2 . 粉煤灰是燃煤产生的工业固体废料,主要成分有 、
、 ,还含有少量
,还含有少量 、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下:
、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下:
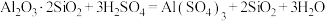

(1)“结晶”操作:缓缓加热,浓缩至___________ ,放置冷却,得到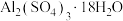 。
。
(2)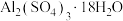 在250~300℃下失重40.5%得
在250~300℃下失重40.5%得 ,
,
___________ 。
(3)“还原焙烧”过程中发生反应的化学方程式为___________ 。
(4)设计实验检验粗氧化铝中是否含有 :
:___________ 。
(5)向硅酸钠溶液中通入过量 制备白炭黑的化学方程式为
制备白炭黑的化学方程式为___________ 。
 、
、 ,还含有少量
,还含有少量 、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下:
、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下: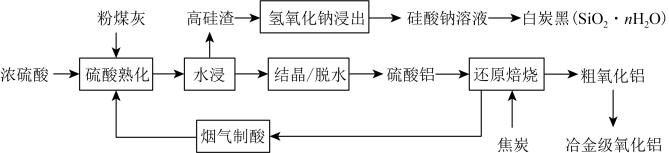
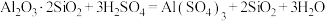

(1)“结晶”操作:缓缓加热,浓缩至
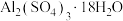 。
。(2)
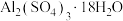 在250~300℃下失重40.5%得
在250~300℃下失重40.5%得 ,
,
(3)“还原焙烧”过程中发生反应的化学方程式为
(4)设计实验检验粗氧化铝中是否含有
 :
:(5)向硅酸钠溶液中通入过量
 制备白炭黑的化学方程式为
制备白炭黑的化学方程式为
您最近一年使用:0次
3 . 碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]是一种重要的无机化工产品。一种由白云石【主要成分为CaMg(CO3)2,含少量SiO2、Fe2O3等】为原料制备碱式碳酸镁的实验流程如下:___________ ,钙元素的主要存在形式是___________ (填化学式)。
(2)“热解”生成碱式碳酸镁的化学方程式为___________ 。
(3)该工艺为达到清洁生产,可以循环利用的物质是___________ (填化学式)。
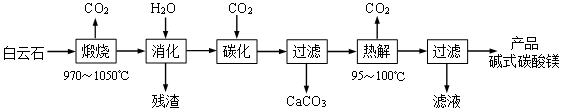
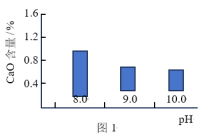
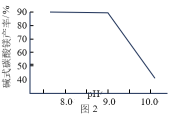
(2)“热解”生成碱式碳酸镁的化学方程式为
(3)该工艺为达到清洁生产,可以循环利用的物质是
您最近一年使用:0次
4 . FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下方法来制备无水FeCl2。有关物质的性质如下:
方法一:用H2还原无水FeCl3制取FeCl2。有关装置如下:____________ 。
(2)按气流由左到右的方向,上述仪器的连接顺序为____________。
(3)该制备装置的缺点为____________ 。
方法二:利用反应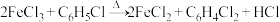 制取无水FeCl2,并通过测定HCl的量来计算FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.50g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却并持续通N2一段时间,分离提纯得到粗产品。
制取无水FeCl2,并通过测定HCl的量来计算FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.50g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却并持续通N2一段时间,分离提纯得到粗产品。_____________ 。
(5)仪器b中干燥剂可以选择_____________。
(6)反应结束后恢复至室温,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用最佳试剂是___________ 。
(7)回收滤液中C6H6Cl的操作方法是_____________。
(8)反应后将c中溶液稀释至250mL。量取25.00mL所配溶液,用0.400mol·L-1标准NaOH溶液滴定,终点时消耗标准液19.60mL。则氯化铁的转化率为___________ 。
(9)若反应后通入N2时间不足,则测得氯化铁的转化率______________ 。
A.偏低 B.偏高 C.不影响
(10)制备无水FeCl2需要用到无水FeCl3,某同学提出利用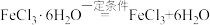 制备无水FeCl3。你认为该设想是否可行。若不可行,请说明理由;若可行,请简要叙述实验方
制备无水FeCl3。你认为该设想是否可行。若不可行,请说明理由;若可行,请简要叙述实验方_______________ 。
| C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯;易溶于乙醇,易吸水 | ||
| 熔点/℃ | -45 | 53 | 100℃时升华 | 672 |
| 沸点/℃ | 132 | 173 | >1000 | |
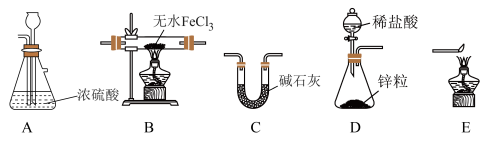
(2)按气流由左到右的方向,上述仪器的连接顺序为____________。
| A.D→C→B→A→E | B.D→A→B→C→E |
| C.D→B→A→C→E | D.D→C→A→B→E |
(3)该制备装置的缺点为
方法二:利用反应
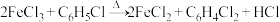 制取无水FeCl2,并通过测定HCl的量来计算FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.50g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却并持续通N2一段时间,分离提纯得到粗产品。
制取无水FeCl2,并通过测定HCl的量来计算FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.50g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却并持续通N2一段时间,分离提纯得到粗产品。
(5)仪器b中干燥剂可以选择_____________。
| A.碱石灰 | B.无水硫酸铜 | C.无水氯化钙 | D.浓硫酸 |
(6)反应结束后恢复至室温,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用最佳试剂是
(7)回收滤液中C6H6Cl的操作方法是_____________。
| A.萃取 | B.分液 | C.过滤 | D.蒸馏 |
(8)反应后将c中溶液稀释至250mL。量取25.00mL所配溶液,用0.400mol·L-1标准NaOH溶液滴定,终点时消耗标准液19.60mL。则氯化铁的转化率为
(9)若反应后通入N2时间不足,则测得氯化铁的转化率
A.偏低 B.偏高 C.不影响
(10)制备无水FeCl2需要用到无水FeCl3,某同学提出利用
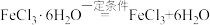 制备无水FeCl3。你认为该设想是否可行。若不可行,请说明理由;若可行,请简要叙述实验方
制备无水FeCl3。你认为该设想是否可行。若不可行,请说明理由;若可行,请简要叙述实验方
您最近一年使用:0次
解题方法
5 . 溶液法制取LiBF4的流程如下: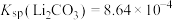 ,
,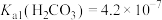 ,
,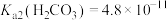 ;
;
ⅱ.反应①可以表示为: 。
。
(1)写出反应②的化学方程式:___________ 。室温条件下,反应②完成后若溶液中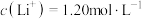 ,pH=8.0,则此时溶液中
,pH=8.0,则此时溶液中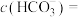
___________ 。
(2)对LiBF4粗品进一步提纯的方法称为______________ 。
(3)写出固相-气相接触法较溶液法制取LiBF4的一项优势:__________ 。

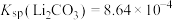 ,
,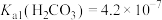 ,
,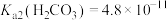 ;
;ⅱ.反应①可以表示为:
 。
。(1)写出反应②的化学方程式:
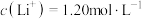 ,pH=8.0,则此时溶液中
,pH=8.0,则此时溶液中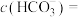
(2)对LiBF4粗品进一步提纯的方法称为
(3)写出固相-气相接触法较溶液法制取LiBF4的一项优势:
您最近一年使用:0次
解题方法
6 . 实验室模拟工业生产,利用废铜(含少量铁)和硫酸制备胆矾的过程如下:
1.灼烧后的固体用硫酸溶解。配制100 mL 1.50 mol·L-1 硫酸溶液,需用98%的硫酸(密度为1.84 g•cm-3)___________ mL(计算结果保留一位小数)。
2.粗CuSO4溶液中存在的正离子除Cu2+外,还有___________ 。
除杂操作为:在粗CuSO4溶液中滴加 3% H2O2溶液,再慢慢加入CuCO3粉末,调节溶液pH至一定范围,再加热至沸腾并过滤。
3.可用来替代CuCO3粉末的试剂是___________。
4.pH范围应控制在___________ 之间。
A. 1.9~9.0 B. 5.8~6.7 C. 3.2~4.7 D. 5.8~9.0
目的是___________ 。

| 离子 | Cu2+ | Fe2+ | Fe3+ |
| 开始沉淀时的pH | 4.7 | 5.8 | 1.9 |
| 完全沉淀时的pH | 6.7 | 9.0 | 3.2 |
1.灼烧后的固体用硫酸溶解。配制100 mL 1.50 mol·L-1 硫酸溶液,需用98%的硫酸(密度为1.84 g•cm-3)
2.粗CuSO4溶液中存在的正离子除Cu2+外,还有
除杂操作为:在粗CuSO4溶液中滴加 3% H2O2溶液,再慢慢加入CuCO3粉末,调节溶液pH至一定范围,再加热至沸腾并过滤。
3.可用来替代CuCO3粉末的试剂是___________。
| A.Na2CO3 | B.Cu(OH)2 | C.NaOH | D.CO2 |
A. 1.9~9.0 B. 5.8~6.7 C. 3.2~4.7 D. 5.8~9.0
目的是
您最近一年使用:0次
解题方法
7 . 已知:①2H2(g)+O2(g) =2H2O(l),ΔH1=-572 kJ·mol-1
②2H2O2(l) = 2H2O(l)+O2(g),ΔH2=-196 kJ·mol-1
1.请写出生产H2O2总反应的热化学方程式___________ 。
2.反应①中的ΔH1___________ (选填: A.是 B.否)为H2的燃烧热,原因为___________ 。
3.H2O2沸点为150.2℃,受热容易分解。某试剂厂欲将7%的过氧化氢溶液浓缩成30%的溶液,以下方法中可以采用的是___________。
②2H2O2(l) = 2H2O(l)+O2(g),ΔH2=-196 kJ·mol-1
1.请写出生产H2O2总反应的热化学方程式
2.反应①中的ΔH1
3.H2O2沸点为150.2℃,受热容易分解。某试剂厂欲将7%的过氧化氢溶液浓缩成30%的溶液,以下方法中可以采用的是___________。
| A.常压蒸馏 | B.减压蒸馏 | C.加热蒸发 | D.加氧化钙除水 |
您最近一年使用:0次
8 . 《本草衍义》中对精制砒霜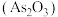 过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒霜上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”
过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒霜上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”
1.精制砒霜过程中涉及的分离提纯方法是 。
2.砒霜的晶体类型为 。
3.检验某混合物中是否含有砒霜,可通过砒霜、锌和盐酸混合反应,生成 来检验。下列说法正确的是 。
来检验。下列说法正确的是 。
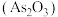 过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒霜上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”
过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒霜上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”1.精制砒霜过程中涉及的分离提纯方法是 。
| A.蒸馏 | B.升华 | C.干馏 | D.萃取 |
| A.分子晶体 | B.离子晶体 | C.共价晶体 | D.金属晶体 |
 来检验。下列说法正确的是 。
来检验。下列说法正确的是 。A. 是氧化产物 是氧化产物 | B. 的电子式: 的电子式: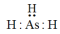 |
C.热稳定性: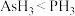 | D. 的空间结构:平面三角形 的空间结构:平面三角形 |
您最近一年使用:0次
解题方法
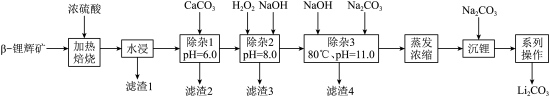
9 . 锂在电池领域的消费量最大,被称为“21世纪的能源金属”。
以β-锂辉矿石(主要成分为Li2O·Al2O3·4SiO2,还含有铁、镁、铝及钙的氧化物等杂质)为原料来制取碳酸锂的一种工艺流程如图:
浓硫酸的沸点是330℃。
部分金属离子沉淀的pH如下表:
1.滤渣2的主要成分是_____ ,“除杂2”步骤中氧化剂和还原剂的理论物质的量之比是_____ 。
已知Li2CO3和CaCO3在不同温度下的Ksp:
2.“除杂3”步骤中,原溶液中Ca2+和Li+浓度分别为4.0×10-4mol·L-1和5.0mol·L-1.通过列式计算说明不损失Li+的情况下,Ca2+是否能除尽(工业离子除尽要求是浓度小于1.0×10-6mol·L-1)_____ 。
3.Li2CO3在不同温度下的溶解度是:0℃1.54g,20℃1.33g,80℃0.85g,则系列操作为_____ 。
以β-锂辉矿石(主要成分为Li2O·Al2O3·4SiO2,还含有铁、镁、铝及钙的氧化物等杂质)为原料来制取碳酸锂的一种工艺流程如图:
浓硫酸的沸点是330℃。
部分金属离子沉淀的pH如下表:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ |
| 开始沉淀时(c=0.01mol/L)的pH | 2.2 | 3.7 | 7.5 | 9.6 | 13.37 |
| 沉淀完全时(c=1.0×10-5mol/L)的pH | 3.2 | 4.7 | 9.0 | 11.0 | — |
已知Li2CO3和CaCO3在不同温度下的Ksp:
| 20℃ | Ksp(Li2CO3)=2.5×10-2 | Ksp (CaCO3)=2.8×10-9 |
| 80℃ | Ksp (Li2CO3)=6.0×10-3 | Ksp (CaCO3)=4.0×10-9 |
3.Li2CO3在不同温度下的溶解度是:0℃1.54g,20℃1.33g,80℃0.85g,则系列操作为
您最近一年使用:0次
10 . Ⅰ.硒(Se)是一种重要的化学元素,在医药、农业、能源和电子等领域有广泛应用。
(1)以下不能用元素周期律解释的是___________。
(2)硒化铅可用作玻璃和陶瓷的着色剂,其晶胞结构如图所示:___________ 。
A.离子键 B.共价键
②晶体中每个Se周围与其最近的,且距离相等的Se有___________ 个。
Ⅱ.工业上以精炼铜的阳极泥为原料(主要成分为Se、CuSe、Ag2Se等)回收Se。
② 室温下Ksp(Ag2SO4)=10−5;Ksp(AgCl)=10−9.75。
(3)“焙烧”前,将阳极泥中大块颗粒粉碎的目的是___________ 。
(4)“烟气”中含有SO2和SeO2,被水吸收发生反应,SO2与和SeO2的物质的量之比为___________ ,SeO2体现了___________ 。
A.氧化性 B.还原性
(5)“提纯”步骤中用到真空蒸馏工艺,真空的作用是___________ 、___________ 。
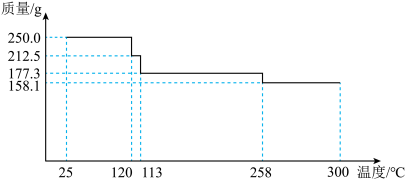
(6)小组同学测定某CuSO4∙xH2O晶体样品热分解的质量变化情况(如图所示),258℃失去全部结晶水,x=___________ 。(结果保留2位小数)___________ 。
Ⅲ.亚硒酸(H2SeO3)是主要的含硒化合物,是二元弱酸。常温下,H2SeO3溶液中某些微粒的物质的量分数与pH的关系如图所示:
(9)向滴有酚酞的H2SeO3溶液中加入氨水,当溶液由粉红色变为红色时,反应的离子方程式为___________ 。
(1)以下不能用元素周期律解释的是___________。
| A.键的极性:H−Se < H−Br | B.原子半径:Se > Br |
| C.稳定性:H2Se < HBr | D.酸性:H2SeO3 < HBrO4 |
(2)硒化铅可用作玻璃和陶瓷的着色剂,其晶胞结构如图所示:
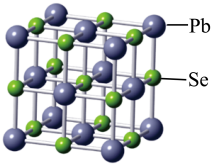
A.离子键 B.共价键
②晶体中每个Se周围与其最近的,且距离相等的Se有
Ⅱ.工业上以精炼铜的阳极泥为原料(主要成分为Se、CuSe、Ag2Se等)回收Se。
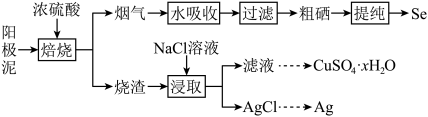
② 室温下Ksp(Ag2SO4)=10−5;Ksp(AgCl)=10−9.75。
(3)“焙烧”前,将阳极泥中大块颗粒粉碎的目的是
(4)“烟气”中含有SO2和SeO2,被水吸收发生反应,SO2与和SeO2的物质的量之比为
A.氧化性 B.还原性
(5)“提纯”步骤中用到真空蒸馏工艺,真空的作用是
(6)小组同学测定某CuSO4∙xH2O晶体样品热分解的质量变化情况(如图所示),258℃失去全部结晶水,x=
Ⅲ.亚硒酸(H2SeO3)是主要的含硒化合物,是二元弱酸。常温下,H2SeO3溶液中某些微粒的物质的量分数与pH的关系如图所示:
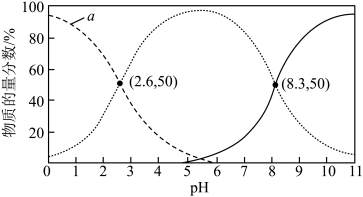
A.曲线a表示的是SeO 物质的量分数随pH变化 物质的量分数随pH变化 |
| B.Ka1=10−5.5 |
C.pH=3时, =100.4 =100.4 |
D.向H2SeO3溶液中逐滴加入NaOH溶液,pH=8.3时溶液中存在:2c(Na+)=3[c(HSeO )+ c(SeO )+ c(SeO )+ c(H2SeO3)] )+ c(H2SeO3)] |
(9)向滴有酚酞的H2SeO3溶液中加入氨水,当溶液由粉红色变为红色时,反应的离子方程式为
您最近一年使用:0次



