名校
1 . 锡在材料、医药、化工等方面有广泛的应用,锡精矿(SnO2)中主要有Fe、S、As、Sb、Pb等杂质元素。下图为锡的冶炼工艺流程:
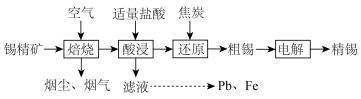
| A.焙烧产生的烟尘、烟气中主要杂质元素是S、As、Sb |
B.酸浸时,PbO生成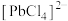 ,为了提高铅的浸出率,可添加适量NaCl固体 ,为了提高铅的浸出率,可添加适量NaCl固体 |
C.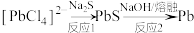 的反应2中S元素化合价全部升高 的反应2中S元素化合价全部升高 |
| D.电解精炼时,电源的正极与粗锡相连 |
您最近一年使用:0次
7日内更新
|
45次组卷
|
2卷引用:2024届吉林省长春吉大附中实验学校高三下学期考前适应考试化学试题
名校
解题方法
2 . 铼(Re)是一种贵金属。一种以辉钼矿(主要含有 ,还含有少量
,还含有少量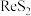 、
、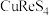 、FeS、
、FeS、 等)为原料制备铼的工艺流程如图:
等)为原料制备铼的工艺流程如图: 、
、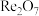 、
、 、CuO、
、CuO、 ,其中
,其中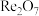 、
、 与氨水反应分别生成
与氨水反应分别生成 、
、 。下列说法错误的是
。下列说法错误的是
 ,还含有少量
,还含有少量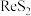 、
、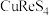 、FeS、
、FeS、 等)为原料制备铼的工艺流程如图:
等)为原料制备铼的工艺流程如图:
 、
、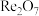 、
、 、CuO、
、CuO、 ,其中
,其中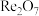 、
、 与氨水反应分别生成
与氨水反应分别生成 、
、 。下列说法错误的是
。下列说法错误的是A.废气中含有 |
B.滤渣的主要成分为 、CuO、 、CuO、 |
C.浸出时发生的反应有 |
| D.实验室用烧杯、漏斗、玻璃棒即可完成重结晶操作 |
您最近一年使用:0次
7日内更新
|
303次组卷
|
3卷引用:吉林省长春市东北师范大学附属实验学校2023-2024学年高三下学期七模化学试题
3 . 以辉锑矿(主要成分为Sb2S3,含少量As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示。下列说法错误的是
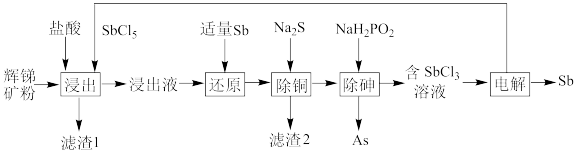
| A.“还原”过程加适量Sb目的是将SbCl5还原为SbCl3 |
| B.“除铜”时,不宜加过多的Na2S,是为了防止生成Sb2S3或产生有毒物质 |
C.“除砷”时有H3PO3生成,该反应的化学方程式为: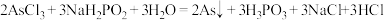 |
| D.“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为2:3 |
您最近一年使用:0次
4 . 化学与生产、生活、科技密切相关。下列说法错误的是
| A.港珠澳大桥使用高性能富锌底漆是依据外加电流法防腐 |
| B.“天和核心舱”电推进系统采用的氮化硼陶瓷属于新型无机非金属材料 |
| C.屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作 |
| D.农村推广风力发电、光伏发电有利于“碳达峰、碳中和” |
您最近一年使用:0次
解题方法
5 . 芳基亚胺酯是重要的有机反应中间体,受热易分解,可由腈在酸催化下与醇发生Pinner反应制备,原理如下图所示。
Ⅱ.向容器中持续通入HCl气体4小时,密封容器。
Ⅲ.室温下在HCl氛围中继续搅拌反应液24小时,冷却至0℃,抽滤得白色固体,用乙腈洗涤。
Ⅳ.将洗涤后的白色固体加入饱和Na2CO3溶液中,在15℃低温下反应,用有机溶剂萃取3次,合并有机相。
V.向有机相中加入无水硫酸钠,抽滤,蒸去溶剂得产品19.50g。
回答下列问题:
(1)实验室中可用浓盐酸和浓硫酸制备干燥HCl气体,下列仪器中一定需要的为_______ (填仪器名称)。_______ (填标号)。_______ ;实验中选择低温的原因为_______ 。
(4)第Ⅳ步萃取时可选用的有机溶剂为_______(填标号)。
(5)第Ⅳ将洗涤后的白色固体加入饱和Na2CO3溶液中,饱和Na2CO3的作用是_______ 。
(6)抽滤装置如下图所示,其相对于普通过滤的优点是_______ 。
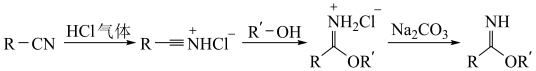
某实验小组以苯甲腈(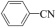 )和三氟乙醇(CF3CH2OH)为原料合成苯甲亚胺三氟乙酯。步骤如下:
)和三氟乙醇(CF3CH2OH)为原料合成苯甲亚胺三氟乙酯。步骤如下:
Ⅱ.向容器中持续通入HCl气体4小时,密封容器。
Ⅲ.室温下在HCl氛围中继续搅拌反应液24小时,冷却至0℃,抽滤得白色固体,用乙腈洗涤。
Ⅳ.将洗涤后的白色固体加入饱和Na2CO3溶液中,在15℃低温下反应,用有机溶剂萃取3次,合并有机相。
V.向有机相中加入无水硫酸钠,抽滤,蒸去溶剂得产品19.50g。
回答下列问题:
(1)实验室中可用浓盐酸和浓硫酸制备干燥HCl气体,下列仪器中一定需要的为

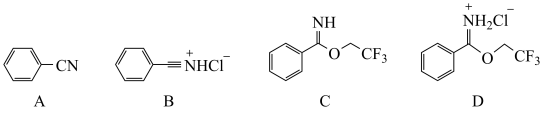
(4)第Ⅳ步萃取时可选用的有机溶剂为_______(填标号)。
| A.甲醇 | B.乙酸 | C.丙酮 | D.乙酸乙酯 |
(5)第Ⅳ将洗涤后的白色固体加入饱和Na2CO3溶液中,饱和Na2CO3的作用是
(6)抽滤装置如下图所示,其相对于普通过滤的优点是
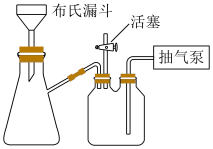
您最近一年使用:0次
6 . 从炼钢粉尘(主要含Fe3O4、Fe2O3和ZnO)中提取锌的流程如下: 并有少量Fe2+和Fe3+浸出。下列说法错误的是
并有少量Fe2+和Fe3+浸出。下列说法错误的是
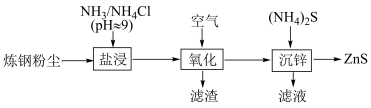
 并有少量Fe2+和Fe3+浸出。下列说法错误的是
并有少量Fe2+和Fe3+浸出。下列说法错误的是A. 中心离子采取sp3杂化 中心离子采取sp3杂化 |
B.“滤渣”的主要成分为 |
C.“沉锌”过程发生反应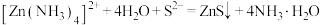 |
D.应合理控制 用量,以便滤液循环使用 用量,以便滤液循环使用 |
您最近一年使用:0次
2024-05-14更新
|
114次组卷
|
2卷引用:2024届东北三省四市教研联合体高三下学期高考模拟(二)化学试卷
名校
解题方法
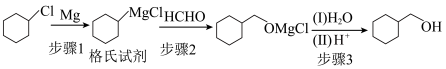
7 . 环己基甲醇是重要的有机合成中间体,其合成方法如下:
注意:①环已基甲醇120-140℃易发生脱水反应。
②涉及格氏试剂的反应需要在无水的条件下进行。
具体步骤如下:
 .制备
.制备
步骤1:(格氏试剂的制备)将2.67g镁条及10mL正丁醚加入250mL三颈烧瓶中,于恒压滴液漏斗中加入12.1mL(0.1mol)氯代环己烷和45mL正丁醚。水浴条件下逐滴滴加混合液,冷凝回流直至反应完毕。
步骤2:分批量加入10g干燥的多聚甲醛,加热至100-110℃,搅拌、反应0.5h。
步骤3:冷却反应混合物,加入30g碎冰,搅拌至水解完全,加入稀硫酸,分液。
 .环已基甲醇的分离和提纯
.环已基甲醇的分离和提纯
步骤4:向有机相中加入饱和氯化钠溶液,分液。
步骤5:向有机层加入无水碳酸钾,过滤,___________,得到产品6.3g。
回答下列问题:
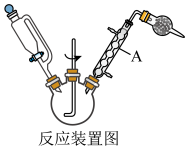
(1)反应装置中仪器A的名称为___________ ,实验中恒压滴液漏斗的作用是___________ 。
(2)环己基甲醇的沸点高于氯代环己烷主要原因是___________ 。
(3)制备过程中,步骤3水解反应(i)的方程式为___________ ,加入稀硫酸的作用为___________ 。
(4)分离提纯中,步骤 饱和氯化钠的作用
饱和氯化钠的作用___________ 。
(5)步骤5得到产品的操作为___________ 。
(6)产品的产率为___________ (用计算,精确至0.1%)。
| 物质 | 氯代环己烷 | 正丁醚 | 环己基甲醇 |
| 沸点 | 142℃ | 143℃ | 182℃(熔点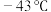 ) ) |
| 溶解性 | 难溶于水 | 难溶于水 | 难溶于水 |
| 密度 | 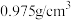 | 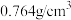 |  |
| 相对分子质量 | 118.5 | 139 | 114 |
②涉及格氏试剂的反应需要在无水的条件下进行。
具体步骤如下:
 .制备
.制备步骤1:(格氏试剂的制备)将2.67g镁条及10mL正丁醚加入250mL三颈烧瓶中,于恒压滴液漏斗中加入12.1mL(0.1mol)氯代环己烷和45mL正丁醚。水浴条件下逐滴滴加混合液,冷凝回流直至反应完毕。
步骤2:分批量加入10g干燥的多聚甲醛,加热至100-110℃,搅拌、反应0.5h。
步骤3:冷却反应混合物,加入30g碎冰,搅拌至水解完全,加入稀硫酸,分液。
 .环已基甲醇的分离和提纯
.环已基甲醇的分离和提纯步骤4:向有机相中加入饱和氯化钠溶液,分液。
步骤5:向有机层加入无水碳酸钾,过滤,___________,得到产品6.3g。
回答下列问题:
(1)反应装置中仪器A的名称为
(2)环己基甲醇的沸点高于氯代环己烷主要原因是
(3)制备过程中,步骤3水解反应(i)的方程式为
(4)分离提纯中,步骤
 饱和氯化钠的作用
饱和氯化钠的作用(5)步骤5得到产品的操作为
(6)产品的产率为
您最近一年使用:0次
8 . 黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4.黏土钒矿采用以下工艺流程可制备偏钒酸铵(NH4VO3)。
②钒元素的存在形态较多,部分四价钒和五价钒物种的分布分数δ与pH的关系如图所示,
(1)NH4+的VSEPR模型是___________ 形。
(2)“酸浸氧化”时,VO+、VO2+被氧化为VO2+,增大“酸浸氧化”速率的措施是___________ (任写一种)。
(3)“中和沉淀”时,滤饼②含有的沉淀有V2O5·xH2O以及___________ 。
(4)“沉淀转溶”时,V2O5·xH2O转化为钒酸盐溶解。滤液③中含有的阴离子有OH−以及___________ 。
(5)①“沉钒”时pH最好约为7且NH4Cl应过量,原因为___________ 。
②温度高于80℃时,沉钒率下降的原因是___________ (任写一种)。
(6)加热偏钒酸铵制备V2O5的化学方程式为___________ 。

| 金属离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 开始沉淀pH | 1.9 | 3.0 | 8.1 | 8.9 |
| 完全沉淀pH | 3.0 | 4.7 | 10.1 | 10.9 |

(1)NH4+的VSEPR模型是
(2)“酸浸氧化”时,VO+、VO2+被氧化为VO2+,增大“酸浸氧化”速率的措施是
(3)“中和沉淀”时,滤饼②含有的沉淀有V2O5·xH2O以及
(4)“沉淀转溶”时,V2O5·xH2O转化为钒酸盐溶解。滤液③中含有的阴离子有OH−以及
(5)①“沉钒”时pH最好约为7且NH4Cl应过量,原因为
②温度高于80℃时,沉钒率下降的原因是
(6)加热偏钒酸铵制备V2O5的化学方程式为
您最近一年使用:0次
9 . 历经十年传承积淀,形成精湛的东阿阿胶传统工艺,包括洗皮、泡皮、晾皮、刮毛、铡皮、化皮、打沫、除渣、浓缩、挂旗、凝胶、切胶等工序。下列工序与化学实验中的原理不具有对应关系的是
| 选项 | A | B | C | D |
| 工序 |
|
|
|
|
| 化学实验 |
|
|
|
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
10 . 在苯甲酸重结晶与粗盐提纯的实验操作过程中,均不需要用到的玻璃仪器为
| A.烧杯 | B.玻璃棒 | C.漏斗 | D.温度计 |
您最近一年使用:0次
2024-04-13更新
|
257次组卷
|
3卷引用:2024届吉林省长春吉大附中实验学校高三下学期考前适应考试化学试题