名校
1 . 下列实验操作能达到实验目的的是
| 实验操作 |
|
|
| 实验目的 | A.验证Cl2与FeCl2发生氧化还原反应 | B.NH4Cl和 制氨气 制氨气 |
| 实验操作 |
|
|
| 实验目的 | C.灼烧 失水制Fe2O3 失水制Fe2O3 | D.蒸馏分离苯(沸点:80℃)和硝基苯(沸点:210℃) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
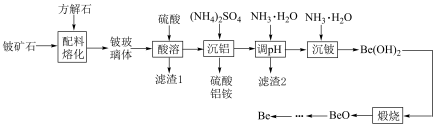
2 . Be是重要的战略性金属,其性质与铝相似。以铍矿石、方解石为原料制备铍的工艺流程如图所示: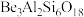 (氧化物形式为
(氧化物形式为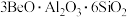 ),还含有Fe2O3(忽略其他元素对工艺流程的影响);方解石的主要成分为CaCO3;铍玻璃体的主要成分为CaAl2Si2O8、CaBe3SiO6,Fe2O3、SiO2;
),还含有Fe2O3(忽略其他元素对工艺流程的影响);方解石的主要成分为CaCO3;铍玻璃体的主要成分为CaAl2Si2O8、CaBe3SiO6,Fe2O3、SiO2;
②硫酸铝铵微溶于水;常温下,相关物质溶度积如下表所示:
回答下列问题:
(1)提高“配料熔化”时的反应速率及效率的措施为___________ (任写一条),该过程中主要反应的化学方程式为___________ 。
(2)“酸溶”时CaBe3SiO6发生反应的离子方程式为___________ 。
(3)常温下,“调pH”时所得滤液的pH为5,则“滤渣2”的成分为___________ (填化学式,下同)。该工业流程中可循环使用的物质为___________ 。
(4)常温时调节pH为7.5进行“沉铍”,通过计算判断 是否完全沉淀:
是否完全沉淀:___________ (溶液中离子浓度低于 时认为该离子完全沉淀);“沉铍”时不选用NaOH溶液的原因为
时认为该离子完全沉淀);“沉铍”时不选用NaOH溶液的原因为___________ (用离子方程式解释)。
(5)先将原料BeO与碳质还原剂压制成团块,再在高温下将其氯化为BeCl2,然后用镍坩埚为阴极,石墨棒为阳极,将等量的BeCl2与氯化钠混合熔融后进行电解,在___________ (填“阴”或“阳”)极上析出固态金属铍,该法的缺点为___________ 。
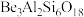 (氧化物形式为
(氧化物形式为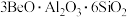 ),还含有Fe2O3(忽略其他元素对工艺流程的影响);方解石的主要成分为CaCO3;铍玻璃体的主要成分为CaAl2Si2O8、CaBe3SiO6,Fe2O3、SiO2;
),还含有Fe2O3(忽略其他元素对工艺流程的影响);方解石的主要成分为CaCO3;铍玻璃体的主要成分为CaAl2Si2O8、CaBe3SiO6,Fe2O3、SiO2;②硫酸铝铵微溶于水;常温下,相关物质溶度积如下表所示:
| 难溶物 |  |  | 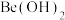 |
 | 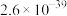 | 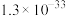 |  |
(1)提高“配料熔化”时的反应速率及效率的措施为
(2)“酸溶”时CaBe3SiO6发生反应的离子方程式为
(3)常温下,“调pH”时所得滤液的pH为5,则“滤渣2”的成分为
(4)常温时调节pH为7.5进行“沉铍”,通过计算判断
 是否完全沉淀:
是否完全沉淀: 时认为该离子完全沉淀);“沉铍”时不选用NaOH溶液的原因为
时认为该离子完全沉淀);“沉铍”时不选用NaOH溶液的原因为(5)先将原料BeO与碳质还原剂压制成团块,再在高温下将其氯化为BeCl2,然后用镍坩埚为阴极,石墨棒为阳极,将等量的BeCl2与氯化钠混合熔融后进行电解,在
您最近一年使用:0次
名校
3 .  是一种氧化剂、催化剂,以含铼废渣(含Re、
是一种氧化剂、催化剂,以含铼废渣(含Re、 、Fe、Ni和
、Fe、Ni和 等)为原料提取
等)为原料提取 的工艺如图所示。
的工艺如图所示。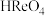 (强酸)、
(强酸)、 、
、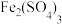 等。
等。
②离子交换中存在平衡: 。回答下列问题:
。回答下列问题:
(1)在元素周期表中,Re与Mn同族,则Re位于_______ 区。
(2)“粉碎过筛”的目的是_____ ,“焙烧”过程中 发生反应的化学方程式为
发生反应的化学方程式为_______ ,“反萃取”中试剂A的化学式为_______ 。
(3)“离子交换”中c(Cl-)变化如图所示。
(4)其他条件相同时,“离子交换”过程中料液和D296体积比与铼交换率、铼交换量的关系如图2所示,混合液的pH与铼提取率的关系如图3所示。_______ 。
②其他条件相同,混合液的pH>1.5时,铼提取率降低的主要原因可能是_______ 。
(5)Re有多种金属氧化物,其中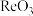 晶胞如图所示。已知NA代表阿伏加德罗常数的值,晶胞参数为a pm。
晶胞如图所示。已知NA代表阿伏加德罗常数的值,晶胞参数为a pm。_______ ,该晶体密度为_______ g·cm-3。
 是一种氧化剂、催化剂,以含铼废渣(含Re、
是一种氧化剂、催化剂,以含铼废渣(含Re、 、Fe、Ni和
、Fe、Ni和 等)为原料提取
等)为原料提取 的工艺如图所示。
的工艺如图所示。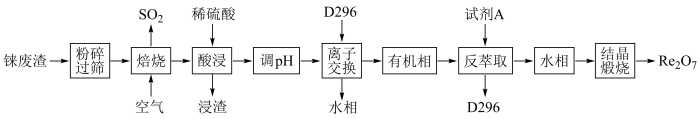
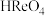 (强酸)、
(强酸)、 、
、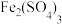 等。
等。②离子交换中存在平衡:
 。回答下列问题:
。回答下列问题:(1)在元素周期表中,Re与Mn同族,则Re位于
(2)“粉碎过筛”的目的是
 发生反应的化学方程式为
发生反应的化学方程式为(3)“离子交换”中c(Cl-)变化如图所示。
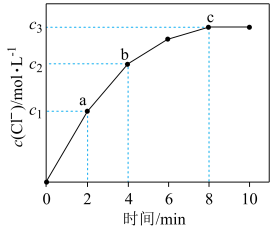
| A.正反应速率:c>b>a |
| B.8min时离子交换反应已停止 |
| C.向溶液中加入少量NaCl,离子交换反应的平衡常数减小 |
D.2~4min内 |
(4)其他条件相同时,“离子交换”过程中料液和D296体积比与铼交换率、铼交换量的关系如图2所示,混合液的pH与铼提取率的关系如图3所示。
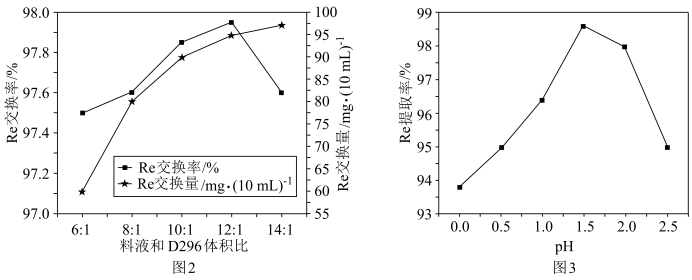
②其他条件相同,混合液的pH>1.5时,铼提取率降低的主要原因可能是
(5)Re有多种金属氧化物,其中
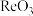 晶胞如图所示。已知NA代表阿伏加德罗常数的值,晶胞参数为a pm。
晶胞如图所示。已知NA代表阿伏加德罗常数的值,晶胞参数为a pm。
您最近一年使用:0次
名校
解题方法
4 . 实验室由1,3,5-三甲苯(密度为0.87gcm3)为主要有机原料制备2,4,6-三甲基苯甲酸的反应原理为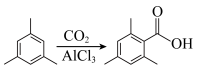 ;
;
| 物质 | 性状 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 1,3,5-三甲苯(Mr=120) | 无色液体 | -44.8 | 164.7 | 难溶于水、酸、碱 |
| 2,4,6-三甲基苯甲酸(Mr=164) | 白色固体 | 155 | 296 | 微溶于冷水,能溶于热水,易溶于碱 |
| 六甲基二苯甲酮 | 白色粉末 | 136 | 340 | 难溶于水、酸、碱 |
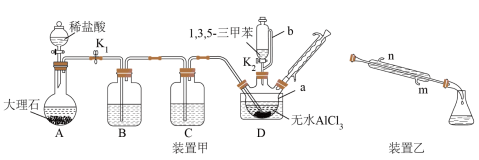
①在装置甲仪器a中加入8.0g无水AlCl3、20mL1,3,5-三甲苯,并控制温度40℃。
②打开分液漏斗活塞和K1,通入过量干燥纯净的CO2气体,加热D回流20~30min。
③关闭分液漏斗活塞和K1.取下球形冷凝管,接装置乙加热蒸馏,回收未反应完的1,3,5-三甲苯。
④将仪器a中的混合物倒入NaOH溶液中,调节pH至8~9,过滤。
⑤向滤液中加入稀盐酸调节pH=2,过滤、洗涤干燥,再将粗品进行纯化,得到19.0g白色固体。
回答下列问题:
(1)仪器b的名称为
(2)为获得干燥纯净的CO2气体,装置B、C中所盛试剂分别为
(3)装置乙中,冷凝水的进水口为
(4)步骤④中过滤得到的沉淀中包含Al(OH)3和六甲基二苯甲酮,从该沉淀中获得六甲基二苯甲酮的实验方法为
(5)①2,4,6-三甲基苯甲酸、②苯甲酸、③2,4,6-三氟苯甲酸,三种酸的酸性由强到弱的顺序为
(6)本实验的产率为
您最近一年使用:0次
2024-06-04更新
|
168次组卷
|
3卷引用:2024届江西省宜春市宜丰中学高三下学期模拟预测化学试题
名校
5 . 酸性条件下,砷酸具有较强氧化性,能被正四价硫、碘离子等还原为正三价砷。某工厂以废渣(主要含 )制备砷的流程如下:
)制备砷的流程如下:
(1)砷的原子结构示意图为_______ 。 的结构简式为
的结构简式为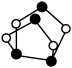 ,0.5mol
,0.5mol  所含有S-S键的物质的量为
所含有S-S键的物质的量为_______ mol。
(2)“碱浸”后溶液中含有 、
、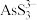 ,则该工序主反应的化学方程式为
,则该工序主反应的化学方程式为______________ 。
(3)“沉砷”时,加入试剂A的作用为_______ ;结合必要的化学用语说明为了提高 的产率,加石灰乳时控制温度45℃~85℃的目的是
的产率,加石灰乳时控制温度45℃~85℃的目的是_______ 。
(4)滤渣1含硫酸钙和沉淀a,实验室里,用_______ 试剂除去试管壁上的沉淀a。
(5)加热时“再还原”的化学方程式为_______ 。“还原”中,氧化产物与还原产物的物质的量之比为_______ 。
(6)该流程中可以循环使用的物质为_______ 。
(7)设计实验检验“还原”后的溶液中是否存在正五价砷元素_______ 。
 )制备砷的流程如下:
)制备砷的流程如下: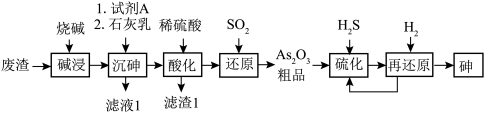
(1)砷的原子结构示意图为
 的结构简式为
的结构简式为 ,0.5mol
,0.5mol  所含有S-S键的物质的量为
所含有S-S键的物质的量为(2)“碱浸”后溶液中含有
 、
、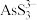 ,则该工序主反应的化学方程式为
,则该工序主反应的化学方程式为(3)“沉砷”时,加入试剂A的作用为
 的产率,加石灰乳时控制温度45℃~85℃的目的是
的产率,加石灰乳时控制温度45℃~85℃的目的是(4)滤渣1含硫酸钙和沉淀a,实验室里,用
(5)加热时“再还原”的化学方程式为
(6)该流程中可以循环使用的物质为
(7)设计实验检验“还原”后的溶液中是否存在正五价砷元素
您最近一年使用:0次
2024-06-03更新
|
79次组卷
|
2卷引用:2024年江西省宜春市第一中学高三下学期第三次模拟考试化学试卷
6 . 用铁泥(主要成分为 、FeO和少量Fe)制备超顺磁性纳米
、FeO和少量Fe)制备超顺磁性纳米 (平均直径为25nm)的流程图如下(所加试剂均过量,部分步骤已省略),下列叙述正确的是
(平均直径为25nm)的流程图如下(所加试剂均过量,部分步骤已省略),下列叙述正确的是
 、FeO和少量Fe)制备超顺磁性纳米
、FeO和少量Fe)制备超顺磁性纳米 (平均直径为25nm)的流程图如下(所加试剂均过量,部分步骤已省略),下列叙述正确的是
(平均直径为25nm)的流程图如下(所加试剂均过量,部分步骤已省略),下列叙述正确的是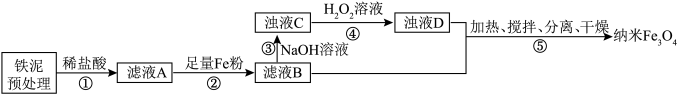
| A.滤液B的溶质主要为氯化铁 |
| B.步骤②中发生的反应均为置换反应 |
C.为防止在步骤⑤中继续氧化亚铁离子,步骤④反应完成后剩余的 需加热除去 需加热除去 |
D.将步骤⑤得到的纳米 均匀分散在水中时,不能产生丁达尔效应 均匀分散在水中时,不能产生丁达尔效应 |
您最近一年使用:0次
名校
解题方法
7 . 铬绿(Cr2O3)常用于制造颜料。以某工业烧渣(主要成分是Na2CrO4、Fe2O3、NaAlO2)为原料制备铬绿的流程如下。已知:“还原”中氧化产物为附加值高的单质。

| A.滤渣1主要成分是Fe2O3 |
| B.气体X为CO2、NH3或HCl |
| C.实验室“灼烧”时需要坩埚、酒精灯等仪器 |
D.“还原”时 (Na2CrO4)∶ (Na2CrO4)∶ (Na2S)=2∶3 (Na2S)=2∶3 |
您最近一年使用:0次
名校
解题方法
8 . 某实验小组以粗铍(含少量的Mg、Fe、Al、Cu、Si等)为原料制备、提纯BeCl2,并测定产品中BeCl2的含量。利用如图所示装置(夹持装置略)制BeCl2,实验开始前先通入一段时间的氩气。
②BeCl2溶于乙醚,不溶于苯,易发生水解;
③AlCl3溶于乙醚且溶于苯,FeCl2、MgCl2不溶于乙醚和苯;
④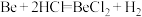 为放热反应。
为放热反应。
请回答下列问题:
(1)装置A中方框内的仪器M应为________ (填“直形冷凝管”或“球形冷凝管”),实验中装置A需置于温度15℃左右的水浴中,其主要目的是________ 。
(2)装置B中盛放的试剂为________ 。
(3)反应后,装置A中BeCl2的乙醚溶液先经过滤除去杂质________ ,再蒸馏滤液将乙醚蒸出得“固体”。为了除去“固体”中的其余杂质,可采取的操作为________ 。
(4)取 g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用
g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用 mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸
mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸 mL(已知:
mL(已知: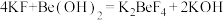 ;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为
;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为________ %(用含 、
、 和
和 的字母表示)。
的字母表示)。
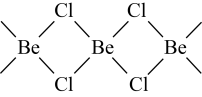
(5)氯化铍在气态时存在BeCl2分子(a)和二聚分子[(BeCl2)2](b),固态时则具有如下图所示的链状结构(c)。____ 。
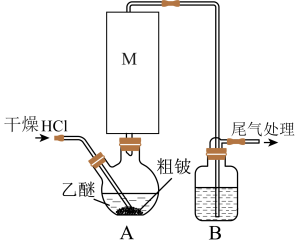
②BeCl2溶于乙醚,不溶于苯,易发生水解;
③AlCl3溶于乙醚且溶于苯,FeCl2、MgCl2不溶于乙醚和苯;
④
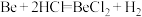 为放热反应。
为放热反应。请回答下列问题:
(1)装置A中方框内的仪器M应为
(2)装置B中盛放的试剂为
(3)反应后,装置A中BeCl2的乙醚溶液先经过滤除去杂质
(4)取
 g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用
g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用 mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸
mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸 mL(已知:
mL(已知: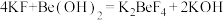 ;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为
;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为 、
、 和
和 的字母表示)。
的字母表示)。(5)氯化铍在气态时存在BeCl2分子(a)和二聚分子[(BeCl2)2](b),固态时则具有如下图所示的链状结构(c)。
您最近一年使用:0次
解题方法
9 .  (过碳酸钠)是一种集洗涤、漂白、杀菌于一体的氧化系漂白剂,是碳酸钠和过氧化氢形成的不稳定加合物,易溶于水,难溶于乙醇。制备相关资料如下。
(过碳酸钠)是一种集洗涤、漂白、杀菌于一体的氧化系漂白剂,是碳酸钠和过氧化氢形成的不稳定加合物,易溶于水,难溶于乙醇。制备相关资料如下。
制备装置:如图所示。
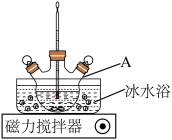
i.按图组装仪器,控制实验温度不超过15℃;
ii.往A中加入25mL的过氧化氢(质量分数为30%)、硫酸镁和硅酸钠各0.1g,控温搅拌至所有试剂完全溶解;
iii.冷却至一定温度,加入100mL饱和碳酸钠溶液,搅拌反应30min,静置结晶;
iv.利用真空泵抽滤,滤饼用无水乙醇洗涤2~3次,通风橱风干得到产品过碳酸钠,滤液回收利用。
回答下列问题:
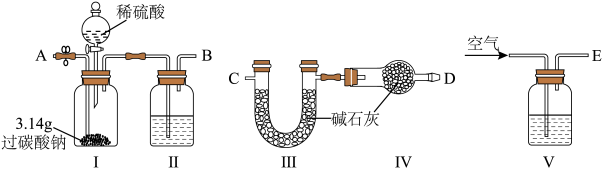
(1)仪器A的名称为___________ 。
(2)制备过程中,为了避免温度升高,导致产率下降,“加入100mL饱和碳酸钠溶液”的正确方法是___________ 。
(3)步骤iv用无水乙醇洗涤的原因是___________ 。
(4)下列有关过碳酸钠说法错误的是___________。
(5)采用下列装置验证过碳酸钠中碳酸钠和过氧化氢的物质的量之比是2∶3(不考虑过碳酸钠含有杂质)。 中的试剂为
中的试剂为___________ 。
②装置接口的连接顺序为___________ (用ABCDE字母表示)。
③若实验操作准确,则装置 理论上应增重
理论上应增重___________ g。
 (过碳酸钠)是一种集洗涤、漂白、杀菌于一体的氧化系漂白剂,是碳酸钠和过氧化氢形成的不稳定加合物,易溶于水,难溶于乙醇。制备相关资料如下。
(过碳酸钠)是一种集洗涤、漂白、杀菌于一体的氧化系漂白剂,是碳酸钠和过氧化氢形成的不稳定加合物,易溶于水,难溶于乙醇。制备相关资料如下。制备装置:如图所示。
i.按图组装仪器,控制实验温度不超过15℃;
ii.往A中加入25mL的过氧化氢(质量分数为30%)、硫酸镁和硅酸钠各0.1g,控温搅拌至所有试剂完全溶解;
iii.冷却至一定温度,加入100mL饱和碳酸钠溶液,搅拌反应30min,静置结晶;
iv.利用真空泵抽滤,滤饼用无水乙醇洗涤2~3次,通风橱风干得到产品过碳酸钠,滤液回收利用。
回答下列问题:
(1)仪器A的名称为
(2)制备过程中,为了避免温度升高,导致产率下降,“加入100mL饱和碳酸钠溶液”的正确方法是
(3)步骤iv用无水乙醇洗涤的原因是
(4)下列有关过碳酸钠说法错误的是___________。
| A.过碳酸钠是一种混合物 |
| B.过碳酸钠既具有碳酸钠的性质,又具有双氧水性质 |
| C.往酸性高锰酸钾溶液中加入足量过碳酸钠,溶液褪成无色 |
| D.过碳酸钠既可用作绿色漂白剂也可用作鱼塘供氧剂 |
(5)采用下列装置验证过碳酸钠中碳酸钠和过氧化氢的物质的量之比是2∶3(不考虑过碳酸钠含有杂质)。
 中的试剂为
中的试剂为②装置接口的连接顺序为
③若实验操作准确,则装置
 理论上应增重
理论上应增重
您最近一年使用:0次
名校
解题方法
10 . 从废旧镍钴锰三元锂电池正极材料[主要含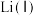 、
、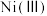 、
、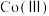 、
、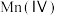 等金属的氧化物]中回收钴的一种流程如下:
等金属的氧化物]中回收钴的一种流程如下: 的形式存在。下列说法正确的是
的形式存在。下列说法正确的是
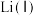 、
、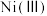 、
、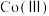 、
、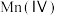 等金属的氧化物]中回收钴的一种流程如下:
等金属的氧化物]中回收钴的一种流程如下: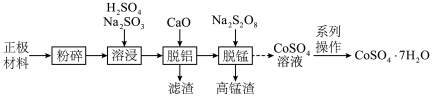
 的形式存在。下列说法正确的是
的形式存在。下列说法正确的是A.“溶浸”中 被还原 被还原 |
B.“脱铝”得到的滤渣成分是 |
C.“脱锰”的离子方程式为: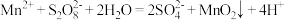 |
| D.“系列操作”含蒸发结晶、洗涤、干燥 |
您最近一年使用:0次
2024-05-29更新
|
201次组卷
|
2卷引用:2024届南昌市第十九中学高三下学期模拟预测化学试题