名校
解题方法
1 . 为除去括号内少量的杂质,所用的试剂或方法正确的是
| A.Fe粉(Cu粉):盐酸,过滤 |
B. :氧气,点燃 :氧气,点燃 |
C.除去KCl溶液中的少量 :加入适量NaOH溶液,过滤 :加入适量NaOH溶液,过滤 |
D. :饱和碳酸氢钠溶液,洗气 :饱和碳酸氢钠溶液,洗气 |
您最近一年使用:0次
2024-03-20更新
|
367次组卷
|
3卷引用:浙江省杭州市长河高级中学2023-2024学年高一上学期期末考试化学试题
浙江省杭州市长河高级中学2023-2024学年高一上学期期末考试化学试题浙江省宁波市九校2023-2024学年高一上学期1月期末化学试题(已下线)专题01 硫及其化合物(考点清单)(讲+练)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)
2 . 某含铬废水中含有一定浓度的 ,同时还含有少量的
,同时还含有少量的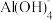 杂质,某研究小组为消除废水污染同时获得Cr2O3(铬绿),设计如下流程:
杂质,某研究小组为消除废水污染同时获得Cr2O3(铬绿),设计如下流程:

已知:在酸性环境中 的氧化性强于
的氧化性强于 。
。
(1)“滤渣”的主要成分为___________ (写化学式)。
(2)下列溶液中可以代替“还原”过程中Na2S2O5溶液的是___________(填标号)。
(3)已知常温下,Ksp[Cr(OH)3]=1.0×10-32。若“沉铬”后滤液中Cr3+恰好完全沉淀(即c(Cr3+)=1.0×10-5mol·L-1),则此时溶液的pH=___________ 。
(4)“沉铬”过程所用浓氨水也可换用浓碳酸钠溶液,此时除得到Cr(OH)3外,还会有大量气泡生成,试写出反应的离子方程式:___________ 。
(5)“滤液”中的 也可利用电解法还原为Cr3+,装置如图所示。
也可利用电解法还原为Cr3+,装置如图所示。

①则该装置的阳极区产生的Fe2+与 反应的离子方程式为
反应的离子方程式为___________ 。
②每还原1mol ,电路中通过
,电路中通过___________ mol电子。
 ,同时还含有少量的
,同时还含有少量的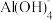 杂质,某研究小组为消除废水污染同时获得Cr2O3(铬绿),设计如下流程:
杂质,某研究小组为消除废水污染同时获得Cr2O3(铬绿),设计如下流程:
已知:在酸性环境中
 的氧化性强于
的氧化性强于 。
。(1)“滤渣”的主要成分为
(2)下列溶液中可以代替“还原”过程中Na2S2O5溶液的是___________(填标号)。
| A.NaHCO3溶液 | B.Na2SO4溶液 | C.NaHSO3溶液 | D.Na2S2O3溶液 |
(3)已知常温下,Ksp[Cr(OH)3]=1.0×10-32。若“沉铬”后滤液中Cr3+恰好完全沉淀(即c(Cr3+)=1.0×10-5mol·L-1),则此时溶液的pH=
(4)“沉铬”过程所用浓氨水也可换用浓碳酸钠溶液,此时除得到Cr(OH)3外,还会有大量气泡生成,试写出反应的离子方程式:
(5)“滤液”中的
 也可利用电解法还原为Cr3+,装置如图所示。
也可利用电解法还原为Cr3+,装置如图所示。
①则该装置的阳极区产生的Fe2+与
 反应的离子方程式为
反应的离子方程式为②每还原1mol
 ,电路中通过
,电路中通过
您最近一年使用:0次
解题方法
3 . 亚硫酰氯(SOCl2)是一种重要化工试剂,被广泛应用于结晶水合物的脱水和有机合成,三氯氧磷(POCl3)常作为半导体掺杂剂及光导纤维原料。工业上合成POCl3和SOCl2的方法之一是:PCl5(s)+SO2(g)=POCl3(l)+SOCl2(l)  =-101.4kJ·mol-1.已知相关物质的熔沸点及水解性如表:
=-101.4kJ·mol-1.已知相关物质的熔沸点及水解性如表:
某小组在实验室模拟工业制亚硫酰氯设计如图实验。

试回答下列问题:
(1)B装置中盛装的a试剂为___________ ;C装置中X仪器的名称是___________ 。
(2)反应过程中C装置的烧瓶要放在冰水浴中,原因是___________ 。
(3)反应结束后,应进行___________ (填操作名称),将产品分离得到较纯净的POCl3和SOCl2。
(4)测定某掺杂剂中POCl3的含量(杂质不参与反应);准确称取mg样品,在水解瓶中完全水解,将水解液配成250mL溶液,取25.00mL于锥形瓶中,加入0.2000mol·L-1的AgNO3溶液25.00mL,再加少许硝基苯防止AgCl参与后续反应,用力振荡。加入少量NH4Fe(SO4)2,用0.1000mol·L-1KSCN标准溶液滴定,消耗KSCN标准溶液20.00mL。[已知:Ag3PO4可溶于硝酸,Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12,POCl3的相对分子质量为153.5]
①说明滴定到达终点的实验现象为___________ 。
②产品中POCl3的质量分数为___________ 。
③关于反应,下列说法正确的是___________ 。
A.POCl3完全水解生成两种强酸
B.反应中无需外加HNO3
C.加入硝基苯防止的后续反应为AgCl+SCN- AgSCN+Cl-,其平衡常数为6.25×10-3
AgSCN+Cl-,其平衡常数为6.25×10-3
D.若未加入硝基苯,则实验测得的POCl3的含量将偏低
 =-101.4kJ·mol-1.已知相关物质的熔沸点及水解性如表:
=-101.4kJ·mol-1.已知相关物质的熔沸点及水解性如表:| 物质 | 熔点 | 沸点 | 水解性 |
| POCl3 | 1.2 | 105.5 | 易水解 |
| SOCl2 | -104.5 | 76 | 易水解 |
| PCl5 | 160(升华) | 167 | 易水解 |

试回答下列问题:
(1)B装置中盛装的a试剂为
(2)反应过程中C装置的烧瓶要放在冰水浴中,原因是
(3)反应结束后,应进行
(4)测定某掺杂剂中POCl3的含量(杂质不参与反应);准确称取mg样品,在水解瓶中完全水解,将水解液配成250mL溶液,取25.00mL于锥形瓶中,加入0.2000mol·L-1的AgNO3溶液25.00mL,再加少许硝基苯防止AgCl参与后续反应,用力振荡。加入少量NH4Fe(SO4)2,用0.1000mol·L-1KSCN标准溶液滴定,消耗KSCN标准溶液20.00mL。[已知:Ag3PO4可溶于硝酸,Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12,POCl3的相对分子质量为153.5]
①说明滴定到达终点的实验现象为
②产品中POCl3的质量分数为
③关于反应,下列说法正确的是
A.POCl3完全水解生成两种强酸
B.反应中无需外加HNO3
C.加入硝基苯防止的后续反应为AgCl+SCN-
 AgSCN+Cl-,其平衡常数为6.25×10-3
AgSCN+Cl-,其平衡常数为6.25×10-3D.若未加入硝基苯,则实验测得的POCl3的含量将偏低
您最近一年使用:0次
4 . 在蒸发器中加热蒸干并灼烧(低于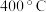 ),下列物质的溶液,可以得到该物质固体的是
),下列物质的溶液,可以得到该物质固体的是
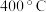 ),下列物质的溶液,可以得到该物质固体的是
),下列物质的溶液,可以得到该物质固体的是A. | B.碳酸氢钾 | C.硫酸钠 | D.氯化铵 |
您最近一年使用:0次
5 . 下列实验中,实验操作和实验目的有误的是
| 由海水制取蒸馏水 | 萃取碘水中的碘 | 验证牺牲阳极法 | 制备Fe(OH)3胶体 |
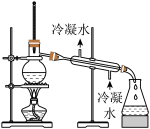 |  | 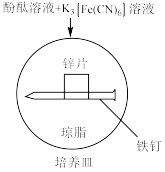 | 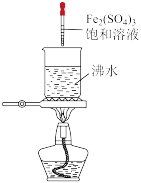 |
| A | B | C | D |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-05更新
|
64次组卷
|
2卷引用:浙江省杭州第二中学东河校区2023-2024学年高二上学期期末考试化学试题
6 . 除去下列物质中所含的少量杂质(括号内为杂质),所选除杂试剂正确的是
A. :澄清石灰水 :澄清石灰水 | B. :KSCN溶液 :KSCN溶液 |
C.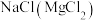 : : 溶液 溶液 | D. 溶液 溶液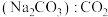 |
您最近一年使用:0次
解题方法
7 . 水钴矿主要成分为 ,同时含有少量
,同时含有少量 的氧化物及其他杂质。用水钴矿制取
的氧化物及其他杂质。用水钴矿制取 的工艺流程如图所示:
的工艺流程如图所示: 见下表:
见下表:
请回答下列问题:
(1)浸出液中加入 溶液的目的:
溶液的目的:___________ (离子方程式表示)。
(2)浸出过程中加入 调
调 的范围是
的范围是___________ 。
(3)如图所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。萃取剂合适的 为___________(填标号)。
为___________(填标号)。
(4) 能与强酸反应产生
能与强酸反应产生 ,采用惰性电极电解
,采用惰性电极电解 溶液制取钴,在无离子交换膜的条件下,不能用
溶液制取钴,在无离子交换膜的条件下,不能用 溶液代替
溶液代替 溶液的理由是
溶液的理由是___________ 。
(5)已知: ,
, ,加入
,加入 后,所得“滤液Ⅱ”中
后,所得“滤液Ⅱ”中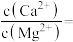
___________ 。
 ,同时含有少量
,同时含有少量 的氧化物及其他杂质。用水钴矿制取
的氧化物及其他杂质。用水钴矿制取 的工艺流程如图所示:
的工艺流程如图所示:
 见下表:
见下表:| 沉淀物 |  |  |  |  |  |
开始沉淀时的 | 7.0 | 2.7 | 7.6 | 7.7 | 4.0 |
沉淀完全时的 | 9.6 | 3.7 | 9.2 | 9.8 | 5.2 |
(1)浸出液中加入
 溶液的目的:
溶液的目的:(2)浸出过程中加入
 调
调 的范围是
的范围是(3)如图所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。萃取剂合适的
 为___________(填标号)。
为___________(填标号)。
| A.1~2 | B.3~4 | C.6~7 | D.7~8 |
(4)
 能与强酸反应产生
能与强酸反应产生 ,采用惰性电极电解
,采用惰性电极电解 溶液制取钴,在无离子交换膜的条件下,不能用
溶液制取钴,在无离子交换膜的条件下,不能用 溶液代替
溶液代替 溶液的理由是
溶液的理由是(5)已知:
 ,
, ,加入
,加入 后,所得“滤液Ⅱ”中
后,所得“滤液Ⅱ”中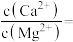
您最近一年使用:0次
解题方法
8 . 通过海水晒盐可以得到粗盐。某粗盐中除含有NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是某兴趣小组制备精盐的实验方案,其操作流程如图(所加试剂均过量):
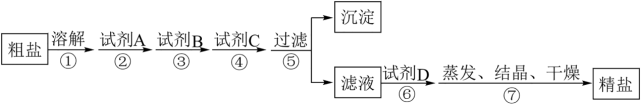
下列说法不正确的是

下列说法不正确的是
| A.试剂A、试剂B、试剂C分别为Na2CO3溶液、NaOH溶液、BaCl2溶液 |
| B.操作①、⑤、⑦均需用到玻璃棒 |
| C.试剂D为盐酸,需要滴加至溶液呈中性或微酸性 |
| D.蒸发完成后,用坩埚钳将蒸发皿夹持到陶土网上冷却 |
您最近一年使用:0次
名校
9 . 下列实验操作或装置正确的是

A.图甲可用于实验室制备 |
| B.图乙装置可用于完成过滤操作 |
| C.图丙可用于验证氨气在水中的溶解性 |
| D.图丁表示为配制一定物质的量浓度NaOH溶液时称量溶质的操作 |
您最近一年使用:0次
2024-02-23更新
|
278次组卷
|
5卷引用:浙江省杭州市长河高级中学2023-2024学年高一上学期期末考试化学试题
10 . 冰晶石(Na3AlF6)是工业上冶炼金属铝的熔剂,以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
(1)气体B易溶于水,画出其水溶液中可能存在的氢键形式:___________ 。解释工业上利用萤石(CaF2)制取气体B而不用氢气与其单质发生化合反应的原因:___________ 。
(2)下列说法正确的是___________。
(3)写出由气体B制备冰晶石的化学方程式:___________ 。
(4)将固体A(仅含一种化合物 )加入水中,设计实验检验所得澄清溶液中阴离子___________ 。

(1)气体B易溶于水,画出其水溶液中可能存在的氢键形式:
(2)下列说法正确的是___________。
| A.为防止空气进入,须在玻璃容器中进行 | B.固体A中可能存在少量氟化钙 |
| C.冰晶石是由NaF和AlF3组成的混合物 | D.酸性:Al(OH)3<HClO |
(4)将固体A(
您最近一年使用:0次



