1 . 某兴趣小组的同学制备了氯气并探究其性质。试回答下列问题:
Ⅰ.写出实验室制取氯气的化学方程式___________________________________ ;在该反应中,还原剂与氧化剂的物质的量之比为_____________ ;加热条件下,若有0.4mol浓盐酸与足量二氧化锰反应,则生成标准状况下氯气的体积_________ 2.24L(填“>、<或=”)。
Ⅱ.甲同学设计如图所示装置研究氯气能否与水发生反应,气体a是含有少量空气和水蒸气的氯气。请回答下列问题:
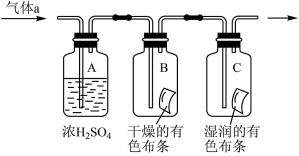
(1)浓硫酸的作用是__________________________ ;
(2)证明氯气和水发生化学反应的实验现象为___________________________ ;
(3)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是__________________________________ ;
(4)漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,反应的化学方程式是__________________________________ 。
Ⅰ.写出实验室制取氯气的化学方程式
Ⅱ.甲同学设计如图所示装置研究氯气能否与水发生反应,气体a是含有少量空气和水蒸气的氯气。请回答下列问题:

(1)浓硫酸的作用是
(2)证明氯气和水发生化学反应的实验现象为
(3)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是
(4)漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,反应的化学方程式是
您最近一年使用:0次
2 . 某研究小组制备氯气并对产生氯气的条件进行探究。
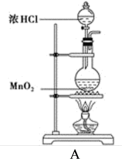
(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的_______ (填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是_______ 。(填写化学式)
(3)装置B用于吸收多余的Cl2,B中发生反应的离子方程式是_______ 。
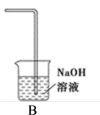
(4)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行探究:
①已知MnO2呈弱碱性。Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是_______ 。
②Ⅱ中发生了分解反应,反应的化学方程式是_______ 。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:
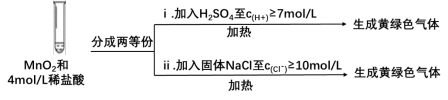
将实验Ⅲ、Ⅳ作对比,得出的结论是_______ ;
将ⅰ、ⅱ作对比,得出的结论是_______ 。

(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的
(2)A中产生的气体不纯,含有的杂质可能是
(3)装置B用于吸收多余的Cl2,B中发生反应的离子方程式是

(4)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行探究:
| 实验 | 操作 | 现象 |
| Ⅰ | 常温下将MnO2和12mol/L浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| Ⅲ | 加热MnO2和4mol/L稀盐酸混合物 | 无明显现象 |
②Ⅱ中发生了分解反应,反应的化学方程式是
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是
将ⅰ、ⅱ作对比,得出的结论是
您最近一年使用:0次
3 . 氨气在工农业生产中有重要应用。
(1)写出工业合成氨的化学方程式_____ 。
(2)某化学实验小组同学利用以下装置制备氨,并探究氨的性质(部分仪器已略去)。
请回答:
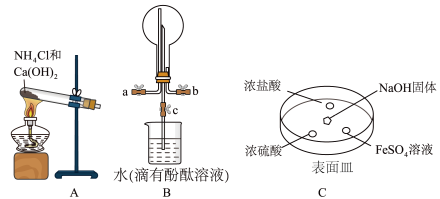
①实验室制备氨的化学方程式为_____ 。
②用装置B收集氨时,氨的进气口是____ (选填“a”或“b”)。打开装置B中的活塞c,若观察到烧瓶内产生了红色喷泉,则说明氨具有的性质是______ ,____ 。
③向C中NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。浓盐酸液滴附近会出现白烟,发生反应的化学方程式为_____ 。FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2++2NH3·H2O===Fe(OH)2↓+2NH4+和_____ 。
④为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨的是____ (填序号)。

(1)写出工业合成氨的化学方程式
(2)某化学实验小组同学利用以下装置制备氨,并探究氨的性质(部分仪器已略去)。
请回答:

①实验室制备氨的化学方程式为
②用装置B收集氨时,氨的进气口是
③向C中NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。浓盐酸液滴附近会出现白烟,发生反应的化学方程式为
④为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨的是

您最近一年使用:0次
2019-06-13更新
|
319次组卷
|
2卷引用:甘肃省天水市第一中学2020-2021学年高一下学期第一阶段考试化学(理)试题
4 . 下列实验的操作、现象和结论都正确的是
| 选项 | 实验目的 | 实验操作及现象 | 结论 |
| A | 探究铁粉在氯气中燃烧所得固体粉末的成分 | 取少量固体粉末,加入2~3mL蒸馏水,振荡,迅速滴入几滴KSCN溶液,溶液不显红色 | 该固体粉末中不存在FeCl3 |
| B | 证明SO2具有漂白性 | 将SO2缓慢通入滴有酚酞的NaOH溶液中,溶液红色褪去 | SO2有漂白性 |
| C | 探究温度对化学平衡的影响 | 加热盛有CuCl2溶液的试管,溶液变为黄色,冷却后变为蓝色 | [Cu(H2O)4]2+转化为[CuCl4]2-的反应放热 |
| D | 探究Cl2的性质 | 将Cl2通入K2S溶液中,生成淡黄色沉淀 | Cl2具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019·甘肃兰州·一模
5 . 实验室用浓盐酸与氯酸钾固体反应制ClO2时,发现收集的气体中含有Cl2某研究性学习小组拟用下图装置分离混合气体,并探究混合气体的组成。

【资料信息】
①常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不溶于浓硫酸、四氯化碳
②ClO2具有强氧化性,能与NaOH溶液反应生成等物质的量的两种盐,其中一种为NaClO3。
实验1.制备与分离
(1)实验过程中加药品前应进行的操作是______________________ 。
(2)D中冰水的作用是______________________ 。
(3)多余的ClO2可用碱溶液吸收,写出ClO2与NaOH溶液反应的离子方程式___________ 。
实验2.测量与计算
反应结束后,打开止水夹鼓入过量N2,再测得B、C装置分别增重2.0g和7.1g,将D中试管收集的物质溶于水配成2.5L溶液。取25.00mL该溶液,调节溶液pH<2.0后加入足量的KI晶体,振荡,静置片刻;再加入指示剂X,用0.400 mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液25.00mL。
已知:2ClO2+8H++10I-=5I2+2Cl-+4H2O;2Na2S2O3+I2=Na2S4O6+2NaI
(4)鼓入过量N2的目的是_________________________________ 。
(5)指示剂X为___________ ,滴定至终点时的实验现象为___________ 。
(6)混合气体中ClO2与C12物质的量之比为___________ 。
【实验反思】
(7)该实验设计存在一定缺陷,改进措施是______________________ 。

【资料信息】
①常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不溶于浓硫酸、四氯化碳
②ClO2具有强氧化性,能与NaOH溶液反应生成等物质的量的两种盐,其中一种为NaClO3。
实验1.制备与分离
(1)实验过程中加药品前应进行的操作是
(2)D中冰水的作用是
(3)多余的ClO2可用碱溶液吸收,写出ClO2与NaOH溶液反应的离子方程式
实验2.测量与计算
反应结束后,打开止水夹鼓入过量N2,再测得B、C装置分别增重2.0g和7.1g,将D中试管收集的物质溶于水配成2.5L溶液。取25.00mL该溶液,调节溶液pH<2.0后加入足量的KI晶体,振荡,静置片刻;再加入指示剂X,用0.400 mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液25.00mL。
已知:2ClO2+8H++10I-=5I2+2Cl-+4H2O;2Na2S2O3+I2=Na2S4O6+2NaI
(4)鼓入过量N2的目的是
(5)指示剂X为
(6)混合气体中ClO2与C12物质的量之比为
【实验反思】
(7)该实验设计存在一定缺陷,改进措施是
您最近一年使用:0次
6 . 某校化学兴趣小组的同学分别对氯气和氯水的性质进行探究。
Ⅰ.下图是实验室制备氯气并进行一系列相关实验的装置(部分夹持装置已略)。

(1)制备氯气选用的药品为二氧化锰和浓盐酸,A中反应的化学方程式为
__________________________________ 。
(2)装置B中饱和食盐水的作用是______ ;同时装置B还能监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象______ 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处最好依次放入________ (填序号)。
①干燥的有色布条 ②湿润的有色布条 ③碱石灰④无水氯化钙 ⑤浓硫酸
(4)当向D中缓缓通入一定量氯气时,D中溶液逐渐变为______ 色;再打开D装置活塞,将装置D中少量溶液滴入锥形瓶E中,振荡,观察到的现象是___________________ 。
(5)有人提出,装置F中可改用足量的饱和NaHSO3溶液吸收氯气,请判断是否可行________ (填“是”或“否”),理由是__________________________________ (用离子反应方程式表示)。
Ⅰ.下图是实验室制备氯气并进行一系列相关实验的装置(部分夹持装置已略)。

(1)制备氯气选用的药品为二氧化锰和浓盐酸,A中反应的化学方程式为
(2)装置B中饱和食盐水的作用是
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处最好依次放入
①干燥的有色布条 ②湿润的有色布条 ③碱石灰④无水氯化钙 ⑤浓硫酸
(4)当向D中缓缓通入一定量氯气时,D中溶液逐渐变为
(5)有人提出,装置F中可改用足量的饱和NaHSO3溶液吸收氯气,请判断是否可行
您最近一年使用:0次
7 . 硫化碱法是工业上制备Na2S2O3的方法之一。某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O。
(1)利用吸硫装置A制取Na2S2O3。

①写出吸硫装置A中发生反应的化学方程式_______________________ 。
②装置B的作用是检验装置中SO2的吸收效率,B中试剂是_____________ ,表明SO2吸收效率低的实验现象是B 中溶液___________________ 。
③为了使SO2尽可能吸收完全,除了及时搅拌反应物外,还可采取的合理措施是___________ (写出一条即可)。
(2)从反应液中获得Na2S2O3·5H2O晶体的方法是_____________ ,减压抽滤,洗涤干燥。
(3)实验制得的Na2S2O3·5H2O产品中可能含有Na2SO3、Na2SO4等杂质。请设计实验检测Na2S2O3·5H2O产品中是否存在Na2SO4杂质,简要说明实验操作现象和结论:__________________________ 。
(4)①Na2S2
O3
溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取agKIO3(相对分子质量:214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为VmL
则c(Na2S2O3)=________ mol·L-1 (列出算式即可)。
(已知:IO3-+5I-+6H+=3I2+3H2O,2S2O32-+I2= S4O62-+2I-)
②在滴定过程中下列实验操作会造成实验结果偏低的是_______ 。
A.滴定管未用Na2S2O3溶液润洗
B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗后未进行干燥处理
D.滴定管尖嘴处滴定前无气泡,满定终点发现有气泡
(1)利用吸硫装置A制取Na2S2O3。

①写出吸硫装置A中发生反应的化学方程式
②装置B的作用是检验装置中SO2的吸收效率,B中试剂是
③为了使SO2尽可能吸收完全,除了及时搅拌反应物外,还可采取的合理措施是
(2)从反应液中获得Na2S2O3·5H2O晶体的方法是
(3)实验制得的Na2S2O3·5H2O产品中可能含有Na2SO3、Na2SO4等杂质。请设计实验检测Na2S2O3·5H2O产品中是否存在Na2SO4杂质,简要说明实验操作现象和结论:
(4)①Na2S2
O3
溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取agKIO3(相对分子质量:214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为VmL
则c(Na2S2O3)=
(已知:IO3-+5I-+6H+=3I2+3H2O,2S2O32-+I2= S4O62-+2I-)
②在滴定过程中下列实验操作会造成实验结果偏低的是
A.滴定管未用Na2S2O3溶液润洗
B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗后未进行干燥处理
D.滴定管尖嘴处滴定前无气泡,满定终点发现有气泡
您最近一年使用:0次
名校
8 . 葡萄酒中添加的SO2有抗氧化和杀菌等作用。中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g/L。
1.SO2的制取和部分性质研究。
(1)下列实验室制取、验证漂白性、收集及尾气处理的装置和原理能达到实验目的的是_______ 。

(2)设计实验验证SO2与Fe2+还原性的强弱(可供选择的试剂有:FeCl2溶液、氯水、KSCN溶液、Ba(NO3)2溶液、BaCl2溶液、KMnO4溶液)。取SO2的饱和溶液,向其中滴加少量FeCl3溶液,充分反应。将反应后混合液分成甲、乙两份。
向甲中滴加_______ 溶液,观察到_______ ,可知混合液中无Fe3+;
向乙中滴加_______ 溶液,观察到_______ ,可知混合液中有_______
由此得出结论:SO2的还原性强于Fe2+。
2.葡萄酒中SO2的检测。
(3)检测干白葡萄酒(液体为无色)中的SO2或 。设计如图1的实验:
。设计如图1的实验:
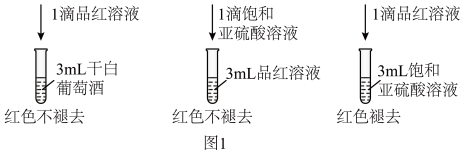
甲同学得出实验结论:干白葡萄酒中不含SO2或 。这个结论是否合理
。这个结论是否合理_______ (填“是”或“否”)说明理由_______ 。
(4)某兴趣小组用图2装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定。
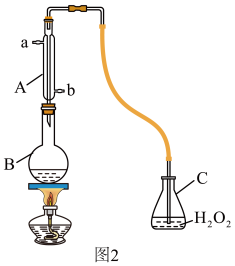
实验步骤:
i.检查装置的气密性后,向图2仪器B中加入300.00mL葡萄酒和适量盐酸
ii.加热使SO2全部逸出并与C中H2O2完全反应
iii.除去C中过量的H2O2
iv.用0.0900mol/LNaOH标准溶液进行滴定
回答下列问题:
①A的进水口为_______ ,滴定前排气泡时,应选择图3中的_______ 。
②C中反应生成物的化学式是_______ ,除去过量H2O2的方法是_______ 。
③滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为_______ g/L,是否符合国家标准_______ (填“是”或“否”)。
④下列操作使测定结果比实际值偏高的是_______ 。
a.B中加入的盐酸挥发
b.滴定终点读取滴定管刻度时,俯视标准液液面
c.配制NaOH标准溶液时,未等烧杯中溶液冷却至室温即转移定容
1.SO2的制取和部分性质研究。
(1)下列实验室制取、验证漂白性、收集及尾气处理的装置和原理能达到实验目的的是

(2)设计实验验证SO2与Fe2+还原性的强弱(可供选择的试剂有:FeCl2溶液、氯水、KSCN溶液、Ba(NO3)2溶液、BaCl2溶液、KMnO4溶液)。取SO2的饱和溶液,向其中滴加少量FeCl3溶液,充分反应。将反应后混合液分成甲、乙两份。
向甲中滴加
向乙中滴加
由此得出结论:SO2的还原性强于Fe2+。
2.葡萄酒中SO2的检测。
(3)检测干白葡萄酒(液体为无色)中的SO2或
 。设计如图1的实验:
。设计如图1的实验:
甲同学得出实验结论:干白葡萄酒中不含SO2或
 。这个结论是否合理
。这个结论是否合理(4)某兴趣小组用图2装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定。

实验步骤:
i.检查装置的气密性后,向图2仪器B中加入300.00mL葡萄酒和适量盐酸
ii.加热使SO2全部逸出并与C中H2O2完全反应
iii.除去C中过量的H2O2
iv.用0.0900mol/LNaOH标准溶液进行滴定
回答下列问题:
①A的进水口为

②C中反应生成物的化学式是
③滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为
④下列操作使测定结果比实际值偏高的是
a.B中加入的盐酸挥发
b.滴定终点读取滴定管刻度时,俯视标准液液面
c.配制NaOH标准溶液时,未等烧杯中溶液冷却至室温即转移定容
您最近一年使用:0次
9 . 利用下列有关实验装置进行相关实验,不能达到实验目的的是


| A.用图甲所示装置检验金属钠与水反应的热效应 |
B.用图乙所示装置制取并收集干燥纯净的 |
C.用图丙所示装置可以比较 、 、 、S的氧化性 、S的氧化性 |
| D.用图丁所示装置检验氨气的水溶性 |
您最近一年使用:0次
2022-06-03更新
|
364次组卷
|
5卷引用:甘肃省庆阳市2021-2022学年高一下学期期末考试化学试题
解题方法
10 . 已知 固体与硫酸可发生反应:
固体与硫酸可发生反应: ,下图是实验室制取
,下图是实验室制取 并验证
并验证 的某些性质的装置图.试回答:
的某些性质的装置图.试回答:___________________ ,证明 是
是____________ 气体。
(2)②中的实验现象为品红溶液_______________ ,证明 有
有____________ 性。
(3)③中的实验现象是____________ ,证明 有
有____________ 性,写出相应的化学方程式__________________ 。
(4)④中的实验现象是____________ ,证明 有
有____________ 性,写出相应的化学方程式___________________ 。
 固体与硫酸可发生反应:
固体与硫酸可发生反应: ,下图是实验室制取
,下图是实验室制取 并验证
并验证 的某些性质的装置图.试回答:
的某些性质的装置图.试回答: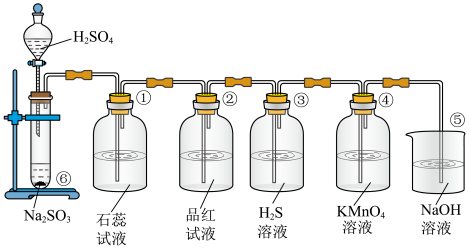
 是
是(2)②中的实验现象为品红溶液
 有
有(3)③中的实验现象是
 有
有(4)④中的实验现象是
 有
有
您最近一年使用:0次



