名校
1 . 从干海带中提取碘的实验流程如下:
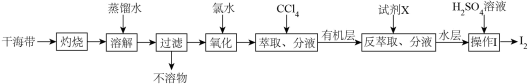
| A.氧化过程可以用过氧化氢代替氯水 |
B.试剂X可以选择使用NaOH溶液,发生的反应为:3I2+6OH‒=5I‒+IO +3H2O +3H2O |
| C.萃取时可使用无水乙醇代替CCl4以节约成本 |
| D.整个过程中的操作是利用了物质的溶解性实现了碘元素的富集、分离与提纯 |
您最近半年使用:0次
名校
解题方法
2 . 中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。
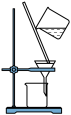
Ⅰ.海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:___________ 中进行。
(2)操作Ⅰ中具体实验步骤:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.检验分液漏斗旋塞和上口的瓶塞是否漏液;
C.把20mL碘水与5mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.从分液漏斗上口倒出上层溶液;
H.静止、分层;
实验步骤的正确顺序为___________ 。
_____→_____→_____→A→H→_____→_____→_____
(3)为寻找氯水的替代品,某同学设计了用 代替氯水。请写出此反应的离子方程式:
代替氯水。请写出此反应的离子方程式:___________ 。
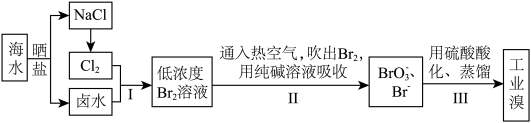
Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其流程如图所示,试回答下列问题:___________ 。
(5)步骤Ⅱ中涉及的离子方程式如下,请在下面横线上填入适当的化学计量数___________ 。
_____ _____
_____ _____
_____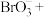 _____
_____ _____
_____
(6)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:___________ 。
Ⅲ.镁及其合金是一种用途很广的金属材料,目前60%的镁是从海水中提取的。主要步骤如下: 转化为
转化为 ,试剂①工业上选用
,试剂①工业上选用___________ (填化学式)。
(8)熔融状态的无水 通电后会产生Mg和
通电后会产生Mg和 ,试写出该反应的化学方程式:
,试写出该反应的化学方程式:___________ 。
Ⅰ.海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:
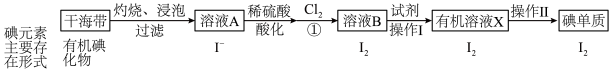
(2)操作Ⅰ中具体实验步骤:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.检验分液漏斗旋塞和上口的瓶塞是否漏液;
C.把20mL碘水与5mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.从分液漏斗上口倒出上层溶液;
H.静止、分层;
实验步骤的正确顺序为
_____→_____→_____→A→H→_____→_____→_____
(3)为寻找氯水的替代品,某同学设计了用
 代替氯水。请写出此反应的离子方程式:
代替氯水。请写出此反应的离子方程式:Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其流程如图所示,试回答下列问题:
(5)步骤Ⅱ中涉及的离子方程式如下,请在下面横线上填入适当的化学计量数
_____
 _____
_____ _____
_____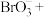 _____
_____ _____
_____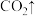
(6)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:
Ⅲ.镁及其合金是一种用途很广的金属材料,目前60%的镁是从海水中提取的。主要步骤如下:
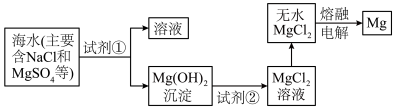
 转化为
转化为 ,试剂①工业上选用
,试剂①工业上选用(8)熔融状态的无水
 通电后会产生Mg和
通电后会产生Mg和 ,试写出该反应的化学方程式:
,试写出该反应的化学方程式:
您最近半年使用:0次
名校
解题方法
3 . 下表为元素周期表的一部分,请参照元素①—⑨在表中的位置,回答下列问题:
(1)第三周期中元素非金属性最强的元素的原子结构示意图为___________ 。
(2)②③⑨最高价氧化物对应水化物酸性强弱顺序为(填化学式)___________
(3)下列可以判断⑤和⑥金属性强弱的是___________ 。
a.⑤单质的熔点比⑥单质低 b.⑤的化合价比⑥低
c.⑤单质与水反应比单质⑥剧烈 d.⑤最高价氧化物的水化物的碱性比⑥强
(4)工业制备⑥单质的化学方程式___________ 。用⑥与赤铁矿冶炼金属铁的化学方程式___________ 。
(5)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图:
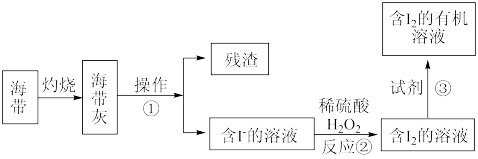
操作①的名称是___________ ;反应②的离子方程式是___________ 。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(2)②③⑨最高价氧化物对应水化物酸性强弱顺序为(填化学式)
(3)下列可以判断⑤和⑥金属性强弱的是
a.⑤单质的熔点比⑥单质低 b.⑤的化合价比⑥低
c.⑤单质与水反应比单质⑥剧烈 d.⑤最高价氧化物的水化物的碱性比⑥强
(4)工业制备⑥单质的化学方程式
(5)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图:

操作①的名称是
您最近半年使用:0次
名校
4 . 海洋植物如海带,海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下:(已知: )。
)。
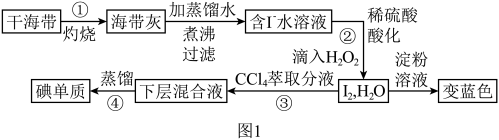
(1)以上步骤不需要用到的仪器是_______。
(2)选用试剂 的理由是_______。
的理由是_______。
(3)写出步骤②中反应的离子方程式_______ 。
(4)工业制备过程中,步骤④很难达到目的,常对图1步骤④进行如下改进:
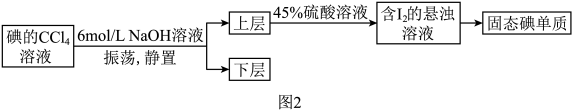
写出上述流程中加入45%硫酸溶液一步反应的离子方程式_______ 。
(5)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
①已知碘元素最终变为无色HIO3。上述整个过程中的还原剂有_______ 。
②若把KI成KBr,则CCl4层变为_______ 色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是_______ 。
 )。
)。
(1)以上步骤不需要用到的仪器是_______。
A. | B. | C. | D. |
 的理由是_______。
的理由是_______。A. 不溶于水 不溶于水 | B. 的密度比水大 的密度比水大 |
C.碘在 中比在水中溶解度更大 中比在水中溶解度更大 | D. 与碘水不反应 与碘水不反应 |
(4)工业制备过程中,步骤④很难达到目的,常对图1步骤④进行如下改进:

写出上述流程中加入45%硫酸溶液一步反应的离子方程式
(5)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
①已知碘元素最终变为无色HIO3。上述整个过程中的还原剂有
②若把KI成KBr,则CCl4层变为
您最近半年使用:0次
名校
解题方法
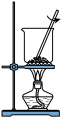
5 . 某同学检验海带中是否含有碘元素,进行了如下实验。
步骤Ⅰ:灼烧干海带得到海带灰;
步骤Ⅱ:将海带灰加蒸馏水溶解、过滤,得到海带灰浸取液;
步骤Ⅲ:取少量浸取液于试管中,加入淀粉溶液,溶液未变蓝;再加入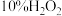 溶液(硫酸酸化),溶液变为蓝色;
溶液(硫酸酸化),溶液变为蓝色;
步骤Ⅳ:将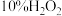 溶液(硫酸酸化)替换为氯水,重复步骤Ⅲ,溶液未变蓝;
溶液(硫酸酸化)替换为氯水,重复步骤Ⅲ,溶液未变蓝;
步骤Ⅴ:向步骤Ⅳ所得溶液中通入 ,溶液迅速变为蓝色。
,溶液迅速变为蓝色。
下列说法不正确的是
步骤Ⅰ:灼烧干海带得到海带灰;
步骤Ⅱ:将海带灰加蒸馏水溶解、过滤,得到海带灰浸取液;
步骤Ⅲ:取少量浸取液于试管中,加入淀粉溶液,溶液未变蓝;再加入
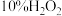 溶液(硫酸酸化),溶液变为蓝色;
溶液(硫酸酸化),溶液变为蓝色;步骤Ⅳ:将
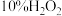 溶液(硫酸酸化)替换为氯水,重复步骤Ⅲ,溶液未变蓝;
溶液(硫酸酸化)替换为氯水,重复步骤Ⅲ,溶液未变蓝;步骤Ⅴ:向步骤Ⅳ所得溶液中通入
 ,溶液迅速变为蓝色。
,溶液迅速变为蓝色。下列说法不正确的是
| A.步骤Ⅰ中,灼烧干海带的目的是除去有机化合物,获得可溶性碘化物 |
B.步骤Ⅲ中,反应的离子方程式: |
C.若将步骤Ⅴ中的 替换为 替换为 溶液,也可能观察到溶液变为蓝色 溶液,也可能观察到溶液变为蓝色 |
D.对比步骤Ⅲ、Ⅳ和Ⅴ中实验现象,说明该条件下 氧化性比氯水强 氧化性比氯水强 |
您最近半年使用:0次
2023-04-29更新
|
539次组卷
|
4卷引用:北京市丰台区2023届高三下学期二模考试化学试题
6 . 海洋资源的利用具有非常广阔的前景。
I.利用空气吹出法从海水(弱碱性)中提取溴的流程如图。

已知:溴单质的沸点为58.5℃。
(1)溴元素在元素周期表中的位置是_______ 。
(2)“吸收塔”中发生反应的离子方程式为_______ 。
(3)“蒸馏塔”中温度应控制在_______ (填序号)。
A.40~50℃ B.70~80℃ C.100℃以上
(4)物质A_______ (填化学式)可以循环利用,降低成本。
(5)探究“氧化”的适宜条件,测得不同条件下溶液中被氧化的Br-的百分含量如图:

注: 表示加入氯元素与海水中溴元素物质的量之比。
表示加入氯元素与海水中溴元素物质的量之比。
①“氧化”的适宜条件为_______ 。
②已知:海水中溴的浓度是64 mg/L ,经该方法处理后1m3海水最终得到 38.4g Br2,则溴的总提取率为_______ 。
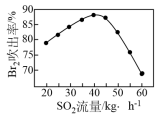
③吸收后的空气进行循环利用。吹出时,Br2 吹出率与吸收塔中SO2流量的关系如图所示。SO2 流量过大,Br2 吹出率反而下降的原因是:___________ 。
Ⅱ.离子交换法从海带中提取碘是一种较为先进的制碘工艺。如图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。

已知:①I2 + I- I
I ;
;
②强碱性阴离子树脂(用R-Cl表示,Cl-可被其它更易被吸附的阴离子替代)对多碘离子(I )有很强的交换吸附能力;
)有很强的交换吸附能力;
③步骤“交换吸附”发生的反应:R-Cl+I =R-I3+Cl-。
=R-I3+Cl-。
试回答下列问题:
(6)下列各步反应中,属于氧化还原反应的有:_______(填序号)
(7)酸性条件下,原料被H2O2氧化时发生的反应有:①_______ ;②I2+I- I
I 。
。
(8)实验室模拟步骤“酸化氧化”,一般选用氯水。工业上生产企业可以按照自己的实际情况,选择合适的氧化剂。若某企业在酸性条件下选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则添加氧化剂与NaI的质量比应不少于_______ 。
I.利用空气吹出法从海水(弱碱性)中提取溴的流程如图。

已知:溴单质的沸点为58.5℃。
(1)溴元素在元素周期表中的位置是
(2)“吸收塔”中发生反应的离子方程式为
(3)“蒸馏塔”中温度应控制在
A.40~50℃ B.70~80℃ C.100℃以上
(4)物质A
(5)探究“氧化”的适宜条件,测得不同条件下溶液中被氧化的Br-的百分含量如图:

注:
 表示加入氯元素与海水中溴元素物质的量之比。
表示加入氯元素与海水中溴元素物质的量之比。①“氧化”的适宜条件为
②已知:海水中溴的浓度是64 mg/L ,经该方法处理后1m3海水最终得到 38.4g Br2,则溴的总提取率为
③吸收后的空气进行循环利用。吹出时,Br2 吹出率与吸收塔中SO2流量的关系如图所示。SO2 流量过大,Br2 吹出率反而下降的原因是:

Ⅱ.离子交换法从海带中提取碘是一种较为先进的制碘工艺。如图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。

已知:①I2 + I-
 I
I ;
;②强碱性阴离子树脂(用R-Cl表示,Cl-可被其它更易被吸附的阴离子替代)对多碘离子(I
 )有很强的交换吸附能力;
)有很强的交换吸附能力;③步骤“交换吸附”发生的反应:R-Cl+I
 =R-I3+Cl-。
=R-I3+Cl-。试回答下列问题:
(6)下列各步反应中,属于氧化还原反应的有:_______(填序号)
| A.交换吸附 | B.洗脱 | C.酸化氧化 | D.NaCl洗脱 |
 I
I 。
。(8)实验室模拟步骤“酸化氧化”,一般选用氯水。工业上生产企业可以按照自己的实际情况,选择合适的氧化剂。若某企业在酸性条件下选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则添加氧化剂与NaI的质量比应不少于
您最近半年使用:0次
名校
7 . 实验室海带提碘的实验中不涉及的操作是
| A.灼烧 | B.溶解 | C.过滤 | D.蒸发 |
您最近半年使用:0次
2023-04-14更新
|
166次组卷
|
4卷引用:北京市第二十中学2023-2024学年高一下学期3月化学试题
名校
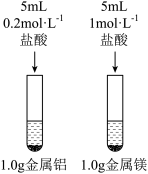
8 . 利用图中实验装置进行相应实验,能达到实验目的的是
| 选项 | A | B | C | D |
| 实验目的 | 将海带灼烧成灰 | 探究镁、铝的失电子能力强弱 | 从 的悬浊液中分离出碘单质 的悬浊液中分离出碘单质 | 验证得电子能力:N>C>Si |
| 实验装置 |
|
|
|
|
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-04-11更新
|
438次组卷
|
5卷引用:北京市第二十中学2023-2024学年高一下学期3月化学试题
2023高三·全国·专题练习
名校
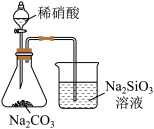
9 . 工业上用活性炭吸附海带提碘后废水中的 制取
制取 ,其流程如图:
,其流程如图:
 制取
制取 ,其流程如图:
,其流程如图: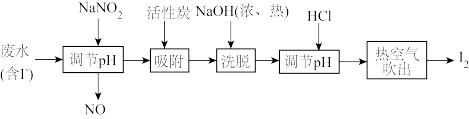
A. 氧化 氧化 时使溶液 时使溶液 变大 变大 |
| B.活性炭吸附是为了净化水溶液 |
C. 与 与 (浓、热)反应的化学方程式: (浓、热)反应的化学方程式: |
D.热空气能吹出 ,是因为 ,是因为 在水中溶解度小、易升华 在水中溶解度小、易升华 |
您最近半年使用:0次
2023-02-12更新
|
258次组卷
|
4卷引用:选择题6-10
(已下线)选择题6-10(已下线)第四章 非金属及其化合物 第19练 卤素的性质及提取浙江省义乌市义亭中学2023-2024学年高二上学期化学期末模拟试题(一)福建省厦门第六中学2023-2024学年高一下学期4月月考化学试题
10 . 海带中含有碘元素,从海带中提取碘的实验过程如下图所示。

(1)步骤①会用到下列仪器中的_______(填字母)。
(2)海带灰悬浊液含有 。步骤④的试剂选用
。步骤④的试剂选用 、稀硫酸,离子方程式是
、稀硫酸,离子方程式是_______ 。
(3)检验步骤④产生了 的方法是
的方法是_______ 。
(4)步骤⑤“提取”包含以下四个过程。
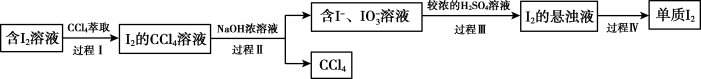
a.过程Ⅰ使用的 体积明显小于含
体积明显小于含 溶液,即可使
溶液,即可使 几乎完全地转移至
几乎完全地转移至 中,推测
中,推测 在
在_______ (填“ ”或“
”或“ ”)中的溶解度更大。
”)中的溶解度更大。
b. 与
与 浓溶液反应的离子方程式是
浓溶液反应的离子方程式是_______ 。
c.过程Ⅰ→过程Ⅲ的目的是_______ 。
d.过程Ⅳ的操作是_______ 。

(1)步骤①会用到下列仪器中的_______(填字母)。
| A.酒精灯 | B.漏斗 | C.坩埚 | D.泥三角 |
 。步骤④的试剂选用
。步骤④的试剂选用 、稀硫酸,离子方程式是
、稀硫酸,离子方程式是(3)检验步骤④产生了
 的方法是
的方法是(4)步骤⑤“提取”包含以下四个过程。

a.过程Ⅰ使用的
 体积明显小于含
体积明显小于含 溶液,即可使
溶液,即可使 几乎完全地转移至
几乎完全地转移至 中,推测
中,推测 在
在 ”或“
”或“ ”)中的溶解度更大。
”)中的溶解度更大。b.
 与
与 浓溶液反应的离子方程式是
浓溶液反应的离子方程式是c.过程Ⅰ→过程Ⅲ的目的是
d.过程Ⅳ的操作是
您最近半年使用:0次