名校
解题方法
1 . 海洋资源的利用具有广阔前景。
(1)从海水制得的粗盐含有Ca2+、Mg2+、 等杂质离子,正确的除杂操作顺序为___________
等杂质离子,正确的除杂操作顺序为___________
①加入稍过量的BaCl2溶液;②加入稍过量的Na2CO3溶液;③加入适量的稀盐酸;④加入稍过量的NaOH溶液;⑤过滤。
(2)从海水中提取溴的主要步骤是向浓缩的海水中通入Cl2,将Br-氧化,该反应的离子方程式是______ 。
(3)下图是从海水中提取镁的简单流程。
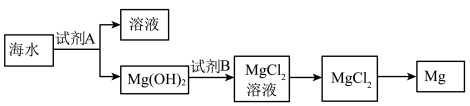
①工业上常用于沉淀Mg2+ 的试剂A是___________ 。
②由无水MgCl2制取Mg的化学方程式是___________ 。
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
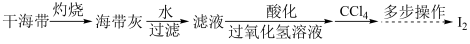
①灼烧海带时所用的主要仪器名称是___________ 。
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式:___________ 。
(1)从海水制得的粗盐含有Ca2+、Mg2+、
 等杂质离子,正确的除杂操作顺序为___________
等杂质离子,正确的除杂操作顺序为___________①加入稍过量的BaCl2溶液;②加入稍过量的Na2CO3溶液;③加入适量的稀盐酸;④加入稍过量的NaOH溶液;⑤过滤。
| A.④①②③⑤ | B.②①④⑤③ | C.①②⑤③④ | D.①④②⑤③ |
(3)下图是从海水中提取镁的简单流程。

①工业上常用于沉淀Mg2+ 的试剂A是
②由无水MgCl2制取Mg的化学方程式是
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
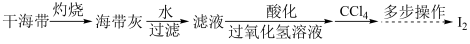
①灼烧海带时所用的主要仪器名称是
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式:
您最近半年使用:0次
名校
解题方法
2 . 制备相关物质,涉及的反应原理及部分流程不合理的是
A.制溴:浓缩海水 Br2 Br2  HBr溶液 HBr溶液 Br2 Br2 |
B.制取镁:海水    溶液 溶液 Mg Mg |
C.加热分解Ag2O冶炼Ag:2Ag2O 4Ag+O2↑ 4Ag+O2↑ |
D.制碘:干海带 浸出液 浸出液 碘水 碘水 含I2苯溶液 含I2苯溶液 单质碘 单质碘 |
您最近半年使用:0次
2023-09-12更新
|
81次组卷
|
2卷引用:山西省晋城市第一中学校2023-2024学年高三上学期10月月考化学试题
名校
解题方法
3 . 海洋资源的利用具有广阔前景。
(1)从海水中提取溴的主要步骤是向浓缩的海水中通入Cl2,将Br-氧化,该反应的离子方程式是___________ 。
(2)下图是从海水中提取镁的简单流程。
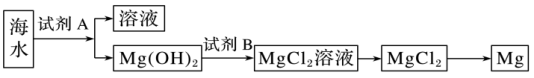
①工业上常用于沉淀Mg2+的试剂A是___________ ,Mg(OH)2转化为MgCl2的离子方程式是___________ 。
②由无水MgCl2制取Mg的化学方程式是___________ 。
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧海带时所用的主要仪器名称是___________ 。
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式:___________ 。
(1)从海水中提取溴的主要步骤是向浓缩的海水中通入Cl2,将Br-氧化,该反应的离子方程式是
(2)下图是从海水中提取镁的简单流程。

①工业上常用于沉淀Mg2+的试剂A是
②由无水MgCl2制取Mg的化学方程式是
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧海带时所用的主要仪器名称是
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式:
您最近半年使用:0次
名校
解题方法
4 . 海带中既含有有机碘化合物又含有碘化钠等无机碘化合物。某课题组探究了海带提碘的优化条件,并用色度计测定了某海带样品中碘的含量。实验步骤:
I.预处理:将干海带刷净,剪成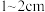 大小的方块,准确称量
大小的方块,准确称量 样品。
样品。
II.灰化:在仪器A中加热干海带,并用玻璃棒不断搅拌,记录加热时间,停止加热,冷却。
III.过滤:将冷却后的海带灰转移到 烧杯中,加入
烧杯中,加入 蒸馏水,静置后过滤。
蒸馏水,静置后过滤。
IV.氧化:向滤液中加入稀 和
和 溶液,充分反应后将滤液转移到分液漏斗中。
溶液,充分反应后将滤液转移到分液漏斗中。
V.萃取:向分液漏斗中加入 ,振荡,静置。待溶液完全分层后,取下层溶液。
,振荡,静置。待溶液完全分层后,取下层溶液。
VI.含量测定:用色度计测定出所得溶液中碘的含量。
VII.回收处理:蒸馏碘的 溶液,回收
溶液,回收
已知:海带灰化后,碘元素以 的形式存在。
的形式存在。
回答下列问题:
(1)第II步中的仪器A是___________ 。
(2)证明第III步滤液中存在 的实验方法是
的实验方法是___________ ,实验现象是___________ 。
(3)第IV步氧化过程中发生反应的离子方程式为___________ 。
(4)第V步可得到 的
的 溶液,也可用如下流程从其中回收
溶液,也可用如下流程从其中回收 :
:
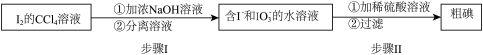
请写出步骤II的离子方程式:___________ 。
(5)碘浓度越大吸光度越大。用色度计测得某碘溶液的吸光度后,利用以溶液吸光度为纵坐标,碘浓度(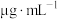 )为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取
)为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取 碘单质,用
碘单质,用 容量瓶配成碘的
容量瓶配成碘的 溶液,取出
溶液,取出 加入一定量
加入一定量 中配得第一份碘的标准溶液
中配得第一份碘的标准溶液 。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是
。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是___________ 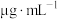 。
。
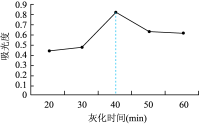
(6)课题组在其他实验条件相同情况下,研究了不同灰化时间对碘提取效果的影响,其结果如图所示。灰化时间超过40min,测得碘的含量逐渐降低,原因是___________ 。
I.预处理:将干海带刷净,剪成
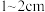 大小的方块,准确称量
大小的方块,准确称量 样品。
样品。II.灰化:在仪器A中加热干海带,并用玻璃棒不断搅拌,记录加热时间,停止加热,冷却。
III.过滤:将冷却后的海带灰转移到
 烧杯中,加入
烧杯中,加入 蒸馏水,静置后过滤。
蒸馏水,静置后过滤。IV.氧化:向滤液中加入稀
 和
和 溶液,充分反应后将滤液转移到分液漏斗中。
溶液,充分反应后将滤液转移到分液漏斗中。V.萃取:向分液漏斗中加入
 ,振荡,静置。待溶液完全分层后,取下层溶液。
,振荡,静置。待溶液完全分层后,取下层溶液。VI.含量测定:用色度计测定出所得溶液中碘的含量。
VII.回收处理:蒸馏碘的
 溶液,回收
溶液,回收
已知:海带灰化后,碘元素以
 的形式存在。
的形式存在。回答下列问题:
(1)第II步中的仪器A是
(2)证明第III步滤液中存在
 的实验方法是
的实验方法是(3)第IV步氧化过程中发生反应的离子方程式为
(4)第V步可得到
 的
的 溶液,也可用如下流程从其中回收
溶液,也可用如下流程从其中回收 :
:
请写出步骤II的离子方程式:
(5)碘浓度越大吸光度越大。用色度计测得某碘溶液的吸光度后,利用以溶液吸光度为纵坐标,碘浓度(
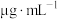 )为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取
)为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取 碘单质,用
碘单质,用 容量瓶配成碘的
容量瓶配成碘的 溶液,取出
溶液,取出 加入一定量
加入一定量 中配得第一份碘的标准溶液
中配得第一份碘的标准溶液 。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是
。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是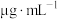 。
。(6)课题组在其他实验条件相同情况下,研究了不同灰化时间对碘提取效果的影响,其结果如图所示。灰化时间超过40min,测得碘的含量逐渐降低,原因是

您最近半年使用:0次
2023-07-03更新
|
135次组卷
|
2卷引用:山西省运城市2022-2023学年高一下学期期末考试化学试题
解题方法
5 . 碘和碘的化合物在有机化学中十分重要,另外在医药和照相方面的用途也很广泛。海带提碘的相关流程如下所示,已知 ,请回答下列问题:
,请回答下列问题:
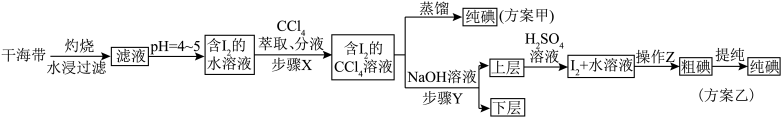
(1)海带灼烧的目的是_______ ;实验室进行此操作用到的主要仪器名称为_______ 。
(2)滤液得到含 的水溶液,除了调节
的水溶液,除了调节 ,还需要加入臭氧或过氧化氢,所加试剂在反应中作
,还需要加入臭氧或过氧化氢,所加试剂在反应中作_______ 剂(填“氧化”或“还原”),写出加入过氧化氢时发生反应的离子方程式:_______ 。
(3)步骤 是否可以用酒精代替
是否可以用酒精代替 ,并说明理由
,并说明理由_______ 。
(4)步骤 的操作为
的操作为_______ 。
(5)上层液体加入 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为_______ 。
(6)以上流程中可以循环使用的试剂是_______ 。
(7)加碘食盐中的碘以碘酸钾 形式存在,根据以上信息,可用试纸和一些常见试剂进行检验,证明食盐中存在
形式存在,根据以上信息,可用试纸和一些常见试剂进行检验,证明食盐中存在 。可供选用的物质有:①
。可供选用的物质有:① 试纸、②蓝色石蕊试纸、③碘化钾淀粉试纸、④蒸馏水、⑤食醋、⑥醇,进行上述实验时必须使用的物质是
试纸、②蓝色石蕊试纸、③碘化钾淀粉试纸、④蒸馏水、⑤食醋、⑥醇,进行上述实验时必须使用的物质是_______ (填序号)。
 ,请回答下列问题:
,请回答下列问题:
(1)海带灼烧的目的是
(2)滤液得到含
 的水溶液,除了调节
的水溶液,除了调节 ,还需要加入臭氧或过氧化氢,所加试剂在反应中作
,还需要加入臭氧或过氧化氢,所加试剂在反应中作(3)步骤
 是否可以用酒精代替
是否可以用酒精代替 ,并说明理由
,并说明理由(4)步骤
 的操作为
的操作为(5)上层液体加入
 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为(6)以上流程中可以循环使用的试剂是
(7)加碘食盐中的碘以碘酸钾
 形式存在,根据以上信息,可用试纸和一些常见试剂进行检验,证明食盐中存在
形式存在,根据以上信息,可用试纸和一些常见试剂进行检验,证明食盐中存在 。可供选用的物质有:①
。可供选用的物质有:① 试纸、②蓝色石蕊试纸、③碘化钾淀粉试纸、④蒸馏水、⑤食醋、⑥醇,进行上述实验时必须使用的物质是
试纸、②蓝色石蕊试纸、③碘化钾淀粉试纸、④蒸馏水、⑤食醋、⑥醇,进行上述实验时必须使用的物质是
您最近半年使用:0次
解题方法
6 . 海带提碘过程中以 为溶剂将
为溶剂将 从碘水溶液中提取出来,通过下列实验可从
从碘水溶液中提取出来,通过下列实验可从 的
的 溶液中回收
溶液中回收 。
。

下列说法错误的是
 为溶剂将
为溶剂将 从碘水溶液中提取出来,通过下列实验可从
从碘水溶液中提取出来,通过下列实验可从 的
的 溶液中回收
溶液中回收 。
。
下列说法错误的是
| A.以海带为原料得到碘水溶液的主要实验步骤:取样→灼烧→溶解→过滤 |
B.NaOH溶液与 反应的离子方程式: 反应的离子方程式: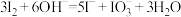 |
| C.过滤需要用到的玻璃仪器有玻璃棒、烧杯和漏斗 |
| D.回收的粗碘可通过升华进行纯化 |
您最近半年使用:0次
7 . 下列自然资源的开发利用中,说法正确的是
A.海水经萃取、蒸馏可提取 |
B.海带  I2 I2 |
C.从海水中可以得到NaCl,电解熔融NaCl可制备 |
| D.石油经分馏、裂解得到苯、甲苯、二甲苯、酚等 |
您最近半年使用:0次
名校
解题方法
8 . 将碘单质加到普通食盐中可制成加碘食盐,经常食用可消除碘缺乏贫。___
您最近半年使用:0次
解题方法
9 . 当今世界各国充分认识到海洋资源的重要性,海水的综合利用是当今的热点话题之一、
I.利用海水脱硫可以有效地解决煤燃烧过程中排放的SO2造成的一系列环境问题。其工艺流程如图所示:
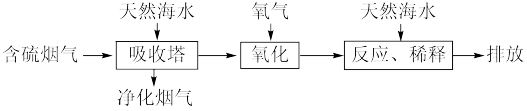
(1)天然海水(pH≈8)吸收含硫的烟气后,会溶有H2SO3、 等分子或离子,需要用氧气进行氧化处理,写出
等分子或离子,需要用氧气进行氧化处理,写出 参加反应的离子方程式
参加反应的离子方程式_______ 。
(2)氧化后的海水需要用大量的天然海水与之混合后才能排放。该操作的主要目的是_______ 。
II.从海水中提纯粗盐后的母液中含有K+、Na+和Mg2+等阳离子。对母液进行一系列的加工可制得金属镁。
(3)从离子反应的角度思考,在母液中加入石灰乳所起的作用是_______ 。
(4)电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是_______(填字母)。
III.海带中含有碘元素。从海带中提取碘的实验过程如下图:

(5)灼烧海带时盛装海带的仪器名称是_______ 。
(6)海带灰中含有硫酸镁、碳酸钠等,在实验步骤_______ (填序号)中实现与碘分离。
(7)写出步骤④反应的离子方程式_______ 。
I.利用海水脱硫可以有效地解决煤燃烧过程中排放的SO2造成的一系列环境问题。其工艺流程如图所示:

(1)天然海水(pH≈8)吸收含硫的烟气后,会溶有H2SO3、
 等分子或离子,需要用氧气进行氧化处理,写出
等分子或离子,需要用氧气进行氧化处理,写出 参加反应的离子方程式
参加反应的离子方程式(2)氧化后的海水需要用大量的天然海水与之混合后才能排放。该操作的主要目的是
II.从海水中提纯粗盐后的母液中含有K+、Na+和Mg2+等阳离子。对母液进行一系列的加工可制得金属镁。
(3)从离子反应的角度思考,在母液中加入石灰乳所起的作用是
(4)电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是_______(填字母)。
| A.O2 | B.N2 | C.Ar | D.水蒸气 |
III.海带中含有碘元素。从海带中提取碘的实验过程如下图:

(5)灼烧海带时盛装海带的仪器名称是
(6)海带灰中含有硫酸镁、碳酸钠等,在实验步骤
(7)写出步骤④反应的离子方程式
您最近半年使用:0次
2022-07-28更新
|
191次组卷
|
2卷引用:山西省晋中市平遥县第二中学校2022-2023学年高二上学期8月质检化学试题
10 . I.海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
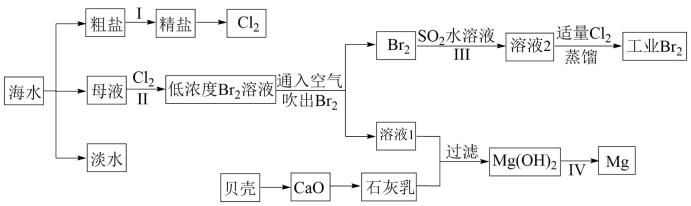
请回答下列问题:
(1)请列举除蒸馏法外海水淡化的一种方法:_______ 。
(2)步骤I中,粗盐中含有Ca2+、Mg2+、 等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是_______(填字母)。
等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是_______(填字母)。
(3)步骤II已经获得Br2,步骤III又将Br2还原为Br-,其目的是_______ 。
(4)写出步骤III反应的离子方程式:_______ 。
II.海洋植物如海带、海藻中含有丰富的碘元素。碘元素以碘离子的形式存在。实验室从海带中提取碘的流程如下:

(5)灼烧所用仪器有酒精灯、泥三角、_______ (填仪器名称)。
(6)向酸化的滤液中加入过氧化氢溶液,可将I-氧化为I2;请写出该反应的离子方程式:_______ 。

请回答下列问题:
(1)请列举除蒸馏法外海水淡化的一种方法:
(2)步骤I中,粗盐中含有Ca2+、Mg2+、
 等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是_______(填字母)。
等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是_______(填字母)。| A.①②③④ | B.②③④① | C.②④③① | D.③④②① |
(4)写出步骤III反应的离子方程式:
II.海洋植物如海带、海藻中含有丰富的碘元素。碘元素以碘离子的形式存在。实验室从海带中提取碘的流程如下:

(5)灼烧所用仪器有酒精灯、泥三角、
(6)向酸化的滤液中加入过氧化氢溶液,可将I-氧化为I2;请写出该反应的离子方程式:
您最近半年使用:0次



