福建省泰宁第一中学2020-2021学年高一下学期期中考试化学试题
福建
高一
期中
2021-06-07
354次
整体难度:
适中
考查范围:
有机化学基础、物质结构与性质、化学实验基础、化学与STSE、化学反应原理、常见无机物及其应用、认识化学科学、初中衔接知识点
一、单选题 添加题型下试题
| A.O2、O3是氧元素的同素异形体,性质都相似 |
| B.35Cl2与37Cl2互为同位素 |
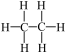
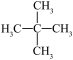
C.乙二醇(HO-CH2-CH2-OH) 和甘油(  )互为同系物 )互为同系物 |
D.CH3CHO 与 互为同分异构体 互为同分异构体 |
A. | B. |
C.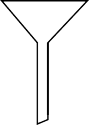 | D. |
【知识点】 物质的分离、提纯 物质分离、提纯的常见物理方法 萃取和分液解读
| A.甲烷与异丁烷互为同系物 |
| B.16O2、17O2、18O2是同种分子,且摩尔质量相同 |
| C.正丁烷和异丁烷互为同分异构体,且化学性质完全相同 |
| D.金刚石和足球烯C60互为同素异形体,且物理性质完全相同 |
| A.石油 | B.煤炭 | C.淀粉 | D.酒精 |
【知识点】 化学科学对人类文明发展的意义解读 石油裂化、裂解解读
| A.酸性强弱:HIO4>HBrO4>HClO4 | B.原子半径大小:Mg>P>N |
| C.碱性强弱:KOH>NaOH>LiOH | D.金属性强弱:Na>Mg>Al |
A(s)+2B(g)
 C(g)+D(g)已达到化学平衡状态的是
C(g)+D(g)已达到化学平衡状态的是| A.C的物质的量浓度 | B.混合气体的密度 |
| C.容器内压强 | D.混合气体的平均分子量 |
【知识点】 化学平衡状态的判断方法解读
| A.无色一氧化氮气体与空气接触变为红棕色 |
| B.往盐酸中滴加紫色石蕊试液,溶液变红色 |
| C.向硫酸铜溶液中滴加氢氧化钠溶液,出现白色沉淀 |
| D.将足量二氧化硫气体通入品红溶液,红色逐渐褪去 |
①v(A)=0.15 mol·L-1·s-1
②v(B)=0.6 mol·L-1·s-1
③v(C)=0.4 mol·L-1·s-1
④v(D)=0.45 mol·L-1·min-1
该反应进行的快慢顺序为( )
| A.② >④>③>① | B.④>②=③>① |
| C.②=③>①>④ | D.② >③=④>① |
【知识点】 化学反应速率与化学计量数之间的关系解读
①离子化合物一定含离子键,也可能含极性键或非极性键;
②共价化合物一定含共价键,也可能含离子键;
③含金属元素的化合物不一定是离子化合物;
④由非金属元素组成的化合物一定是共价化合物;
⑤由分子组成的物质中一定存在共价键;
⑥熔融状态能电离的化合物一定是离子化合物。
| A.①③⑤ | B.①③⑥ | C.②③④ | D.②④⑥ |
【知识点】 化学键与物质类别关系的判断解读
| A.只含有共价键的物质属于共价化合物 |
| B.共价化合物中一定不含离子键 |
| C.含有离子键的物质肯定含金属元素 |
| D.离子化合物中一定不含共价键 |
【知识点】 化学键与物质类别关系的判断解读
| A.干水是纯净物 | B.干水和干冰是同一种物质 |
| C.干水中的水分子不再运动 | D.用干水能更好地吸收CO2 |
【知识点】 无机物质的分类 化学科学对人类文明发展的意义解读 物质构成的奥秘

| A.其一氯代物只有一种 |
| B.其二氯代物有三种同分异构体 |
| C.是一种不饱和烃 |
D.与苯乙烯( )互为同分异构体 )互为同分异构体 |
【知识点】 同分异构体的数目的确定解读
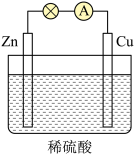
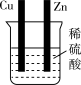
实验后的记录:
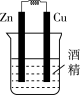
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu-→Zn
⑥正极反应式:Cu+2e-═Cu2+,发生氧化反应
| A.①②③ | B.②④ |
| C.②④⑥ | D.③④⑤ |
【知识点】 通过实验探究原电池原理解读 原电池正负极判断解读
①HCl比H2S稳定
②HCl和H2S的水溶液前者的酸性强
③HClO4酸性比H2SO3强
④Cl2能与H2S反应生成S
⑤Cl原子能得1个电子变成稳定离子而S原子能得两个电子形成稳定离子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
| A.②⑤ | B.①② | C.①②④ | D.②③⑤ |
【知识点】 元素非金属性强弱的比较方法解读
| X | Y | |
| Z | W |
| A.X、Y、Z三种元素所形成的单质中,X的单质最稳定 |
| B.Z元素的氧化物对应的水化物一定是一种强酸 |
| C.Z单质在Y单质中燃烧可反应生成ZY3 |
| D.Z单质与Fe反应生成的化合物中,铁元素显+3价 |
【知识点】 元素周期表提供的元素信息解读 元素周期律的应用
 8H2O晶体和NH4Cl晶体混合搅拌有氨气放出 ③浓硫酸稀释 ④氯酸钾分解 ⑤生石灰跟水反应
8H2O晶体和NH4Cl晶体混合搅拌有氨气放出 ③浓硫酸稀释 ④氯酸钾分解 ⑤生石灰跟水反应| A.② | B.①②④ | C.②④ | D.①④⑤ |
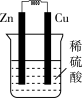
| A.负极是铝失电子被氧化 |
| B.该电池通常只需更换铝板就可继续使用 |
| C.以网状的铂为正极,可增大与氧气的接触面积 |
| D.电池工作时,电流由铝电极沿导线流向铂电极 |
①不跟碘和水发生反应 ②能溶于水 ③不溶于水 ④密度必须比水大 ⑤密度必须比水小 ⑥碘在该溶剂中的溶解度比在水中大
| A.①②④⑥ | B.①②⑤⑥ | C.①③⑥ | D.①②⑥ |
 ,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.6mol/L、0.3mol/L、0.6mol/L,当正、逆反应速率相等时,可能存在的数据是
,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.6mol/L、0.3mol/L、0.6mol/L,当正、逆反应速率相等时,可能存在的数据是| A.SO2为1.2mol/L、O2为0.6mol/L | B.SO2为0.75mol/L |
| C.SO2、SO3均为0.45mol/L | D.SO2为1.2mol/L |
 ,经5s反应达平衡,在此5s内C的平均反应速率为0.2mol/(L·s),同时生成1molD,下列叙述中不正确的是
,经5s反应达平衡,在此5s内C的平均反应速率为0.2mol/(L·s),同时生成1molD,下列叙述中不正确的是| A.反应达到平衡状态时A的转化率为60% |
| B.x=4 |
| C.平衡时,相同条件下容器内气体的压强与起始时压强比为6:5 |
| D.若混合气体的密度不再变化,则该可逆反应达到化学平衡状态 |
【知识点】 化学反应速率计算解读 化学平衡状态的判断方法解读
| A.556 kJ | B.496 kJ | C.336 kJ | D.188 kJ |
二、解答题 添加题型下试题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)地壳中含量最多的元素是
(3)单质常用作半导体材料的是
(4)Mg原子结构示意图为
(5)O和S中,原子半径较大的是
(6)CH4和NH3中,热稳定性较强的是
(7)新制氯水有漂白作用,是因为其中含有
(8)元素最高价氧化物对应水化物中,碱性最强的是
(9)某烃分子中含有6个碳原子,结构简式
 ,常用作有机溶剂。该有机物分子有
,常用作有机溶剂。该有机物分子有【知识点】 苯的取代反应解读 元素周期律、元素周期表的推断
三、填空题 添加题型下试题
请根据下列标准,对上述物质进行分类(填序号):
(1)属于共价化合物是
(2)只含离子键的化合物是
(3)含共价键的离子化合物是
(4)如果将NaHSO4溶于水,破坏了NaHSO4中化学键的类型为
Ⅱ.某温度时,在0.5L密闭容器中,某一反应中A、B气体的物质的量随时间变化的曲线如图所示,回答下列问题:
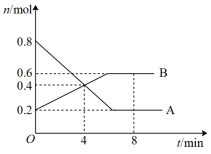
(1)该反应的化学方程式为
(2)第4min时,正、逆反应速率的大小关系为:v(正)
(3)下列措施能加快反应速率的是
A.恒温恒容充入He气B.缩小体积,使压强增大
C.恒温恒压充入He气D.使用催化剂
四、解答题 添加题型下试题
 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。(1)用C表示10s内反应的平均反应速率为
(2)反应前A的物质的量浓度是
(3)10s末,生成物D的浓度为
(4)反应过程中容器内气体的平均相对分子质量变化情况是
(5)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):
①降低温度
②恒容下充入氖气
II.某化学反应:3A(g)
 2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度c随时间t的变化情况如表:
2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度c随时间t的变化情况如表:| 实验序号 | t/min C/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.65 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)c2=
(2)在实验1和2中,有一个实验使用了催化剂,根据表中数据判断,使用催化剂的实验为
【知识点】 影响化学反应速率的因素 化学反应速率计算解读 化学平衡的有关计算

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.打开活塞b,将C中溶液滴入试管中并振荡、静置。
(1)验证氯气的氧化性强于碘的实验现象是
(2)B中溶液发生反应的离子方程式是
(3)为验证溴的氧化性强于碘,过程Ⅳ中试管的现象是
(4)试管B管口塞有浸有NaOH溶液的棉花的目的是
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐
【知识点】 同主族元素性质递变规律探究实验解读 物质性质的探究解读
试卷分析
试卷题型(共 27题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 同系物的判断 同分异构现象、同分异构体的概念 “四同”的相关比较 几组常见同素异形体 | |
| 2 | 0.94 | 物质的分离、提纯 物质分离、提纯的常见物理方法 萃取和分液 | |
| 3 | 0.85 | 同系物的判断 几组常见同素异形体 | |
| 4 | 0.94 | 化学科学对人类文明发展的意义 石油裂化、裂解 | |
| 5 | 0.85 | 同周期元素性质递变规律 同主族元素性质递变规律 同周期元素性质递变规律理解及应用 同主族元素性质递变规律理解及应用 | |
| 6 | 0.65 | 化学平衡状态的判断方法 | |
| 7 | 0.65 | 一氧化氮的化学性质 二氧化硫 | |
| 8 | 0.65 | 化学反应速率与化学计量数之间的关系 | |
| 9 | 0.85 | 烃、烷烃的概念 | |
| 10 | 0.85 | 化学键与物质类别关系的判断 | |
| 11 | 0.65 | 化学键与物质类别关系的判断 | |
| 12 | 0.94 | 无机物质的分类 化学科学对人类文明发展的意义 物质构成的奥秘 | |
| 13 | 0.65 | 同分异构体的数目的确定 | |
| 14 | 0.85 | 通过实验探究原电池原理 原电池正负极判断 | |
| 15 | 0.85 | 原电池的结构 | |
| 16 | 0.65 | 元素非金属性强弱的比较方法 | |
| 17 | 0.65 | 元素周期表提供的元素信息 元素周期律的应用 | |
| 18 | 0.65 | 常见能量转化形式 吸热反应和放热反应 | |
| 19 | 0.85 | 原电池 原电池原理的应用 原电池原理的综合应用 新型电池 | |
| 20 | 0.94 | 萃取和分液 | |
| 21 | 0.85 | 等效平衡 可逆反应及反应限度 化学平衡建立的过程 | |
| 22 | 0.65 | 化学反应速率计算 化学平衡状态的判断方法 | |
| 23 | 0.65 | 化学键与化学反应中的能量关系 根据△H=反应物的键能之和-生成物的键能之和进行计算 | |
| 二、解答题 | |||
| 24 | 0.85 | 苯的取代反应 元素周期律、元素周期表的推断 | 无机推断题 |
| 26 | 0.65 | 影响化学反应速率的因素 化学反应速率计算 化学平衡的有关计算 | 原理综合题 |
| 27 | 0.65 | 同主族元素性质递变规律探究实验 物质性质的探究 | 实验探究题 |
| 三、填空题 | |||
| 25 | 0.65 | 化学反应速率计算 浓度对化学反应速率的影响 催化剂对化学反应速率的影响 化学键概念理解及判断 | |