山西省大同市阳高县第四中学校2022-2023学年高二下学期7月期末考试化学试题
山西
高二
期末
2024-02-26
67次
整体难度:
适中
考查范围:
物质结构与性质、认识化学科学、有机化学基础、化学与STSE、常见无机物及其应用、化学实验基础、化学反应原理
山西省大同市阳高县第四中学校2022-2023学年高二下学期7月期末考试化学试题
山西
高二
期末
2024-02-26
67次
整体难度:
适中
考查范围:
物质结构与性质、认识化学科学、有机化学基础、化学与STSE、常见无机物及其应用、化学实验基础、化学反应原理
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
解题方法
1. 近日,温州大学王舜教授课题组与美国北德克萨斯大学ZhenhaiXia教授合作在杂原子掺杂碳的超级电容领域取得了新突破。下列C原子电子排布图表示的状态中能量关系正确的是


| A.①=②=③=④ | B.②>①>④>③ | C.④>③>①=② | D.④>③>①>② |
您最近一年使用:0次
2022-04-25更新
|
169次组卷
|
11卷引用:河北省张家口市第一中学2021届高三上学期期中考试(普通、实验班)化学试题
河北省张家口市第一中学2021届高三上学期期中考试(普通、实验班)化学试题(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记四川省内江市第六中学2020-2021学年高二上学期期中考试化学试题四川省达川第四中学2021-2022学年高二上学期第一次月考化学试题四川省遂宁市第二中学校2021-2022学年高二上学期期中考试化学试题四川省遂宁中学校2021-2022学年高二上学期期中考试化学试题浙江省宁波市六校2021-2022学年高二下学期期中联考化学试题浙江省温州市十校联合体2022-2023学年高二下学期期末联考化学试题天津市第一中学2022-2023学年高二上学期期末考试化学试题1.1原子结构模型(课中)-鲁科版选择性必修2山西省大同市阳高县第四中学校2022-2023学年高二下学期7月期末考试化学试题
单选题
|
适中(0.65)
解题方法
2. 下列关于物质的说法正确的是
| A.在金刚石晶体中,最小的环上有6个碳原子 |
| B.杯酚是一种常见的超分子,能与C60结合,不能与C70结合,因此可实现C60和C70的分离 |
| C.B3N3H6(无机苯)的结构与苯类似,其熔点主要取决于所含化学键的键能 |
| D.某些金属盐灼烧呈现不同焰色是因为电子从低能级跃迁至较高能级时吸收光的波长不同 |
您最近一年使用:0次
2023-06-25更新
|
140次组卷
|
2卷引用:浙江省温州市十校联合体2022-2023学年高二下学期期末联考化学试题
3. 关于方程式□C2H6O+□KMnO4+□H2SO4=□K2SO4+□X+□CO2↑+□H2O(未配平)下列说法正确的是
| A.X的化学式为K2MnO4 | B.氧化产物是CO2 |
| C.每消耗1molC2H6O需要转移的电子数为6NA | D.H2SO4的化学计量数为20 |
您最近一年使用:0次
2023-06-25更新
|
154次组卷
|
2卷引用:浙江省温州市十校联合体2022-2023学年高二下学期期末联考化学试题
单选题
|
适中(0.65)
解题方法
4. 某有机物的结构简式如图所示,下列说法不正确的是


| A.该物质含有两个手性碳原子,有旋光性 |
| B.1mol该物质与足量溴水反应,最多可消耗3molBr2 |
| C.该物质可以和碳酸钠、碳酸氢钠、盐酸反应 |
| D.该有机物的分子式为C12H10O4NBr |
您最近一年使用:0次
2023-06-25更新
|
139次组卷
|
2卷引用:浙江省温州市十校联合体2022-2023学年高二下学期期末联考化学试题
单选题
|
较易(0.85)
名校
解题方法
5. 从2月4日开幕到2月20日闭幕,为期17天的精彩冬奥,“中国之美”与“五环之美”交相辉映,中国式浪漫拨动了全世界的心弦。下列冬奥会有关物品所用材料属于合金的是
 |  |  |  |
| A.冰墩墩的外壳 | B.奥运火炬材料中的碳纤维 | C.高亭宇的冰刀 | D.谷爱凌的滑板 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-04-01更新
|
917次组卷
|
6卷引用:湖北省十一校2021-2022学年高三下学期第二次联考化学试题
湖北省十一校2021-2022学年高三下学期第二次联考化学试题(已下线)押全国卷理综第7题 化学与社会生产生活及传统文化-备战2022年高考化学临考题号押题(课标全国卷)宁夏石嘴山市第三中学2022届高三第三次模拟考试理综化学试题吉林省吉林市第一中学2021-2022学年高二下学期6月月考化学试题(理科创新班)河北省石家庄市元氏县第四中学2021-2022学年高二下学期期末考试化学试题山西省大同市阳高县第四中学校2022-2023学年高二下学期7月期末考试化学试题
单选题
|
适中(0.65)
解题方法
6. 下列离子方程式的书写正确的是
A.用醋酸除水垢: |
B.用氯化铁溶液刻蚀铜板: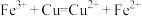 |
C.少量 加入 加入 溶液中: 溶液中: |
D.氯气充入冷的NaOH溶液中: |
您最近一年使用:0次
2022-07-14更新
|
94次组卷
|
2卷引用:湘鄂冀三省益阳平高学校、长沙市平高中学等七校联考2021-2022学年高二下学期期末考试化学试题
单选题
|
适中(0.65)
7. 铝电解厂烟气净化的一种简单流程如下,下列说法错误 的是


| A.HF是一种弱酸 |
B.吸收塔中反应的生成物主要是NaF与 |
| C.从流程中可以知道冰晶石在水中的溶解度不大 |
| D.滤液中的主要成分可以循环使用 |
您最近一年使用:0次
2022-07-14更新
|
73次组卷
|
2卷引用:湘鄂冀三省益阳平高学校、长沙市平高中学等七校联考2021-2022学年高二下学期期末考试化学试题
单选题
|
适中(0.65)
8. 一种锂-海水电池构造示意图如下。下列说法错误 的是


| A.电极M为负极 |
| B.海水的主要作用是提供电解质 |
| C.玻璃陶瓷不允许任何离子和分子通过 |
D.电极N的电极反应方程式可以是: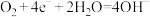 |
【知识点】 原电池原理的综合应用解读 新型电池解读
您最近一年使用:0次
2022-07-14更新
|
145次组卷
|
2卷引用:湘鄂冀三省益阳平高学校、长沙市平高中学等七校联考2021-2022学年高二下学期期末考试化学试题
单选题
|
容易(0.94)
名校
解题方法
9. NSR技术可有效降低柴油发动机在空气过量条件下 的排放,
的排放, 的储存和还原在不同时段交替进行,工作原理如图所示:
的储存和还原在不同时段交替进行,工作原理如图所示:
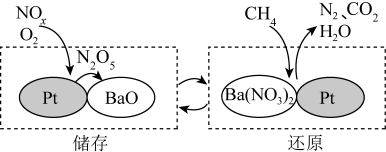
下列说法正确的是
 的排放,
的排放, 的储存和还原在不同时段交替进行,工作原理如图所示:
的储存和还原在不同时段交替进行,工作原理如图所示:
下列说法正确的是
A.柴油发动机中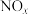 来源于柴油的不充分燃烧 来源于柴油的不充分燃烧 |
B. 转化为 转化为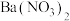 的过程实现 的过程实现 的还原 的还原 |
C.在储存和还原过程中只有 体现氧化性 体现氧化性 |
D.反应消耗的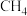 与 与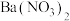 的物质的量之比是 的物质的量之比是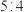 |
您最近一年使用:0次
2022-03-25更新
|
187次组卷
|
4卷引用:四川省遂宁中学校2021-2022学年高一下学期3月月考化学试题
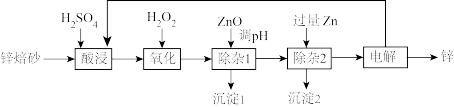
10. 锌是一种常用金属,工业上利用锌培砂(主要含ZnO、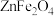 ,还含有少量CaO、FeO、CuO、NiO等)湿法制取金属锌的流程如图所示。已知:Fe的活泼性强于Ni。下列说法错误的是
,还含有少量CaO、FeO、CuO、NiO等)湿法制取金属锌的流程如图所示。已知:Fe的活泼性强于Ni。下列说法错误的是
 ,还含有少量CaO、FeO、CuO、NiO等)湿法制取金属锌的流程如图所示。已知:Fe的活泼性强于Ni。下列说法错误的是
,还含有少量CaO、FeO、CuO、NiO等)湿法制取金属锌的流程如图所示。已知:Fe的活泼性强于Ni。下列说法错误的是
A.加入 是为了将 是为了将 氧化为 氧化为 | B.ZnO可以用 代替 代替 |
| C.“沉淀2”中只含有两种金属 | D.可循环利用的物质为 |
您最近一年使用:0次
2022-05-28更新
|
270次组卷
|
4卷引用:湖南省百所学校2021-2022学年高二下学期5月联考化学试题
湖南省百所学校2021-2022学年高二下学期5月联考化学试题(已下线)3.3.3 盐类水解的应用-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)湖南省株洲市茶陵县2021-2022学年高二下学期期末考试化学试题山西省大同市阳高县第四中学校2022-2023学年高二下学期7月期末考试化学试题
单选题
|
容易(0.94)
解题方法
11. 莽草酸是一种可从中药八角茴香中提取的有机化合物,其结构简式如图所示,下列说法错误的是
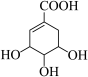

| A.莽草酸的分子式为C7H10O5 |
| B.莽草酸分子中有2种含氧官能团 |
| C.1mol莽草酸最多能与4molNa反应生成4molH2 |
| D.莽草酸既能使溴水褪色,也能使酸性KMnO4溶液褪色 |
您最近一年使用:0次
2023-07-05更新
|
225次组卷
|
2卷引用:福建省龙岩市2022-2023学年高一下学期期末教学质量检查化学试题
单选题
|
适中(0.65)
解题方法
12. 下列离子浓度的关系正确的是
| A.0.1mol·L-1K2S溶液中:c(H+)+c(HS-)+2c(H2S)=c(OH-) |
B.0.1mol·L-1NaHCO3溶液中:c( )+2c( )+2c( )+c(H2CO3)=c(Na+) )+c(H2CO3)=c(Na+) |
| C.等物质的量的CH3COONa和盐酸的混合溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
D.物质的量浓度相等的NH4Cl溶液、CH3COONH4溶液和NH4HSO4溶液中c( )依次增大 )依次增大 |
您最近一年使用:0次
2023-06-17更新
|
187次组卷
|
3卷引用:四川省成都市蓉城名校联2022-2023学年高二下学期期末联考化学试题
单选题
|
适中(0.65)
名校
13. “超钠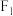 ”的工作原理是
”的工作原理是 ,下列叙述错误的是
,下列叙述错误的是
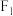 ”的工作原理是
”的工作原理是 ,下列叙述错误的是
,下列叙述错误的是| A.基态钠原子的最外层电子云轮廓图为球形 |
B. 的中心离子配位数为12 的中心离子配位数为12 |
| C.Mn位于元素周期表的d区 |
D.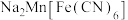 的配体中 的配体中 键和 键和 键的数目之比为 键的数目之比为 |
您最近一年使用:0次
2023-06-27更新
|
187次组卷
|
3卷引用:湖北省十堰市2022-2023学年高二下学期期末调研考试化学试题
单选题
|
适中(0.65)
解题方法
14. 下列离子方程式书写正确的是
| A.将少量CO2通入BaCl2溶液:CO2+Ba2++H2O=BaCO3↓+2H+ |
| B.AlCl3溶液和氨水反应:Al3++3OH-=Al(OH)3↓ |
C.向NaClO溶液中通少量SO2:2ClO-+SO2+H2O=2HClO+ |
D.向盐酸中滴入少量Na2CO3溶液: +2H+=CO2↑+H2O +2H+=CO2↑+H2O |
【知识点】 离子方程式的正误判断解读
您最近一年使用:0次
2023-06-17更新
|
130次组卷
|
2卷引用:四川省成都市蓉城名校联2022-2023学年高二下学期期末联考化学试题
二、解答题 添加题型下试题
15. 某脱硝技术的主要反应为4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) ∆H
4N2(g)+6H2O(g) ∆H
该过程中发生的副反应如下:(平衡常数的数据为773K时的数据)






(1)主反应的
_______ kJ/mol,773K时的平衡常数K=_______
(2)在密闭体系中进行上述实验,在不同温度下反应相同的时间,各组分的浓度如图所示,则图中曲线的斜率绝对值的大小_______ (填“能”或“不能”)代表反应进行的快慢。图中a、b、c三点中, 的生成速率最大的点是
的生成速率最大的点是_______

(3)主反应用到的催化剂中主要含有Fe、Mn、Ni等金属元素。将催化剂溶解,得到含有 、
、 、
、 等离子且浓度均为0.01mol/L的溶液。现用
等离子且浓度均为0.01mol/L的溶液。现用 溶液沉淀
溶液沉淀 与
与 来回收
来回收 。则溶液中的
。则溶液中的 离子浓度应控制在什么范围
离子浓度应控制在什么范围_______ (其中 、
、 、
、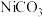 的
的 分别为
分别为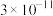 、
、 、
、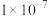 )
)
(4)电解法也是脱硝常用的方法。如图所示的电化学装置,反应时,左边区域产生浅绿色溶液,随后生成无色气体。当铁电极消耗5.6g时,理论上可以处理 含量为6.9%的废水
含量为6.9%的废水_______ g

 4N2(g)+6H2O(g) ∆H
4N2(g)+6H2O(g) ∆H该过程中发生的副反应如下:(平衡常数的数据为773K时的数据)






(1)主反应的

(2)在密闭体系中进行上述实验,在不同温度下反应相同的时间,各组分的浓度如图所示,则图中曲线的斜率绝对值的大小
 的生成速率最大的点是
的生成速率最大的点是
(3)主反应用到的催化剂中主要含有Fe、Mn、Ni等金属元素。将催化剂溶解,得到含有
 、
、 、
、 等离子且浓度均为0.01mol/L的溶液。现用
等离子且浓度均为0.01mol/L的溶液。现用 溶液沉淀
溶液沉淀 与
与 来回收
来回收 。则溶液中的
。则溶液中的 离子浓度应控制在什么范围
离子浓度应控制在什么范围 、
、 、
、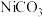 的
的 分别为
分别为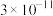 、
、 、
、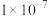 )
)(4)电解法也是脱硝常用的方法。如图所示的电化学装置,反应时,左边区域产生浅绿色溶液,随后生成无色气体。当铁电极消耗5.6g时,理论上可以处理
 含量为6.9%的废水
含量为6.9%的废水
您最近一年使用:0次
2022-07-14更新
|
50次组卷
|
2卷引用:湘鄂冀三省益阳平高学校、长沙市平高中学等七校联考2021-2022学年高二下学期期末考试化学试题
解答题-实验探究题
|
适中(0.65)
解题方法
16. 某化学小组采用类似制乙酸乙酯的装置,用环己醇制备环己烯:
已知: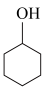
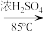
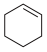 +H2O
+H2O
(1)制备粗品:采用如图所示装置,用环己醇制备环己烯。
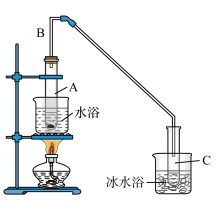
将10.0g环己醇加入试管A中,再加入1mL浓硫酸,摇匀放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是______ 。
②试管C置子冰水浴中的目的是_____ 。
(2)制备精品:
①环己烯粗品中含有环己醇和少量有机酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在______ 层(填“上”或“下),分液后用______ 洗涤(填字母)。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
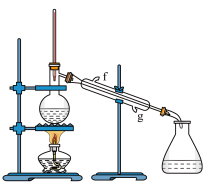
②再将环己烯按如图装置蒸馏。冷凝水从_____ 口进入(填“g”或“f”)。
③收集产品时,应收集______ ℃的馏分,若最终收集到环己烯5.74g,则产率为______ 。
已知:

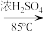
 +H2O
+H2O| 密度(g•cm-3) | 熔点(℃) | 沸点(℃) | 溶解性 | 摩尔质量(g/mol) | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 | 100 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 | 82 |

将10.0g环己醇加入试管A中,再加入1mL浓硫酸,摇匀放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是
②试管C置子冰水浴中的目的是
(2)制备精品:
①环己烯粗品中含有环己醇和少量有机酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按如图装置蒸馏。冷凝水从

③收集产品时,应收集
您最近一年使用:0次
2023-04-28更新
|
294次组卷
|
2卷引用:湖南省株洲市茶陵县2021-2022学年高二下学期期末考试化学试题
解答题-有机推断题
|
适中(0.65)
解题方法
17. 化合物H是制备药物洛索洛芬钠的关键中间体,其一种合成路线如下:
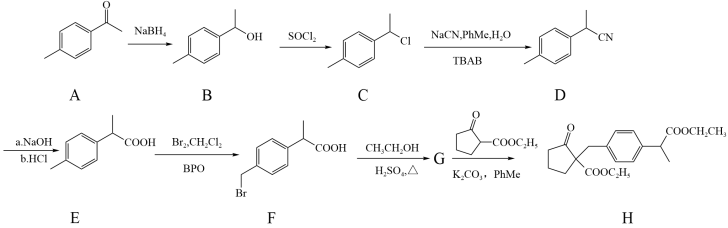
试回答下列问题:
(1)化合物A的名称为_______ ,B→C反应的反应类型为_______
(2)化合物C的分子式为_______ ,C分子中_______ (填“有”或“无”)手性碳原子
(3)F→G过程的化学方程式为_______
(4)化合物A的同分异构体中,满足以下条件的同分异构体有_______ 种
a.含有苯环 b.能发生银镜反应 c.苯环上有两个取代基
(5)设计以苯乙醇(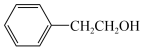 )为原料制备
)为原料制备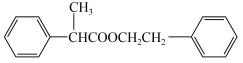 的合成路线。(无机试剂任选)
的合成路线。(无机试剂任选)_______

试回答下列问题:
(1)化合物A的名称为
(2)化合物C的分子式为
(3)F→G过程的化学方程式为
(4)化合物A的同分异构体中,满足以下条件的同分异构体有
a.含有苯环 b.能发生银镜反应 c.苯环上有两个取代基
(5)设计以苯乙醇(
 )为原料制备
)为原料制备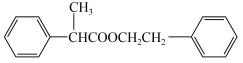 的合成路线。(无机试剂任选)
的合成路线。(无机试剂任选)
您最近一年使用:0次
2022-07-14更新
|
103次组卷
|
2卷引用:湘鄂冀三省益阳平高学校、长沙市平高中学等七校联考2021-2022学年高二下学期期末考试化学试题
解答题-工业流程题
|
适中(0.65)
解题方法
18. 重铬酸钠晶体(Na2Cr2O7·2H2O)是重要的基本化工原料,是化学实验中重要的氧化剂。工业生产中重铬酸钠晶体可用铬铁矿(主要成分为FeO·Cr2O3,还有少量SiO2和Al2O3)来制取,其流程如图所示。回答下列问题:
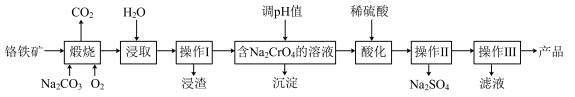
(1)“煅烧”过程中氧化Cr2O3发生反应的化学方程式为_____ 。
(2)“浸取”过程中所得溶液显碱性,其中除含有Na2CrO4外,还含有铝、硅元素的化合物,它们的化学式可能是_____ 。
(3)已知重铬酸钠晶体和硫酸钠的溶解度随温度的变化关系如图所示,操作Ⅱ是_____ 。

(4)“酸化”过程中加入稀硫酸酸化,溶液橙色变深,从化学平衡的角度解释其原因为_____ 。
(5)“操作Ⅲ”得到的滤液中含有重铬酸钠对水体有污染,通常加入亚硫酸钠转化为Cr3+,再加入氢氧化钠溶液使其转化为Cr(OH)3而除去,常温下要除去废液中多余的Cr3+,调节pH至少为_____ ,才能使铬离子沉淀完全(已知溶液中离子浓度小于1×10-5mol·L-1,则认为离子完全沉淀;Ksp[Cr(OH)3]=1×10-32)。

(1)“煅烧”过程中氧化Cr2O3发生反应的化学方程式为
(2)“浸取”过程中所得溶液显碱性,其中除含有Na2CrO4外,还含有铝、硅元素的化合物,它们的化学式可能是
(3)已知重铬酸钠晶体和硫酸钠的溶解度随温度的变化关系如图所示,操作Ⅱ是

(4)“酸化”过程中加入稀硫酸酸化,溶液橙色变深,从化学平衡的角度解释其原因为
(5)“操作Ⅲ”得到的滤液中含有重铬酸钠对水体有污染,通常加入亚硫酸钠转化为Cr3+,再加入氢氧化钠溶液使其转化为Cr(OH)3而除去,常温下要除去废液中多余的Cr3+,调节pH至少为
您最近一年使用:0次
2023-06-17更新
|
259次组卷
|
2卷引用:四川省成都市蓉城名校联2022-2023学年高二下学期期末联考化学试题
试卷分析
整体难度:适中
考查范围:物质结构与性质、认识化学科学、有机化学基础、化学与STSE、常见无机物及其应用、化学实验基础、化学反应原理
试卷题型(共 18题)
题型
数量
单选题
14
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 能级间能量大小比较 轨道表示式 电子基态与激发态 | |
| 2 | 0.65 | 电子基态与激发态 配合物的应用 分子晶体的物理性质 常见共价晶体的结构 | |
| 3 | 0.65 | 氧化还原反应的几组概念 氧化还原反应方程式的书写与配平 电子转移计算 | |
| 4 | 0.65 | 有机官能团的性质及结构 分子的手性 多官能团有机物的结构与性质 | |
| 5 | 0.85 | 高分子材料 金属材料的应用 新型无机非金属材料 | |
| 6 | 0.65 | 离子方程式的正误判断 氯气与碱溶液反应 碳酸氢钠与碱反应 Fe、Cu及相关离子的反应 | |
| 7 | 0.65 | 含氧化铝的混合物的提纯 物质分离、提纯的常见化学方法 常见无机物的制备 常见金属的冶炼 | |
| 8 | 0.65 | 原电池原理的综合应用 新型电池 | |
| 9 | 0.94 | 氧化还原反应的几组概念 氧化还原反应在生活、生产中的应用 | |
| 10 | 0.65 | 盐类水解在生活、生产中的应用 物质分离、提纯综合应用 常见无机物的制备 常见金属的冶炼 | |
| 11 | 0.94 | 有机官能团的性质及结构 常见官能团名称、组成及结构 多官能团有机物的结构与性质 | |
| 12 | 0.65 | 盐类水解规律理解及应用 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 13 | 0.65 | 物质结构与性质综合考查 共价键的形成及主要类型 配合物的概念、组成及形成条件 | |
| 14 | 0.65 | 离子方程式的正误判断 | |
| 二、解答题 | |||
| 15 | 0.65 | 盖斯定律与热化学方程式 化学平衡的移动及其影响因素 溶度积常数相关计算 电解原理的应用 | 原理综合题 |
| 16 | 0.65 | 化学实验基础操作 常见有机物的制备 | 实验探究题 |
| 17 | 0.65 | 有机反应类型 同分异构体的数目的确定 羧酸酯化反应 有机推断综合考查 | 有机推断题 |
| 18 | 0.65 | 氧化还原反应方程式的书写与配平 盐溶液中离子浓度大小的比较 溶度积常数相关计算 物质分离、提纯综合应用 | 工业流程题 |



