维持pH的稳定对生命体的生理活动、化学电源的高效工作等具有重要意义。
(1)常温下,在不同试剂中加入酸或碱后体系pH的变化如下表所示。
①a=____________ (忽略通入HCl气体前后体系的体积变化)。
②结合化学用语解释试剂ii显酸性的原因:____________ 。
③试剂ii中微粒浓度关系正确的有____________ (填序号)。
a. c(CH3COOH)>c(Na+)>c(CH3COO-)
b. 2c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-)
c. c(CH3COOH)+c(CH3COO-)=0.2 mol/L
④由表中数据可知,试剂ii的pH受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是____________ (填序号)。
a. HCl—NaCl b. Na2CO3—NaHCO3 c. NH3·H2O-NH4Cl d. KOH—KCl
(2)缓冲溶液应用在某种液钒电池中能稳定电池的输出电流,该电池装置示意图如下图所示,电池的总反应如下:
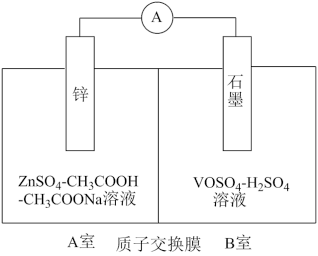
Zn+2VOSO4+2H2SO4 ZnSO4+V2(SO4)3+2H2O
ZnSO4+V2(SO4)3+2H2O
已知:VOSO4和V2(SO4)3的电离方程式分别为VOSO4=VO2++SO42-;V2(SO4)3=2V3++3SO42-;
①放电时,B室中c(H+)____________ (填“增大”“减小”或“不变”),结合化学用语说明理由:______ 。
②充电时,A室中的c(H+)变化缓慢的原因是____________ 。
(1)常温下,在不同试剂中加入酸或碱后体系pH的变化如下表所示。
| 试剂 | pH | ||
| 初始 | 通入0.01 mol HCl气体 | 加入0.01 mol NaOH固体 | |
| i.1 L H2O | 7 | a | 12 |
| ii.0.10 mol CH3COOH+0.10 mol CH3COONa配制成1 L的溶液 | 4.76 | 4.67 | 4.85 |
②结合化学用语解释试剂ii显酸性的原因:
③试剂ii中微粒浓度关系正确的有
a. c(CH3COOH)>c(Na+)>c(CH3COO-)
b. 2c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-)
c. c(CH3COOH)+c(CH3COO-)=0.2 mol/L
④由表中数据可知,试剂ii的pH受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是
a. HCl—NaCl b. Na2CO3—NaHCO3 c. NH3·H2O-NH4Cl d. KOH—KCl
(2)缓冲溶液应用在某种液钒电池中能稳定电池的输出电流,该电池装置示意图如下图所示,电池的总反应如下:

Zn+2VOSO4+2H2SO4
 ZnSO4+V2(SO4)3+2H2O
ZnSO4+V2(SO4)3+2H2O已知:VOSO4和V2(SO4)3的电离方程式分别为VOSO4=VO2++SO42-;V2(SO4)3=2V3++3SO42-;
①放电时,B室中c(H+)
②充电时,A室中的c(H+)变化缓慢的原因是
2020·北京海淀·二模 查看更多[1]
更新时间:2020-06-07 10:58:10
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)某次实验中将含11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液充分反应共放出12.46 kJ的热量,表示该反应的中和热的热化学方程式为_______ 。
(2)下列物质:①氯化钠晶体②盐酸③氨气④NH4Cl固体⑤汞⑥熔融的KNO3 ⑦硫酸钡⑧纯醋酸,其中能导电的是______ 属于强电解质的是_______ 属于非电解质的是_______ 。
(3)已知H2O2为一种二元弱酸,写出其第二步电离的电离方程式________ 。
(4)某溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,a+b=13,则此时温度T____ 25℃。(填“>”、“<”或“=”),若a>b,则该溶液可以是通过给纯水中加入下列哪些物质或操作来实现____
A.稀硫酸 B.金属钠 C.将纯水加热煮沸 D. 氨气
(2)下列物质:①氯化钠晶体②盐酸③氨气④NH4Cl固体⑤汞⑥熔融的KNO3 ⑦硫酸钡⑧纯醋酸,其中能导电的是
(3)已知H2O2为一种二元弱酸,写出其第二步电离的电离方程式
(4)某溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,a+b=13,则此时温度T
A.稀硫酸 B.金属钠 C.将纯水加热煮沸 D. 氨气
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】“神光二号”是我国研制的巨型激光器,其中使用了一种大型非线性光学晶体磷酸二氢钾(KH2PO4)。利用氟磷灰石[化学式为Ca5F(PO4)3]制备磷酸二氢钾晶体的工艺流程如图所示(不涉及本题的部分流程已省略)。
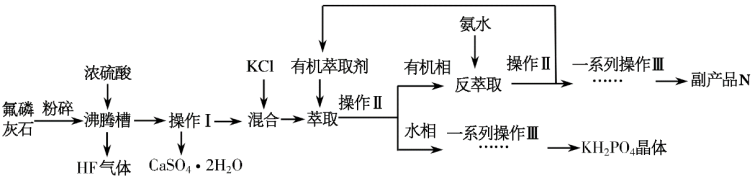
已知:萃取的主要反应原理为KCl+H3PO4 KH2PO4+HCl,其中反应产生的HCl易溶于有机萃取剂。
KH2PO4+HCl,其中反应产生的HCl易溶于有机萃取剂。
请回答下列问题:
(1)写出氟磷灰石在沸腾槽中发生的主要反应的化学方程式___________ ;已知盐酸的酸性比磷酸强,但萃取过程中可以通过反应KCl+H3PO4 KH2PO4+HCl在水相里得到KH2PO4,其原因是
KH2PO4+HCl在水相里得到KH2PO4,其原因是___________ 。
(2)沸腾槽不能使用二氧化硅陶瓷材质,其主要原因是___________ (用化学方程式表示)。
(3)通过一系列操作可得副产品N,写出N的化学式___________ ;得到KH2PO4晶体的一系列操作Ⅲ,其主要包括___________ 、过滤、洗涤、干燥等。
(4)用1000kg质量分数为50.4%的氟磷灰石样品来制取磷酸二氢钾晶体,实际得到316.2kg的KH2PO4,则其产率为___________ 。
(5)已知25℃时H3PO4的Ka1=7.1×10-3、Ka2=6.2×10-8、Ka3=4.5×10-13,试分析常温下KH2PO4溶液呈酸性的原因___________ 。
(6)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃制得白磷,同时逸出SiF4和CO,该反应的化学方程式为___________ 。

已知:萃取的主要反应原理为KCl+H3PO4
 KH2PO4+HCl,其中反应产生的HCl易溶于有机萃取剂。
KH2PO4+HCl,其中反应产生的HCl易溶于有机萃取剂。请回答下列问题:
(1)写出氟磷灰石在沸腾槽中发生的主要反应的化学方程式
 KH2PO4+HCl在水相里得到KH2PO4,其原因是
KH2PO4+HCl在水相里得到KH2PO4,其原因是(2)沸腾槽不能使用二氧化硅陶瓷材质,其主要原因是
(3)通过一系列操作可得副产品N,写出N的化学式
(4)用1000kg质量分数为50.4%的氟磷灰石样品来制取磷酸二氢钾晶体,实际得到316.2kg的KH2PO4,则其产率为
(5)已知25℃时H3PO4的Ka1=7.1×10-3、Ka2=6.2×10-8、Ka3=4.5×10-13,试分析常温下KH2PO4溶液呈酸性的原因
(6)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃制得白磷,同时逸出SiF4和CO,该反应的化学方程式为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如图:
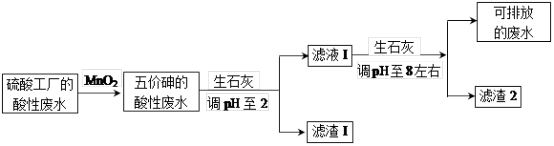
相关数据如表,请回答以下问题:
表1.几种盐的Ksp
表2.工厂污染物排放浓度及允许排放标准
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=_______ mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO )=
)=_______ mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为_______ 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为_______ ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为_______ 。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步电离的平衡常数的表达式为K3=_______ 。Na3AsO4的第一步水解的离子方程式为:AsO +H2O⇌HAsO
+H2O⇌HAsO +OH-,该步水解的平衡常数(25℃)为:
+OH-,该步水解的平衡常数(25℃)为:_______ (保留两位有效数字)。

相关数据如表,请回答以下问题:
表1.几种盐的Ksp
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
表2.工厂污染物排放浓度及允许排放标准
| 污染物 | H2SO4 | As |
| 废水浓度 | 29.4g/L | 1.6g·L-1 |
| 排放标准 | pH 6~9 | 0.5mg·L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO
 )=
)=(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步电离的平衡常数的表达式为K3=
 +H2O⇌HAsO
+H2O⇌HAsO +OH-,该步水解的平衡常数(25℃)为:
+OH-,该步水解的平衡常数(25℃)为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】实验室欲选择酚酞为指示剂用 的标准
的标准 溶液标定某品牌白醋中醋酸含量。
溶液标定某品牌白醋中醋酸含量。
(1)实验时用左手控制滴定管的活塞,右手摇动锥形瓶,眼睛注视___________ 。
(2)判断滴定终点的现象是___________ 。
(3)滴定过程中始终存在的等式关系是___________ 。
A.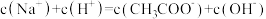 B.
B.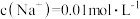
C.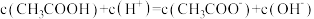 D.
D.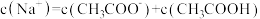
(4)恰好完全反应时溶液中的溶质为醋酸钠,此时向其中继续滴加氢氧化钠溶液,溶液中
___________ (填“增大”、“减小”或“不变”)。
(5)若在滴定前仰视读数,则测出醋酸的含量___________ (填“偏大”或“偏小”)。
 的标准
的标准 溶液标定某品牌白醋中醋酸含量。
溶液标定某品牌白醋中醋酸含量。(1)实验时用左手控制滴定管的活塞,右手摇动锥形瓶,眼睛注视
(2)判断滴定终点的现象是
(3)滴定过程中始终存在的等式关系是
A.
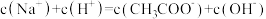 B.
B.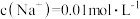
C.
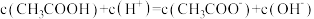 D.
D.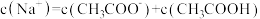
(4)恰好完全反应时溶液中的溶质为醋酸钠,此时向其中继续滴加氢氧化钠溶液,溶液中

(5)若在滴定前仰视读数,则测出醋酸的含量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某学习小组利用不同的方法探究中和反应,实验过程如下:
(1)方法一:酸碱中和滴定
用 的NaOH标准液滴定25.00mL未知浓度盐酸溶液。平行滴定三次所得的实验数据如下表:
的NaOH标准液滴定25.00mL未知浓度盐酸溶液。平行滴定三次所得的实验数据如下表:
①实验需用到的仪器为___________ (填标号),所选仪器在使用前需要___________ 。
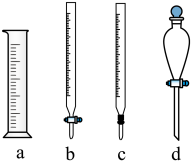
②若选用酚酞作为指示剂,则滴定终点的现象___________ 。
③盐酸溶液的浓度为___________ mol·L-1,下列操作会使测定结果偏大的是___________ (填标号)。
A.装待测液的锥形瓶未润洗 B.装标准液的仪器水洗后直接装液
C.滴定过程中,部分标准液滴到锥形瓶外 D.滴定终点读数时俯视刻度线
(2)方法二:DIS数字化信息系统可以准确测量溶液的pH。
Ⅰ.用0.10molL的NaOH溶液分别滴定10.00mL0.10mol/L的HCl和CH3COOH溶液,连接数据采集器和pH传感器。
Ⅱ.计算机绘制的滴定曲线如图:
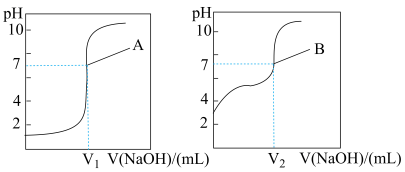
①曲线A对应的是___________ (填“盐酸”或“醋酸”)。
②两曲线图中V1___________ V2(填“>”“=”或“<”)。
③25℃时,0.10mol/L CH3COOH溶液与未知浓度的NaOH溶液等体积混合,所得溶液中c(CH3COOH)+c(CH3COO-)=___________ mol/L(溶液混合时液体积变化忽略不计)。
(1)方法一:酸碱中和滴定
用
 的NaOH标准液滴定25.00mL未知浓度盐酸溶液。平行滴定三次所得的实验数据如下表:
的NaOH标准液滴定25.00mL未知浓度盐酸溶液。平行滴定三次所得的实验数据如下表:| 实验次数 | 1 | 2 | 3 |
| 消耗标准液体积/mL | 20.02 | 23.45 | 19.98 |

②若选用酚酞作为指示剂,则滴定终点的现象
③盐酸溶液的浓度为
A.装待测液的锥形瓶未润洗 B.装标准液的仪器水洗后直接装液
C.滴定过程中,部分标准液滴到锥形瓶外 D.滴定终点读数时俯视刻度线
(2)方法二:DIS数字化信息系统可以准确测量溶液的pH。
Ⅰ.用0.10molL的NaOH溶液分别滴定10.00mL0.10mol/L的HCl和CH3COOH溶液,连接数据采集器和pH传感器。
Ⅱ.计算机绘制的滴定曲线如图:

①曲线A对应的是
②两曲线图中V1
③25℃时,0.10mol/L CH3COOH溶液与未知浓度的NaOH溶液等体积混合,所得溶液中c(CH3COOH)+c(CH3COO-)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】磷是重要的元素,能形成多种含氧酸和含氧酸盐。回答下列问题:
(1)次磷酸(H3PO2)是一种精细化工产品,向10mL H3PO2溶液中加入30mL等物质的量浓度的NaOH溶液后,所得的溶液中只有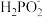 、OH-两种阴离子。则NaH2PO2属于
、OH-两种阴离子。则NaH2PO2属于_______ (填“正盐”或“酸式盐”)。
(2)亚磷酸(H3PO3)溶液存在电离平衡:H3PO3⇌H++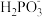 ,
,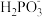 ⇌H++
⇌H++
①已知25C时,1mol•L-1的H3PO3溶液中,H3PO3的电离度为α,H3PO3的一级电离平衡常数Ka1=_______ (用含α的计算式表示,H3PO3第二步电离忽略不计,忽略水的电离)。
②常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示 的是曲线
的是曲线_______ (填“I”或“II”),亚磷酸(H3PO3)的Ka2=_______ 。
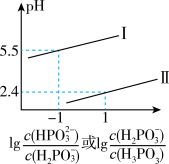
③请结合相关平衡常数判断NaH2PO3溶液显_______ 性(填“酸”、“中”或“碱”),其溶液中离子浓度大到小的顺序是_______ ,c(H+)- c(OH-)_______ c( )- c(H3PO3) (填“>”、“=”或“<”)。
)- c(H3PO3) (填“>”、“=”或“<”)。
(3)25℃时,HF 的电离常数为K=3.6×10-4;H3PO4的电离常数为K1=7.5×10 -3,K2=6.2×10 -8,K3=4.4×10 -13。足量 NaF溶液和 H3PO4溶液反应的离子方程式为:_______ 。
(1)次磷酸(H3PO2)是一种精细化工产品,向10mL H3PO2溶液中加入30mL等物质的量浓度的NaOH溶液后,所得的溶液中只有
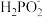 、OH-两种阴离子。则NaH2PO2属于
、OH-两种阴离子。则NaH2PO2属于(2)亚磷酸(H3PO3)溶液存在电离平衡:H3PO3⇌H++
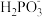 ,
,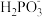 ⇌H++
⇌H++
①已知25C时,1mol•L-1的H3PO3溶液中,H3PO3的电离度为α,H3PO3的一级电离平衡常数Ka1=
②常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示
 的是曲线
的是曲线
③请结合相关平衡常数判断NaH2PO3溶液显
 )- c(H3PO3) (填“>”、“=”或“<”)。
)- c(H3PO3) (填“>”、“=”或“<”)。(3)25℃时,HF 的电离常数为K=3.6×10-4;H3PO4的电离常数为K1=7.5×10 -3,K2=6.2×10 -8,K3=4.4×10 -13。足量 NaF溶液和 H3PO4溶液反应的离子方程式为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
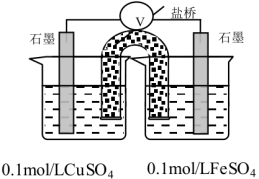
【推荐1】Ⅰ.某化学小组在学习元素周期律后,对卤素单质和拟卤素 的性质递变规律进行探究,利用如图装置可验证它们的性质规律。
的性质递变规律进行探究,利用如图装置可验证它们的性质规律。
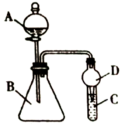
(1)仪器A的名称为______ ;干燥管D的作用为______ 。
(2)若A中加浓HSCN,B中加 ,已知
,已知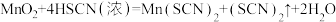 ,C中加淀粉碘化钾混合溶液,如果试管C中溶液变蓝,即可证明还原性
,C中加淀粉碘化钾混合溶液,如果试管C中溶液变蓝,即可证明还原性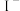
______  (填“
(填“ ”、“
”、“ ”、“
”、“ ”)。写出试管C中发生反应的离子方程式:
”)。写出试管C中发生反应的离子方程式:______ 。
Ⅱ.在探究 的性质实验时,做了以下3个实验:
的性质实验时,做了以下3个实验:
(3)试管1中反应的离子方程式为______ 。
(4)实验2前,小组同学预测经过步骤ii后溶液不应该呈现红色,依据是______ (结合方程式说明)。
(5)实验小组对白色沉淀的产生进行了深入探究,
查阅资料:i.CuSCN为难溶于水的白色固体;
ii. 被称为拟卤素离子,性质与卤素离子相似。
被称为拟卤素离子,性质与卤素离子相似。
经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能:
猜测①: 与KSCN发生了氧化还原反应,该反应的离子方程式
与KSCN发生了氧化还原反应,该反应的离子方程式______ ;
猜测②:亚铁离子将其还原 ,
,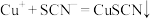
(6)根据实验3,得知猜测①是错误的。小组查阅资料并讨论后得出:溶液中离子在反应时所表现的氧化性强弱与相应还原产物的价态和状态有关。由此分析生成CuSCN沉淀使 的氧化性增强,根据学过的原电池原理设计成以下原电池装置,在左侧烧杯中滴入
的氧化性增强,根据学过的原电池原理设计成以下原电池装置,在左侧烧杯中滴入______ 溶液,若电流计______ ,则可以证明以上分析正确。
 的性质递变规律进行探究,利用如图装置可验证它们的性质规律。
的性质递变规律进行探究,利用如图装置可验证它们的性质规律。
(1)仪器A的名称为
(2)若A中加浓HSCN,B中加
 ,已知
,已知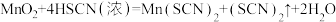 ,C中加淀粉碘化钾混合溶液,如果试管C中溶液变蓝,即可证明还原性
,C中加淀粉碘化钾混合溶液,如果试管C中溶液变蓝,即可证明还原性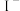
 (填“
(填“ ”、“
”、“ ”、“
”、“ ”)。写出试管C中发生反应的离子方程式:
”)。写出试管C中发生反应的离子方程式:Ⅱ.在探究
 的性质实验时,做了以下3个实验:
的性质实验时,做了以下3个实验:| 实验序号 | 试剂 | 实验步骤 | 实验现象 |
| 1 | 试管1中加2mL 0.05  溶液 溶液 | 加入1mL KSCN溶液 | 溶液变为血红色 |
| 2 | 试管2中加2mL 0.05  溶液 溶液 | I加入0.15g铜粉 | 黄色溶液变为澄清透明的浅蓝色 |
ii 再加入1滴0.1 KSCN溶液 KSCN溶液 | 液滴接触上方变为红色,下方有白色沉淀生成 | ||
| 3 | 试管3中加2mL 0.1  溶液 溶液 | 加入1mL KSCN溶液 | 溶液变成绿色 |
(4)实验2前,小组同学预测经过步骤ii后溶液不应该呈现红色,依据是
(5)实验小组对白色沉淀的产生进行了深入探究,
查阅资料:i.CuSCN为难溶于水的白色固体;
ii.
 被称为拟卤素离子,性质与卤素离子相似。
被称为拟卤素离子,性质与卤素离子相似。经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能:
猜测①:
 与KSCN发生了氧化还原反应,该反应的离子方程式
与KSCN发生了氧化还原反应,该反应的离子方程式猜测②:亚铁离子将其还原
 ,
,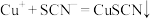
(6)根据实验3,得知猜测①是错误的。小组查阅资料并讨论后得出:溶液中离子在反应时所表现的氧化性强弱与相应还原产物的价态和状态有关。由此分析生成CuSCN沉淀使
 的氧化性增强,根据学过的原电池原理设计成以下原电池装置,在左侧烧杯中滴入
的氧化性增强,根据学过的原电池原理设计成以下原电池装置,在左侧烧杯中滴入
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】丙烯是三大合成材料的基本原料之一,可制备异丙醇、丙烯酸及其酯类等。
(1)丙烷在催化剂作用下能直接脱氢制备丙烯,已知丙烷、丙烯、氢气的燃烧热ΔH分别为−2219.9kJ·mol−1、−2058kJ·mol−1、−285.8kJ·mol−1。写出丙烷直接脱氢制备丙烯的热化学方程式:_______ 。
(2)以乙烯燃料电池为电源(如图1),电解二氧化碳酸性溶液可制得丙烯(如图2)。
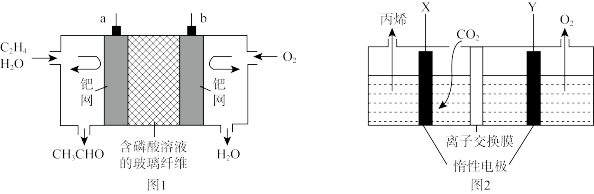
①a极发生_______ (填“氧化”或“还原”)反应,Y极与电源_______ (填“a”或“b”)极相连。
②X极的电极反应式为_______ 。
(3)酸性环境下,丙烯与水反应可以生成异丙醇,其反应过程如下:
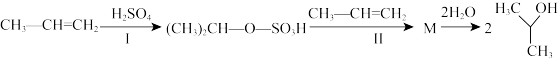
①H2SO4的作用是_______ ,反应I的类型是_______ 。
②反应II的化学方程式为_______ 。
(1)丙烷在催化剂作用下能直接脱氢制备丙烯,已知丙烷、丙烯、氢气的燃烧热ΔH分别为−2219.9kJ·mol−1、−2058kJ·mol−1、−285.8kJ·mol−1。写出丙烷直接脱氢制备丙烯的热化学方程式:
(2)以乙烯燃料电池为电源(如图1),电解二氧化碳酸性溶液可制得丙烯(如图2)。

①a极发生
②X极的电极反应式为
(3)酸性环境下,丙烯与水反应可以生成异丙醇,其反应过程如下:
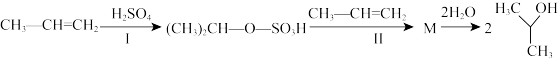
①H2SO4的作用是
②反应II的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】CO、CO2对环境都会产生一定危害,但它们也是重要的化工原料,工业上利用CO、CO2催化加氢制取甲醇,主要发生以下反应:反应I:CO(g)+2H2(g) CH3OH(g) ΔH1;
CH3OH(g) ΔH1;
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
(1)一定温度、压强下,由稳定单质生成1mol化合物的焓变称为该物质的摩尔生成焓。稳定单质的摩尔生成焓为0.已知CO2(g)、CH3OH(g)、H2O(g)的摩尔生成焓分别为-395kJ/mol、-201 kJ/mol、-242 kJ/mol,则在该条件下ΔH2=___________ 。
(2)在体系总压恒定为10kPa的密闭容器中,通入 3mol CO2和5mol H2发生反应Ⅱ,反应达平衡时,CO2转化率为50%,该温度下的平衡常数Kp=___________ (用平衡分压代替平衡浓度,平衡分压=总压×体积分数)。平衡后再充入2.5molCO2和2.5molH2O(g),此时v正_______ v逆(填“>”“<”或“=”)。
(3)利用反应Ⅰ和Ⅱ合成CH3OH,若氢碳比表示为f=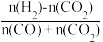 ,则理论上f=
,则理论上f=___________ 时,原料气的利用率最高。
(4)某实验小组研究T1、T2时CO与CO2间的转化,在密闭容器中发生反应CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,实验初始时体系中的c(CO)=c(H2O)、c (H2)=c(CO2),则平衡时lgc(CO)和lgc(H2)的关系如图所示。
CO2(g)+H2(g) ΔH<0,实验初始时体系中的c(CO)=c(H2O)、c (H2)=c(CO2),则平衡时lgc(CO)和lgc(H2)的关系如图所示。
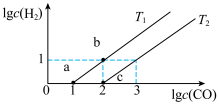
①根据图像判断:T1___________ T2 (填“>”“<”或“=”),T1时的平衡常数Kc=___________ 。
②由平衡状态a到b,改变的条件是___________ 。
(5)利用图所示装置可以将CO2转化为气体燃料CO(电解质溶液为稀硫酸),
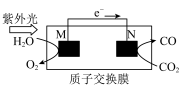
①该装置工作时,N电极的电极反应式为___________ 。
②导线中通过2mol电子后,假定体积不变,M极电解质溶液的pH___________ (填“增大”、“减小”或“不变”),N极电解质溶液质量的变化Δm=___________ g。
 CH3OH(g) ΔH1;
CH3OH(g) ΔH1;反应Ⅱ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2(1)一定温度、压强下,由稳定单质生成1mol化合物的焓变称为该物质的摩尔生成焓。稳定单质的摩尔生成焓为0.已知CO2(g)、CH3OH(g)、H2O(g)的摩尔生成焓分别为-395kJ/mol、-201 kJ/mol、-242 kJ/mol,则在该条件下ΔH2=
(2)在体系总压恒定为10kPa的密闭容器中,通入 3mol CO2和5mol H2发生反应Ⅱ,反应达平衡时,CO2转化率为50%,该温度下的平衡常数Kp=
(3)利用反应Ⅰ和Ⅱ合成CH3OH,若氢碳比表示为f=
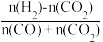 ,则理论上f=
,则理论上f=(4)某实验小组研究T1、T2时CO与CO2间的转化,在密闭容器中发生反应CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH<0,实验初始时体系中的c(CO)=c(H2O)、c (H2)=c(CO2),则平衡时lgc(CO)和lgc(H2)的关系如图所示。
CO2(g)+H2(g) ΔH<0,实验初始时体系中的c(CO)=c(H2O)、c (H2)=c(CO2),则平衡时lgc(CO)和lgc(H2)的关系如图所示。
①根据图像判断:T1
②由平衡状态a到b,改变的条件是
(5)利用图所示装置可以将CO2转化为气体燃料CO(电解质溶液为稀硫酸),

①该装置工作时,N电极的电极反应式为
②导线中通过2mol电子后,假定体积不变,M极电解质溶液的pH
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】下图两个实验装置是实现化学能和电能相互转化的装置。
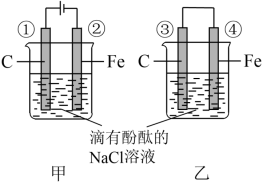
(1)把电能转化为化学能的装置是________ (填“甲”或“乙”)
(2)铁电极腐蚀更严重的装置是_______ (填“甲”或“乙”)
(3)②电极上的电极反应式为______________ ③电极上的电极反应式为________
(4)甲、乙两装置电极附近的溶液首先变红的电极是______
a.①② b②③ c③④ d①④
(5)写出装置甲反应的离子方程式________

(1)把电能转化为化学能的装置是
(2)铁电极腐蚀更严重的装置是
(3)②电极上的电极反应式为
(4)甲、乙两装置电极附近的溶液首先变红的电极是
a.①② b②③ c③④ d①④
(5)写出装置甲反应的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
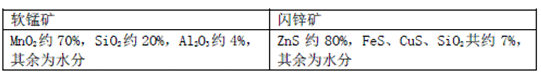
【推荐2】某地有软锰矿和闪锌矿两座矿山,它们的组成(质量分数)如下:
科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。
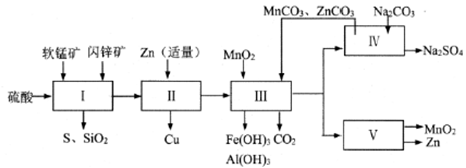
请回答下列问题。
(1)流程I所得滤液中含有MgSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,则流程I中被氧化的物质有_______ 种。
(2)流程II中反应的离子方程式为_____________ 。
(3)氢氧化物开始沉淀的pH如下表:
①流程III中MnO2的作用是将Fe2+氧化成Fe3+,不直接生成Fe(OH)3沉淀的原因是_________ 。
②MnCO3和ZnCO3的作用是______________ 。
(4)下图是Na2SO4和Na2SO4·10H2O的溶解度(g/100g水)曲线,又知MnCO3和ZnSO4的溶解度随温度的升高而增大,则流程IV得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、趁热过滤、_____ 、干燥,要“趁热”过滤的原因是:______________ 。
(5)本工艺所用的原料除软锰矿、闪锌矿、硫酸外还需要购买的原料是_______ 。
(6)流程V的反应为:MnSO4+ZnSO4+2H2O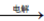 MnO2+Zn+2H2SO4,写出阳极反应式
MnO2+Zn+2H2SO4,写出阳极反应式________ 。
(7)MnO2和Zn可按物质的量之比1 : 1 生产锌-锰干电池,则从主产MnO2和Zn的角度计算,所用软锰矿和闪锌矿的质量比大约是__________ 。

科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。

请回答下列问题。
(1)流程I所得滤液中含有MgSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,则流程I中被氧化的物质有
(2)流程II中反应的离子方程式为
(3)氢氧化物开始沉淀的pH如下表:
| 氢氧化物 | Fe(0H)3 | Al(0H)3 | Fe(0H)2 |
| 开始沉淀pH | 1.5 | 3.3 | 7.6 |
①流程III中MnO2的作用是将Fe2+氧化成Fe3+,不直接生成Fe(OH)3沉淀的原因是
②MnCO3和ZnCO3的作用是
(4)下图是Na2SO4和Na2SO4·10H2O的溶解度(g/100g水)曲线,又知MnCO3和ZnSO4的溶解度随温度的升高而增大,则流程IV得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、趁热过滤、
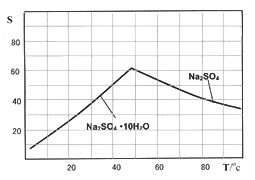
(5)本工艺所用的原料除软锰矿、闪锌矿、硫酸外还需要购买的原料是
(6)流程V的反应为:MnSO4+ZnSO4+2H2O
 MnO2+Zn+2H2SO4,写出阳极反应式
MnO2+Zn+2H2SO4,写出阳极反应式(7)MnO2和Zn可按物质的量之比1 : 1 生产锌-锰干电池,则从主产MnO2和Zn的角度计算,所用软锰矿和闪锌矿的质量比大约是
您最近一年使用:0次
【推荐3】二氧化碳催化加氢制甲醇,能助力“碳达峰”,涉及反应有:
反应①
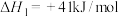
反应②
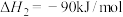
反应③

(1)反应②自发进行的条件是_______ (填“高温”、“低温”或“任意温度”),反应③
_______  。
。
(2)反应③在热力学上趋势大于反应①,其原因是_______ 。
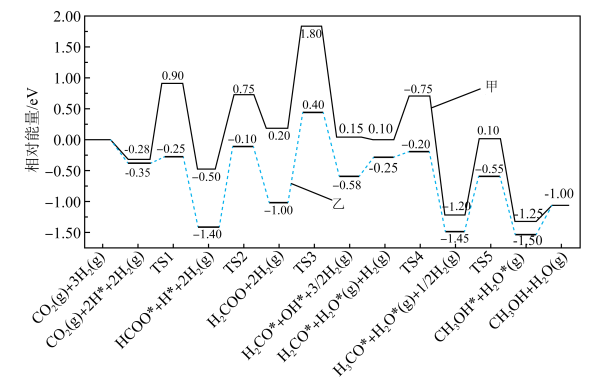
(3)反应③有催化剂和无催化剂作用下的反应机理如图所示(其中标有*的为吸附在催化剂表面上的物种,TS为过渡态),催化剂可使反应历程中决速步骤的活化能降低_______ eV(eV为能量单位)。 下,
下, 和
和 按物质的量之比为
按物质的量之比为 进行投料,只发生反应①和反应③,平衡时CO和
进行投料,只发生反应①和反应③,平衡时CO和 在含碳产物中的物质的量分数及
在含碳产物中的物质的量分数及 转化率随温度的变化如图所示。
转化率随温度的变化如图所示。_______ 。
②q曲线在250℃之后随温度升高而增大的原因是_______ 。
③250℃时,反应①的平衡常数
_______ ( 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
(5)向一定浓度的 溶液通入
溶液通入 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示(阴、阳极区溶液均为
,电解原理如图所示(阴、阳极区溶液均为 溶液)。电解过程中生成尿素的电极反应式为
溶液)。电解过程中生成尿素的电极反应式为_______ 。
反应①

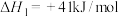
反应②

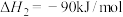
反应③


(1)反应②自发进行的条件是

 。
。(2)反应③在热力学上趋势大于反应①,其原因是
(3)反应③有催化剂和无催化剂作用下的反应机理如图所示(其中标有*的为吸附在催化剂表面上的物种,TS为过渡态),催化剂可使反应历程中决速步骤的活化能降低
 下,
下, 和
和 按物质的量之比为
按物质的量之比为 进行投料,只发生反应①和反应③,平衡时CO和
进行投料,只发生反应①和反应③,平衡时CO和 在含碳产物中的物质的量分数及
在含碳产物中的物质的量分数及 转化率随温度的变化如图所示。
转化率随温度的变化如图所示。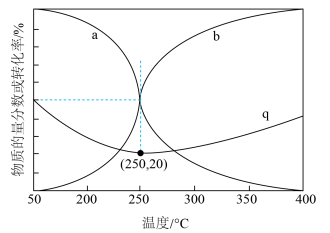
②q曲线在250℃之后随温度升高而增大的原因是
③250℃时,反应①的平衡常数

 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。(5)向一定浓度的
 溶液通入
溶液通入 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示(阴、阳极区溶液均为
,电解原理如图所示(阴、阳极区溶液均为 溶液)。电解过程中生成尿素的电极反应式为
溶液)。电解过程中生成尿素的电极反应式为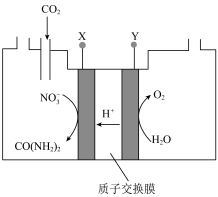
您最近一年使用:0次



