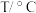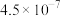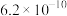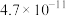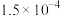多种短周期非金属元素的气态氧化物常会造成一些环境污染问题,化学工作者设计出将工业废气中污染物再利用的方案,以消除这些不利影响。
(1)以NH3、CO2为原料生产重要的高效氮肥——尿素[CO(NH2)2],两步反应的能量变化示意图如下:

写出以氨气和二氧化碳气体为原料合成尿素的热化学方程式_________ ,已知两步反应中第二步反应是生产尿素的决速步骤,可判断Ea1_____ Ea3(填“>”、“<”或“=”)。
(2)向体积为2 L的恒温恒容容器中通入2 mol CO和2 mol SO2,发生反应2CO(g)+SO2(g) 2CO2(g)+S(s)。若反应进行到10 min时达平衡,测得CO2的体积分数为0.5,则前16 min的平均反应速率v(CO)=
2CO2(g)+S(s)。若反应进行到10 min时达平衡,测得CO2的体积分数为0.5,则前16 min的平均反应速率v(CO)=____ ,该温度下反应化学平衡常数K=____ 。
(3)利用“亚硫酸盐法”吸收工业废气中的SO2。
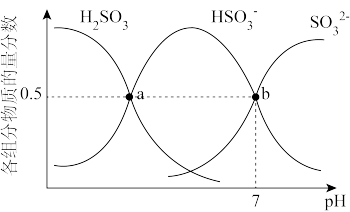
①室温条件下,将工业废气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示,b点溶液中n( )∶n(
)∶n( )=
)=________ 。
②已知室温条件下,Ka1(H2SO3) =1.5×10-2;Ka2(H2SO3) =1.0×10-7;Kb(NH3•H2O) =1.8×10-5。室温下,0.1mol•L-1的(NH4)2SO3溶液中离子浓度(不考虑OH-)由大到小顺序为________ 。
(4)利用电解烧碱和食盐的混合液,使工业废气脱氮,原理如图。
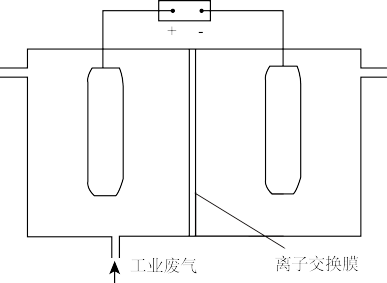
①NO被阳极产生的氧化性物质氧化为 反应的离子方程式:
反应的离子方程式:_________________ 。
②为使该电解装置能较长时间正常工作,保持两极电解质溶液导电能力相对稳定,该装置中应使用_______ 离子交换膜(填“阴”或“阳”)。
(1)以NH3、CO2为原料生产重要的高效氮肥——尿素[CO(NH2)2],两步反应的能量变化示意图如下:

写出以氨气和二氧化碳气体为原料合成尿素的热化学方程式
(2)向体积为2 L的恒温恒容容器中通入2 mol CO和2 mol SO2,发生反应2CO(g)+SO2(g)
 2CO2(g)+S(s)。若反应进行到10 min时达平衡,测得CO2的体积分数为0.5,则前16 min的平均反应速率v(CO)=
2CO2(g)+S(s)。若反应进行到10 min时达平衡,测得CO2的体积分数为0.5,则前16 min的平均反应速率v(CO)=(3)利用“亚硫酸盐法”吸收工业废气中的SO2。

①室温条件下,将工业废气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示,b点溶液中n(
 )∶n(
)∶n( )=
)=②已知室温条件下,Ka1(H2SO3) =1.5×10-2;Ka2(H2SO3) =1.0×10-7;Kb(NH3•H2O) =1.8×10-5。室温下,0.1mol•L-1的(NH4)2SO3溶液中离子浓度(不考虑OH-)由大到小顺序为
(4)利用电解烧碱和食盐的混合液,使工业废气脱氮,原理如图。

①NO被阳极产生的氧化性物质氧化为
 反应的离子方程式:
反应的离子方程式:②为使该电解装置能较长时间正常工作,保持两极电解质溶液导电能力相对稳定,该装置中应使用
更新时间:2020-06-29 21:26:52
|
相似题推荐
【推荐1】甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺CH3NH2的反应为是一个可逆的过程,以甲醇蒸气、氨气为原料合成,另一产物为水蒸气。已知该反应中相关化学键的键能数据如下:
则该反应的热化学方程式为:_______
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) CH3OH(g) ΔH<0在一定条件下,将1molCO和2molH2通入一个3L的密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0在一定条件下,将1molCO和2molH2通入一个3L的密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
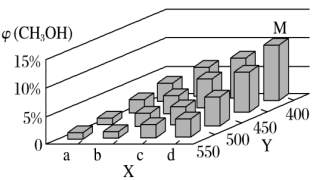
①平衡时,M点CH3OH的体积分数为10%,求该反应在400℃时的平衡常数K=_______ 。
②某同学认为上图中X轴表示压强,你认为他判断的理由是_______ 。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,同时生成I2,写出发生的化学反应方程式_______ 。
(4)HI的制备:将0.8molI2(g)和1.2molH2(g)置于某1L密闭容器中,在P0MPa、T℃的条件下发生反应:I2(g)+H2(g) 2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
①该反应进行到6min时体系内H2的分压为_______ 。(分压=总压×物质的量分数)
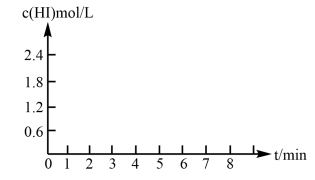
②反应达到平衡后,在7min时将容器体积压缩为原来的一半,请在图中画出c(HI)随时间变化的曲线。_______
(1)制取甲胺CH3NH2的反应为是一个可逆的过程,以甲醇蒸气、氨气为原料合成,另一产物为水蒸气。已知该反应中相关化学键的键能数据如下:
| 共价键 | C—O | H—O | N—H | C—N |
| 键能/(kJ/mol) | 351 | 463 | 393 | 293 |
则该反应的热化学方程式为:
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)
 CH3OH(g) ΔH<0在一定条件下,将1molCO和2molH2通入一个3L的密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0在一定条件下,将1molCO和2molH2通入一个3L的密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
①平衡时,M点CH3OH的体积分数为10%,求该反应在400℃时的平衡常数K=
②某同学认为上图中X轴表示压强,你认为他判断的理由是
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,同时生成I2,写出发生的化学反应方程式
(4)HI的制备:将0.8molI2(g)和1.2molH2(g)置于某1L密闭容器中,在P0MPa、T℃的条件下发生反应:I2(g)+H2(g)
 2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| HI体积分数 | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
①该反应进行到6min时体系内H2的分压为
②反应达到平衡后,在7min时将容器体积压缩为原来的一半,请在图中画出c(HI)随时间变化的曲线。

您最近一年使用:0次
【推荐2】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。
(1)与汽油相比,氢气作为燃料的优点是___________ (至少答出两点)。
(2)氢气可用于制备 ,已知:
,已知:
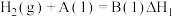
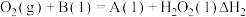
其中A、B为有机物,两反应均为自发反应,则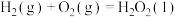 的
的
_______ 0(填“>”“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应: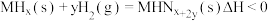 达到化学平衡。下列有关叙述正确的是
达到化学平衡。下列有关叙述正确的是___________ 。
a.容器内气体压强保持不变
b.吸收 只需
只需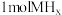
c.若升高温度,该反应的平衡常数增大
(4)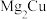 是一种储氢合金。350℃时,
是一种储氢合金。350℃时,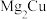 与
与 反应,生成
反应,生成 和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。
和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。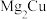 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
(5)电解法制取 可同时获得氢气:
可同时获得氢气: ,工作原理如图所示、通电后,铁电极附近生成紫红色
,工作原理如图所示、通电后,铁电极附近生成紫红色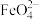 ,镍电极有气泡产生。若
,镍电极有气泡产生。若 溶液浓度过高,铁电极区会产生红褐色物质。已知:
溶液浓度过高,铁电极区会产生红褐色物质。已知: 只在强碱性条件下稳定,易被
只在强碱性条件下稳定,易被 还原。
还原。

①电解一段时间后, 降低的区域在
降低的区域在___________ 。(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出的原因是___________ 。
③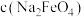 随初始
随初始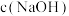 的变化如图,分析M、N点
的变化如图,分析M、N点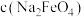 低于最高值的原因:
低于最高值的原因:___________ 。

(1)与汽油相比,氢气作为燃料的优点是
(2)氢气可用于制备
 ,已知:
,已知: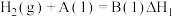
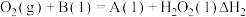
其中A、B为有机物,两反应均为自发反应,则
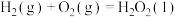 的
的
(3)在恒温恒容的密闭容器中,某储氢反应:
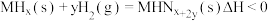 达到化学平衡。下列有关叙述正确的是
达到化学平衡。下列有关叙述正确的是a.容器内气体压强保持不变
b.吸收
 只需
只需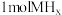
c.若升高温度,该反应的平衡常数增大
(4)
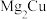 是一种储氢合金。350℃时,
是一种储氢合金。350℃时,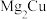 与
与 反应,生成
反应,生成 和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。
和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。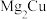 与
与 反应的化学方程式为
反应的化学方程式为(5)电解法制取
 可同时获得氢气:
可同时获得氢气: ,工作原理如图所示、通电后,铁电极附近生成紫红色
,工作原理如图所示、通电后,铁电极附近生成紫红色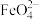 ,镍电极有气泡产生。若
,镍电极有气泡产生。若 溶液浓度过高,铁电极区会产生红褐色物质。已知:
溶液浓度过高,铁电极区会产生红褐色物质。已知: 只在强碱性条件下稳定,易被
只在强碱性条件下稳定,易被 还原。
还原。
①电解一段时间后,
 降低的区域在
降低的区域在②电解过程中,须将阴极产生的气体及时排出的原因是
③
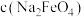 随初始
随初始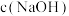 的变化如图,分析M、N点
的变化如图,分析M、N点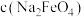 低于最高值的原因:
低于最高值的原因:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】二氧化硫、氯气、氯化亚砜等均为重要的工业原料。工业上用SO2、SCl2与Cl2反应合成氯化亚砜:SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)。该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
2SOCl2(g)。该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。

(1)在373K时,向10L的密闭容器中通入SO2、SCl2与Cl2均为0.20mol,发生上述反应。测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同,p0为初始压强)。
请回答下列问题:
①该反应的ΔH___ (填“>”“<”或“=”)0。
②I反应开始至达到平衡时,v(SOCl2)=___ 。
③若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是___ 。
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点。

①A点的数值为____ 。(已知:lg4=0.6)
②当升高到某一温度时,反应重新达到平衡,A点可能变化为___ 点。
(3)已知反应S4(g)+4Cl2(g)=4SCl2(g)的ΔH=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为___ kJ。
(4)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol/L,电离常数为Ka1=1.54×10-2,Ka2=1.02×10-7,向10mL饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL。
①当V=10mL时,溶液中存在:c(Na+)>c(HSO )>c(SO
)>c(SO )>c(H2SO3),则c(H+)
)>c(H2SO3),则c(H+)___ c(OH-)(填“大于”、“小于”或“等于”,下同)
②当V=amL时,溶液中离子浓度有如下关系:c(Na+)=2c(SO )+c(HSO
)+c(HSO );当V=bmL时,溶液中离子浓度有如下关系:c(Na+)=c(SO
);当V=bmL时,溶液中离子浓度有如下关系:c(Na+)=c(SO )+c(HSO
)+c(HSO )+c(H2SO3);则a
)+c(H2SO3);则a___ b。
(5)以SOCl2溶解四氯铝锂的溶液作为电解质溶液,用金属锂和石墨作电极材料,可组成一种常见的锂电池,电池的总反应式为8Li+3SOCl2=6LiCl+Li2SO3+2S,请写出该电池正极的电极反应方程式___ 。
 2SOCl2(g)。该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
2SOCl2(g)。该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
(1)在373K时,向10L的密闭容器中通入SO2、SCl2与Cl2均为0.20mol,发生上述反应。测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同,p0为初始压强)。
| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| Ⅰ | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| Ⅱ | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
①该反应的ΔH
②I反应开始至达到平衡时,v(SOCl2)=
③若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点。

①A点的数值为
②当升高到某一温度时,反应重新达到平衡,A点可能变化为
(3)已知反应S4(g)+4Cl2(g)=4SCl2(g)的ΔH=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为
(4)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol/L,电离常数为Ka1=1.54×10-2,Ka2=1.02×10-7,向10mL饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL。
①当V=10mL时,溶液中存在:c(Na+)>c(HSO
 )>c(SO
)>c(SO )>c(H2SO3),则c(H+)
)>c(H2SO3),则c(H+)②当V=amL时,溶液中离子浓度有如下关系:c(Na+)=2c(SO
 )+c(HSO
)+c(HSO );当V=bmL时,溶液中离子浓度有如下关系:c(Na+)=c(SO
);当V=bmL时,溶液中离子浓度有如下关系:c(Na+)=c(SO )+c(HSO
)+c(HSO )+c(H2SO3);则a
)+c(H2SO3);则a(5)以SOCl2溶解四氯铝锂的溶液作为电解质溶液,用金属锂和石墨作电极材料,可组成一种常见的锂电池,电池的总反应式为8Li+3SOCl2=6LiCl+Li2SO3+2S,请写出该电池正极的电极反应方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】燃煤烟气中含有 、CO、
、CO、 等气体,综合利用它们是科研的热点。
等气体,综合利用它们是科研的热点。
(1)已知:




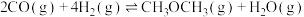

用 、
、 表示
表示 ,
,
___________ 。
(2)气体转化: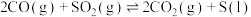
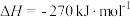 。
。
①相同条件下,分别选取 、NiO、
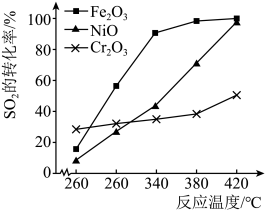
、NiO、 作上述反应的催化剂时,
作上述反应的催化剂时, 的转化率随温度的变化如图所示,研究得出应该选择
的转化率随温度的变化如图所示,研究得出应该选择 作催化剂,主要原因可能是
作催化剂,主要原因可能是___________ 。
②若在2L恒容密闭容器中,将3mol CO、1mol 混合,在一定条件下引发反应,当
混合,在一定条件下引发反应,当 的平衡转化率为40%时,此时,K=
的平衡转化率为40%时,此时,K=___________ 。
③向反应容器中再分别通入下列气体,可以使 转化率增大的是
转化率增大的是___________ (填字母)。
a.CO b. c.
c. d.
d.
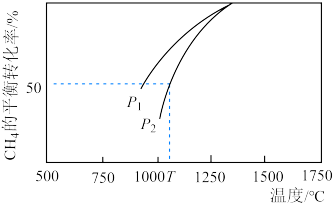
(3) 利用:密闭容器发生
利用:密闭容器发生 ,其中
,其中 与
与 的浓度均为0.1
的浓度均为0.1 ,在一定条件下反应,测得
,在一定条件下反应,测得 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强
___________  (填“>”或“<”=)。若
(填“>”或“<”=)。若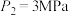 ,则T℃时该反应的平衡常数
,则T℃时该反应的平衡常数
___________  (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4) 捕捉:用100mL 0.1
捕捉:用100mL 0.1
 溶液完全捕捉0.22g
溶液完全捕捉0.22g  气体(溶液体积不变),所得溶液中
气体(溶液体积不变),所得溶液中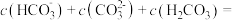
___________  ,此时溶液pH=a,
,此时溶液pH=a,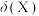 [分布系数(即含碳粒子组分的平衡浓度占含碳粒子总浓度的分数)],则
[分布系数(即含碳粒子组分的平衡浓度占含碳粒子总浓度的分数)],则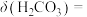
___________ (用含a、b、c的式子表示)。(已知 的两步电离常数
的两步电离常数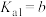 ,
,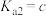 )
)
 、CO、
、CO、 等气体,综合利用它们是科研的热点。
等气体,综合利用它们是科研的热点。(1)已知:




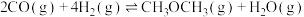

用
 、
、 表示
表示 ,
,
(2)气体转化:
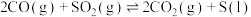
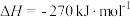 。
。①相同条件下,分别选取
 、NiO、
、NiO、 作上述反应的催化剂时,
作上述反应的催化剂时, 的转化率随温度的变化如图所示,研究得出应该选择
的转化率随温度的变化如图所示,研究得出应该选择 作催化剂,主要原因可能是
作催化剂,主要原因可能是
②若在2L恒容密闭容器中,将3mol CO、1mol
 混合,在一定条件下引发反应,当
混合,在一定条件下引发反应,当 的平衡转化率为40%时,此时,K=
的平衡转化率为40%时,此时,K=③向反应容器中再分别通入下列气体,可以使
 转化率增大的是
转化率增大的是a.CO b.
 c.
c. d.
d.
(3)
 利用:密闭容器发生
利用:密闭容器发生 ,其中
,其中 与
与 的浓度均为0.1
的浓度均为0.1 ,在一定条件下反应,测得
,在一定条件下反应,测得 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强
 (填“>”或“<”=)。若
(填“>”或“<”=)。若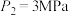 ,则T℃时该反应的平衡常数
,则T℃时该反应的平衡常数
 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)
 捕捉:用100mL 0.1
捕捉:用100mL 0.1
 溶液完全捕捉0.22g
溶液完全捕捉0.22g  气体(溶液体积不变),所得溶液中
气体(溶液体积不变),所得溶液中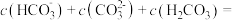
 ,此时溶液pH=a,
,此时溶液pH=a, [分布系数(即含碳粒子组分的平衡浓度占含碳粒子总浓度的分数)],则
[分布系数(即含碳粒子组分的平衡浓度占含碳粒子总浓度的分数)],则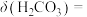
 的两步电离常数
的两步电离常数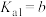 ,
,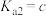 )
)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】工业合成氨反应为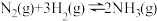 ,氨在工农业生产中应用广泛。
,氨在工农业生产中应用广泛。
(1)若在一容积为 的密闭容器中加入
的密闭容器中加入 的
的 和
和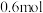 的
的 在一定条件下发生反应:
在一定条件下发生反应: 。下列情况可说明该反应已经达到化学平衡状态的是
。下列情况可说明该反应已经达到化学平衡状态的是___________ (填序号)。
a.反应不再进行,已经停止
b.单位时间内生成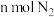 的同时,生成
的同时,生成
c.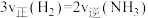
d. 、
、 和
和 的物质的量浓度之比为
的物质的量浓度之比为
e.混合气体的压强不再改变
f.混合气体的密度不再改变
(2)若在5分钟时反应达到平衡,此时测得 的物质的量为
的物质的量为 .则前5分钟的平均反应速率
.则前5分钟的平均反应速率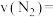
___________ 。
(3)平衡后,若提高 的转化率,可以采取的措施有___________。
的转化率,可以采取的措施有___________。
(4)若在 的密闭容器中,一定量的氮气和氢气进行如下反应:
的密闭容器中,一定量的氮气和氢气进行如下反应: ,其化学平衡常数K与温度T的关系如表所示:
,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较 、
、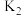 的大小,
的大小,
_____ 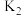 (填“<”“>”或“=”);
(填“<”“>”或“=”);
②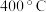 时,反应
时,反应 的化学平衡常数为
的化学平衡常数为___________ 。当测得 、
、 和
和 物质的量分别为
物质的量分别为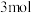 、
、 和
和 时,则该反应的
时,则该反应的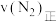
______ 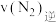 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
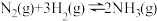 ,氨在工农业生产中应用广泛。
,氨在工农业生产中应用广泛。(1)若在一容积为
 的密闭容器中加入
的密闭容器中加入 的
的 和
和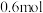 的
的 在一定条件下发生反应:
在一定条件下发生反应: 。下列情况可说明该反应已经达到化学平衡状态的是
。下列情况可说明该反应已经达到化学平衡状态的是a.反应不再进行,已经停止
b.单位时间内生成
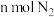 的同时,生成
的同时,生成
c.
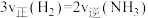
d.
 、
、 和
和 的物质的量浓度之比为
的物质的量浓度之比为
e.混合气体的压强不再改变
f.混合气体的密度不再改变
(2)若在5分钟时反应达到平衡,此时测得
 的物质的量为
的物质的量为 .则前5分钟的平均反应速率
.则前5分钟的平均反应速率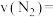
(3)平衡后,若提高
 的转化率,可以采取的措施有___________。
的转化率,可以采取的措施有___________。| A.加了催化剂 | B.增大容器体积 |
| C.降低反应体系的温度 | D.加入一定量 |
 的密闭容器中,一定量的氮气和氢气进行如下反应:
的密闭容器中,一定量的氮气和氢气进行如下反应: ,其化学平衡常数K与温度T的关系如表所示:
,其化学平衡常数K与温度T的关系如表所示:
| 200 | 300 | 400 |
K |
|
| 0.5 |
①试比较
 、
、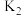 的大小,
的大小,
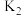 (填“<”“>”或“=”);
(填“<”“>”或“=”);②
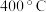 时,反应
时,反应 的化学平衡常数为
的化学平衡常数为 、
、 和
和 物质的量分别为
物质的量分别为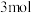 、
、 和
和 时,则该反应的
时,则该反应的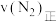
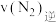 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氧硫化碳( ),用于合成除草剂、杀虫剂等,还能作为粮食熏蒸剂。完成下列填空:
),用于合成除草剂、杀虫剂等,还能作为粮食熏蒸剂。完成下列填空:
 、
、 分别与
分别与 反应均能制得
反应均能制得 ,反应如下:
,反应如下:
反应Ⅰ: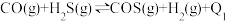
反应Ⅱ: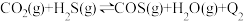
已知:在相同条件下,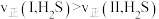
向两个容积相同的密闭容器中按下表投料( 不参与反应),分别发生上述反应。
不参与反应),分别发生上述反应。
图中实线a、b表示在相同的时间内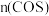 随温度的变化关系。
随温度的变化关系。
图中虚线c、d表示两反应的平衡曲线。
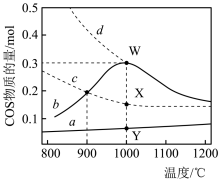
(1)W的坐标是(1000,0.3),W点 的转化率是
的转化率是_______ 。
(2)a是反应_______ (填“Ⅰ”或“Ⅱ”)的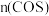 随温度的变化关系,依据是:
随温度的变化关系,依据是:_______ 。
(3)
_______ 0(填“>”或“<”),理由是:_______ 。
(4)下列结论正确的是_______(选填选项)。
 ),用于合成除草剂、杀虫剂等,还能作为粮食熏蒸剂。完成下列填空:
),用于合成除草剂、杀虫剂等,还能作为粮食熏蒸剂。完成下列填空: 、
、 分别与
分别与 反应均能制得
反应均能制得 ,反应如下:
,反应如下:反应Ⅰ:
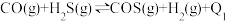
反应Ⅱ:
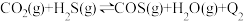
已知:在相同条件下,
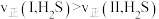
向两个容积相同的密闭容器中按下表投料(
 不参与反应),分别发生上述反应。
不参与反应),分别发生上述反应。| 反应Ⅰ | 反应Ⅱ | |||||
| 起始投料 |  |  |  |  |  |  |
起始物质的量( ) ) | 1 | 1 | 3 | 1 | 1 | 3 |
图中实线a、b表示在相同的时间内
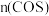 随温度的变化关系。
随温度的变化关系。图中虚线c、d表示两反应的平衡曲线。

(1)W的坐标是(1000,0.3),W点
 的转化率是
的转化率是(2)a是反应
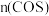 随温度的变化关系,依据是:
随温度的变化关系,依据是:(3)

(4)下列结论正确的是_______(选填选项)。
| A.曲线d为反应I的平衡曲线 |
B. 时,平衡常数 时,平衡常数 |
C.相同条件下,延长反应时间也不能使反应体系中Y点 的量达到W点 的量达到W点 |
D.恒温恒容下,向W点表示的反应体系中增大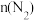 ,能提高 ,能提高 的转化率 的转化率 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】2023年杭州亚运会主火炬使用了零碳甲醇燃料,其制备共消耗了16万吨 。该甲醇的制备反应及副反应如下:
。该甲醇的制备反应及副反应如下:
i.

ii.
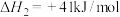
(1)研究表明,CO与 也能生成
也能生成 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:________ 。
(2)其他条件相同,当仅改变容器体积时,实验测得CO的平衡产率随着压强的增加而________ 。(填“增大”、“减小”或“不变”)
(3)在催化剂作用下,将 、
、 投入容积为1L的反应器,反应温度对
投入容积为1L的反应器,反应温度对 平衡转化率
平衡转化率 、
、 选择性Y(
选择性Y( )的影响如下。
)的影响如下。
240℃体系达到平衡时用时为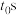 ,则
,则
________  。
。
240℃时反应i的化学平衡常数为________ (列出计算式即可,数据用小数表示)
(4)已知25℃时, 、
、 、HCN的电离平衡常数如下表。
、HCN的电离平衡常数如下表。
①25℃时,某 溶液的pH=8,关于此溶液中的微粒浓度,下列说法正确的是
溶液的pH=8,关于此溶液中的微粒浓度,下列说法正确的是________ 。
A.
B.
C.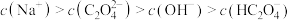
②将少量 溶液加入KCN溶液中,发生反应的离子方程式为
溶液加入KCN溶液中,发生反应的离子方程式为________ 。
(5) 电池可以实现对
电池可以实现对 的利用,该类电池放电的反应方程式为:
的利用,该类电池放电的反应方程式为: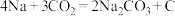 。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式
。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式________ 。
 。该甲醇的制备反应及副反应如下:
。该甲醇的制备反应及副反应如下:i.


ii.

(1)研究表明,CO与
 也能生成
也能生成 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:(2)其他条件相同,当仅改变容器体积时,实验测得CO的平衡产率随着压强的增加而
(3)在催化剂作用下,将
 、
、 投入容积为1L的反应器,反应温度对
投入容积为1L的反应器,反应温度对 平衡转化率
平衡转化率 、
、 选择性Y(
选择性Y( )的影响如下。
)的影响如下。

240℃体系达到平衡时用时为
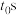 ,则
,则
 。
。240℃时反应i的化学平衡常数为
(4)已知25℃时,
 、
、 、HCN的电离平衡常数如下表。
、HCN的电离平衡常数如下表。
|
| HCN | |
|
|
|
|
|
|
| — |
 溶液的pH=8,关于此溶液中的微粒浓度,下列说法正确的是
溶液的pH=8,关于此溶液中的微粒浓度,下列说法正确的是A.

B.

C.
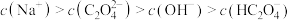
②将少量
 溶液加入KCN溶液中,发生反应的离子方程式为
溶液加入KCN溶液中,发生反应的离子方程式为(5)
 电池可以实现对
电池可以实现对 的利用,该类电池放电的反应方程式为:
的利用,该类电池放电的反应方程式为: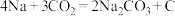 。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式
。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】请根据下列各题要求填空。
(1)已知CO(g)和CH3OH(l)的燃烧热△H分别为-283.0 kJ/mol和-726.5 kJ/mol。请写出甲醇不完全烧生成一氧化碳和液态水的热化学方程式:_______ 。
(2)用离子方程式表示泡沫灭火器灭火原理:_______ 。
(3)物质的量浓度相同的NaOH溶液、NH4Cl溶液等体积混合后,所得溶液中离子浓度由大到小的顺序是_______ 。
(4)一定温度、体积的密闭容器中,可逆反应A(s)+3B(g) 2C(g)达到平衡时,下列说法能判断该反应达到平衡的有
2C(g)达到平衡时,下列说法能判断该反应达到平衡的有_______ 。
①C的生成速率和C的分解速率相等
②单位时间内生成a mol A,同时生成3a mol B
③混合气体的密度不再变化
④A、B、C物质的量之比为1:3:2
⑤混合气体的总压强不再变化
⑥混合气体的平均相对分子质量不变
⑦容器中C的体积分数不变
(5)室温下,用0.100 mol/L盐酸溶液滴定20.00 mL0.100 mol/L的氨水溶液,滴定曲线如图所示。 点所示的溶液中c(Cl-)
点所示的溶液中c(Cl-) _______  (填“>”“<”或“
(填“>”“<”或“ ”)。
”)。

(1)已知CO(g)和CH3OH(l)的燃烧热△H分别为-283.0 kJ/mol和-726.5 kJ/mol。请写出甲醇不完全烧生成一氧化碳和液态水的热化学方程式:
(2)用离子方程式表示泡沫灭火器灭火原理:
(3)物质的量浓度相同的NaOH溶液、NH4Cl溶液等体积混合后,所得溶液中离子浓度由大到小的顺序是
(4)一定温度、体积的密闭容器中,可逆反应A(s)+3B(g)
 2C(g)达到平衡时,下列说法能判断该反应达到平衡的有
2C(g)达到平衡时,下列说法能判断该反应达到平衡的有①C的生成速率和C的分解速率相等
②单位时间内生成a mol A,同时生成3a mol B
③混合气体的密度不再变化
④A、B、C物质的量之比为1:3:2
⑤混合气体的总压强不再变化
⑥混合气体的平均相对分子质量不变
⑦容器中C的体积分数不变
(5)室温下,用0.100 mol/L盐酸溶液滴定20.00 mL0.100 mol/L的氨水溶液,滴定曲线如图所示。
 点所示的溶液中c(Cl-)
点所示的溶液中c(Cl-)  (填“>”“<”或“
(填“>”“<”或“ ”)。
”)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】草酸(H2C2O4)是一种还原性二元酸,存在于菠菜等植物中。
已知:常温下,草酸的电离常数K1=5.4 × 10-2,K2=5.4 × 10-5;溶度积常数Ksp(CaC2O4)=2.34 × 10-9,Ksp(CaSO4)=9.10 × 10-6。
请回答下列问题:
(1)生活中,长期将豆腐与菠菜混合食用,容易损失钙元素且易患胆结石疾病。简述理由:________ 。
(2)写出草酸在水中的电离方程式:______________ 。
(3)已知KHC2O4溶液呈酸性,则溶液中c(H2C2O4)________ c( )(填“>”“<”或“=”,下同)。若0.1 mol·L-1 H2C2O4溶液中第二步电离的c(H+)=a mol·L-1,则0.1 mol·L-1KHC2O4溶液中
)(填“>”“<”或“=”,下同)。若0.1 mol·L-1 H2C2O4溶液中第二步电离的c(H+)=a mol·L-1,则0.1 mol·L-1KHC2O4溶液中 电离出来的c(H+)
电离出来的c(H+)____________ amol·L-1。
(4)常温下,将某浓度的1 mL H2C2O4溶液加蒸馏水稀释,其溶液pH与加水稀释后溶液体积的关系如图所示。

能代表H2C2O4溶液稀释情况的是曲线______________ (填“I”或“II”)。 在稀释该溶液过程中,下列物理量始终增大的是________________ (填字母代号)。
A.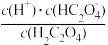 B.c(H+)·c(
B.c(H+)·c( )
)
C.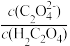 D.
D.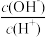
已知:常温下,草酸的电离常数K1=5.4 × 10-2,K2=5.4 × 10-5;溶度积常数Ksp(CaC2O4)=2.34 × 10-9,Ksp(CaSO4)=9.10 × 10-6。
请回答下列问题:
(1)生活中,长期将豆腐与菠菜混合食用,容易损失钙元素且易患胆结石疾病。简述理由:
(2)写出草酸在水中的电离方程式:
(3)已知KHC2O4溶液呈酸性,则溶液中c(H2C2O4)
 )(填“>”“<”或“=”,下同)。若0.1 mol·L-1 H2C2O4溶液中第二步电离的c(H+)=a mol·L-1,则0.1 mol·L-1KHC2O4溶液中
)(填“>”“<”或“=”,下同)。若0.1 mol·L-1 H2C2O4溶液中第二步电离的c(H+)=a mol·L-1,则0.1 mol·L-1KHC2O4溶液中 电离出来的c(H+)
电离出来的c(H+)(4)常温下,将某浓度的1 mL H2C2O4溶液加蒸馏水稀释,其溶液pH与加水稀释后溶液体积的关系如图所示。

能代表H2C2O4溶液稀释情况的是曲线
A.
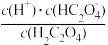 B.c(H+)·c(
B.c(H+)·c( )
)C.
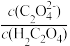 D.
D.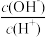
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】锡基轴承合金的主要成分是锡(Sn)、铅(Pb)、锑(Sb)、铜(Cu),某工厂采用如下工艺实现成分金属的回收。

已知:“浸出液”中主要溶质为Na2SnO3、Na3SbO4、Na2PbO2均为强电解质。
回答下列问题:
(1)Sn与C同主族,则基态Sn原子的价层电子排布式为___________ 。
(2)“浸出渣”的主要成分为___________ 。
(3)“沉铅”时,该反应只有Na2PbO2与H2S等物质的量发生反应,___________ (填“是”或“不是”) 氧化还原反应; “沉铅”后溶液的 pH 值___________ (填“增大”“减小” 或 “不变” )。
(4)“沉锑”时发生反应的离子方程式为___________ ;(沉锑后主要溶质为Na2SnO3、NaOH)。
(5)“还原”时发生的反应类似于工业制粗硅,写出还原过程发生反应的化学方程式:___________ 。
(6)制得的粗锡中含有少量金属Pb、Sb,常采用电解法精炼。其中SnSO4溶液作为电解液,精锡连接电源的___________ 极。阳极泥中含有 Sb、PbSO4,则阳极的电极反应式为___________ 。

已知:“浸出液”中主要溶质为Na2SnO3、Na3SbO4、Na2PbO2均为强电解质。
回答下列问题:
(1)Sn与C同主族,则基态Sn原子的价层电子排布式为
(2)“浸出渣”的主要成分为
(3)“沉铅”时,该反应只有Na2PbO2与H2S等物质的量发生反应,
(4)“沉锑”时发生反应的离子方程式为
(5)“还原”时发生的反应类似于工业制粗硅,写出还原过程发生反应的化学方程式:
(6)制得的粗锡中含有少量金属Pb、Sb,常采用电解法精炼。其中SnSO4溶液作为电解液,精锡连接电源的
您最近一年使用:0次
【推荐2】(1)T℃时,在1L密闭容器中A气体与B气体反应生成C气体。在2分钟内用A的浓度变化表示的平均反应速率为___________ mol·L-1·min-1。
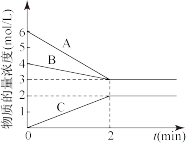
(2)若该反应放出热量,升高温度时,化学反应速率___________ (填“增大”或“减小”),平衡向___________ (填“正”或“逆”)反应方向移动。
(3)如图是电解400mLNaCl溶液的示意图。

①石墨电极上的反应式为___________ ;
②电解一段时间后,若转移电子0.04mol则所得溶液的pH等于___________ 。
(4)水溶液中的离子平衡是化学反应原理的重要内容。
①常温下,0.1mol/LNH4Cl溶液呈_______ (填“酸”“碱”或“中”)性,溶液中c(NH )
)_______ (填“>”“<”或“=”)c(Cl-);
②氢气是一种清洁燃料,已知1mol氢气的燃烧放热为285.8kJ,请写出氢气燃烧的热化学方程式:___________ 。

(2)若该反应放出热量,升高温度时,化学反应速率
(3)如图是电解400mLNaCl溶液的示意图。

①石墨电极上的反应式为
②电解一段时间后,若转移电子0.04mol则所得溶液的pH等于
(4)水溶液中的离子平衡是化学反应原理的重要内容。
①常温下,0.1mol/LNH4Cl溶液呈
 )
)②氢气是一种清洁燃料,已知1mol氢气的燃烧放热为285.8kJ,请写出氢气燃烧的热化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某校学习小组探究不同条件对电解 溶液产物的影响。所用实验装置如下图所示,其中电极为石墨电极。
溶液产物的影响。所用实验装置如下图所示,其中电极为石墨电极。

【查阅文献】i. 、
、 在溶液中通过与
在溶液中通过与 结合形成
结合形成 、
、 ,可降低正电荷。
,可降低正电荷。
ii.电解过程中外界条件(如电解液pH、离子浓度、电压、电极材料)会影响离子放电能力。
【实验记录】
(1)结合阴极实验现象的分析
①实验Ⅰ中阴极的电极反应为___________ 。
②实验Ⅱ中阴极的电极反应为___________ 。
③对比实验Ⅰ、Ⅱ的阴极现象,可以获得的结论是___________ 。
(2)甲同学认为实验Ⅰ中 没有放电,得出此结论依据的实验现象是
没有放电,得出此结论依据的实验现象是___________ 。阳极附近溶液滴加KSCN溶液变红,依现象分析,阳极反应的电极反应式可能是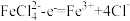 或
或___________ 。
(3)乙同学改变了该电解实验的某一外界条件,在阳极看到“湿润淀粉碘化钾试纸变蓝”的现象。你认为他改变的外界条件是___________ ,请设计相应的验证实验方案___________ 。
 溶液产物的影响。所用实验装置如下图所示,其中电极为石墨电极。
溶液产物的影响。所用实验装置如下图所示,其中电极为石墨电极。
【查阅文献】i.
 、
、 在溶液中通过与
在溶液中通过与 结合形成
结合形成 、
、 ,可降低正电荷。
,可降低正电荷。ii.电解过程中外界条件(如电解液pH、离子浓度、电压、电极材料)会影响离子放电能力。
【实验记录】
| 序号 | 实验条件 | 实验现象 | |
| 阴极 | 阳极 | ||
| Ⅰ |  (即 (即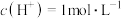 ) )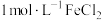 溶液 溶液电压1.5V | 电极上产生无色气体。 | ①湿润淀粉碘化钾试纸始终未见变蓝。 ②取阳极附近溶液于试管中,滴加KSCN溶液,溶液变红。 |
| Ⅱ |  (即 (即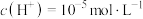 ) )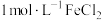 溶液 溶液电压1.5V | ①未观察到气泡产生,电极表面有银灰色金属光泽的固体析出。 ②电解结束后,将电极浸泡在盐酸中,观察到有大量气泡产生。 | ①湿润淀粉碘化钾试纸始终未见变蓝。 ②阳极附近出现红褐色浑浊。取阳极附近浊液于试管中,先用盐酸酸化,再滴加KSCN溶液,溶液变红。 |
(1)结合阴极实验现象的分析
①实验Ⅰ中阴极的电极反应为
②实验Ⅱ中阴极的电极反应为
③对比实验Ⅰ、Ⅱ的阴极现象,可以获得的结论是
(2)甲同学认为实验Ⅰ中
 没有放电,得出此结论依据的实验现象是
没有放电,得出此结论依据的实验现象是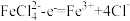 或
或(3)乙同学改变了该电解实验的某一外界条件,在阳极看到“湿润淀粉碘化钾试纸变蓝”的现象。你认为他改变的外界条件是
您最近一年使用:0次