某学习小组同学研究过氧化氢溶液与氢碘酸的反应,查到一组室温时的实验数据如表所示。
(1)过氧化氢溶液与氢碘酸反应的化学方程式为_______ 。
(2)由表中编号为①②③的实验数据得到的结论是_______ 。
(3)若该反应的速率方程可表示为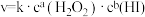 ,对比表中数据可知
,对比表中数据可知
_______ ,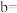
_______ 。
(4)资料显示编号①的反应进行至 时,测得氢碘酸的浓度为
时,测得氢碘酸的浓度为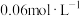 ,此时
,此时 的转化率为
的转化率为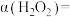
_______  。
。
(5)该小组同学将实验编号④的温度升高,发现到一定温度时,溶液出现棕黄色所需时间变长,可能的原因_______ 。
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
 | 0.1 | 0.1 | 0.1 | 0.2 | 0.3 |
 | 0.1 | 0.2 | 0.3 | 0.1 | 0.1 |
从混合至溶液出现棕黄色的时间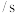 | 13 | 6.5 | 4.3 | 6.6 | 4.4 |
(2)由表中编号为①②③的实验数据得到的结论是
(3)若该反应的速率方程可表示为
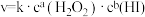 ,对比表中数据可知
,对比表中数据可知
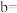
(4)资料显示编号①的反应进行至
 时,测得氢碘酸的浓度为
时,测得氢碘酸的浓度为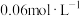 ,此时
,此时 的转化率为
的转化率为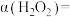
 。
。(5)该小组同学将实验编号④的温度升高,发现到一定温度时,溶液出现棕黄色所需时间变长,可能的原因
更新时间:2022-01-24 18:00:27
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】碘在科研与生活中有重要作用,某兴趣小组用0.20 mol/L KI、0.4%淀粉溶液、0.20 mol/L K2S2O8、0.010 mol/L Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O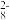 +2I-=2SO
+2I-=2SO +I2(慢);I2+2S2O
+I2(慢);I2+2S2O =2I-+S4O
=2I-+S4O (快)
(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O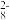 ):n(S2O
):n(S2O )
)_____________ 。
(2)如果实验中不使用Na2S2O3溶液,可能存在的不足是__________________ 。
(3)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
表中V1 =____________ mL,理由是_______________ ;V2 =__________ mL,理由是___________________ 。显色时间t1大约是_______________ 。
(4)根据表中数据可以得出的结论是_______________________ 。
已知:S2O
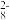 +2I-=2SO
+2I-=2SO +I2(慢);I2+2S2O
+I2(慢);I2+2S2O =2I-+S4O
=2I-+S4O (快)
(快)(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O
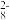 ):n(S2O
):n(S2O )
)(2)如果实验中不使用Na2S2O3溶液,可能存在的不足是
(3)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 试剂体积 V / mL | 显色时间 t /s | ||||
| K2S2O8溶液 | KI溶液 | 水 | Na2S2O3溶液 | 淀粉溶液 | ||
| ① | 10 | 10 | 0 | 4 | 1 | 26.8 |
| ② | 5 | 10 | 5 | 4 | 1 | 54.0 |
| ③ | 2.5 | 10 | V1 | 4 | 1 | 108.2 |
| ④ | 10 | 5 | 5 | 4 | 1 | 53.8 |
| ⑤ | 5 | 7.5 | 7.5 | 4 | V2 | t1 |
(4)根据表中数据可以得出的结论是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
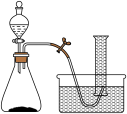
【推荐2】如图是研究催化剂对过氧化氢分解反应速率影响的实验装置图。某学生研究小组在50mL量筒中盛满水,倒置于水槽中,通过分液漏斗把过氧化氢溶液加入锥形瓶中(瓶中已有适量催化剂),记录各时间段收集到的氧气的体积。
实验一:以二氧化锰作催化剂,进行以下四组实验。
第1组:粉末状的二氧化锰0.2g+5mL6%H2O2
第2组:粉末状的二氧化锰0.2g+5mL10%H2O2
第3组:粉末状的二氧化锰0.1g+5mL6%H2O2
第4组:颗粒状的二氧化锰0.1g+5mL6%H2O2
实验二:以不同的催化剂对过氧化氢(均为5mL6%H2O2)分解反应速率影响进行研究,记录反应的时间t和相应的量筒内的气体体积读数V,用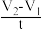 t作为反应速率的表达式(单位:mL•s﹣1),得到以下实验数据:
t作为反应速率的表达式(单位:mL•s﹣1),得到以下实验数据:
(1)写出实验一中H2O2分解的反应方程式_________ 。
(2)实验一的几组数据能够说明在实验中影响反应速率的因素主要有_________ 。
(3)实验二的几组数据反映出的问题是_________ 。
(4)用碰撞理论解释使用正催化剂能增大化学反应速率的原因_________ 。
实验一:以二氧化锰作催化剂,进行以下四组实验。
第1组:粉末状的二氧化锰0.2g+5mL6%H2O2
第2组:粉末状的二氧化锰0.2g+5mL10%H2O2
第3组:粉末状的二氧化锰0.1g+5mL6%H2O2
第4组:颗粒状的二氧化锰0.1g+5mL6%H2O2
| 催化剂:MnO2 | 0.2g粉末状的MnO2+5mL6%H2O2 | 0.2g粉末状的MnO2+5mL10%H2O2 | 0.1g粉末状的MnO2+5mL6%H2O2 | 0.1g颗粒状的MnO2+5mL6%H2O2 |
| 前15s产生O2(mL) | 11 | 15 | 8 | 7 |
| 前30s产生O2(mL) | 21 | 24 | 11 | 9 |
| 前45s产生O2(mL) | 31 | 35 | 18 | 12 |
| 前60s产生O2(mL) | 45 | 48 | 26 | 15 |
实验二:以不同的催化剂对过氧化氢(均为5mL6%H2O2)分解反应速率影响进行研究,记录反应的时间t和相应的量筒内的气体体积读数V,用
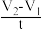 t作为反应速率的表达式(单位:mL•s﹣1),得到以下实验数据:
t作为反应速率的表达式(单位:mL•s﹣1),得到以下实验数据:| 催化剂 | 产生气体速率/mL•s﹣1 | 催化剂 | 产生气体速率/mL•s﹣1 |
| MnO2 | 0.03 | 土豆 | 0.03 |
| CuO | 0.07 | 活性炭 | 0.12 |
(1)写出实验一中H2O2分解的反应方程式
(2)实验一的几组数据能够说明在实验中影响反应速率的因素主要有
(3)实验二的几组数据反映出的问题是
(4)用碰撞理论解释使用正催化剂能增大化学反应速率的原因

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某化学兴趣小组进行以下实验探究。
Ⅰ.设计实验探究反应速率的测定和比较实验步骤:
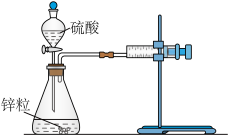
(1)用如图所示装置,加入 的稀硫酸溶液,测量收集
的稀硫酸溶液,测量收集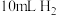 所需的时间。
所需的时间。
(2)另取一套相同的装置,加入40 mL 4 mol·L-1的稀硫酸溶液,测量收集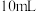 (相同条件下)
(相同条件下) 所需的时间。
所需的时间。
实验现象:锌跟稀硫酸反应产生气泡,收集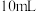 气体,(2)所用时间比(1)所用时间
气体,(2)所用时间比(1)所用时间__________ (填“长”或“短”)
实验结论: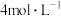 的稀硫酸与锌反应比
的稀硫酸与锌反应比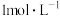 的稀硫酸与锌反应速率
的稀硫酸与锌反应速率___________ (填“大”或“小”):
注意事项:①锌粒的质量、颗粒(即表面积)大小___________ ;
②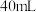 的硫酸要迅速加入;
的硫酸要迅速加入;
③装置____________ ,且计时要迅速准确;
④气体收集可以用排水量气装置代替。
实验讨论:除本实验测定反应速率的方法外,可行的方案还有_________________________ (任写一种)。
Ⅱ.利用 与大理石反应来研究影响反应速率的因素,所用
与大理石反应来研究影响反应速率的因素,所用 浓度为
浓度为 、
、 ,大理石有细颗粒与粗颗粒两种规格,实验温度为
,大理石有细颗粒与粗颗粒两种规格,实验温度为 、
、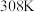 。
。
请完成以下实验设计表。
Ⅰ.设计实验探究反应速率的测定和比较实验步骤:

(1)用如图所示装置,加入
 的稀硫酸溶液,测量收集
的稀硫酸溶液,测量收集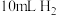 所需的时间。
所需的时间。(2)另取一套相同的装置,加入40 mL 4 mol·L-1的稀硫酸溶液,测量收集
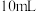 (相同条件下)
(相同条件下) 所需的时间。
所需的时间。实验现象:锌跟稀硫酸反应产生气泡,收集
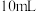 气体,(2)所用时间比(1)所用时间
气体,(2)所用时间比(1)所用时间实验结论:
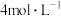 的稀硫酸与锌反应比
的稀硫酸与锌反应比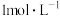 的稀硫酸与锌反应速率
的稀硫酸与锌反应速率注意事项:①锌粒的质量、颗粒(即表面积)大小
②
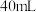 的硫酸要迅速加入;
的硫酸要迅速加入;③装置
④气体收集可以用排水量气装置代替。
实验讨论:除本实验测定反应速率的方法外,可行的方案还有
Ⅱ.利用
 与大理石反应来研究影响反应速率的因素,所用
与大理石反应来研究影响反应速率的因素,所用 浓度为
浓度为 、
、 ,大理石有细颗粒与粗颗粒两种规格,实验温度为
,大理石有细颗粒与粗颗粒两种规格,实验温度为 、
、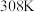 。
。请完成以下实验设计表。
| 实验编号 | T/K | 大理石规格 | 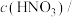 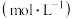 | 实验目的 |
| ① | 298 | 粗颗粒 |  | (1)实验①和②探究 浓度对该反应速率的影响; 浓度对该反应速率的影响;(2)实验①和 (3)实验①和 |
| ② | ||||
| ③ | 粗颗粒 | |||
| ④ |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】下表是某种金属与稀硫酸反应时测得的实验数据。
请回答下列问题:
(1)反应速率最大的是实验__________ (填实验序号,下同),反应速率最小的是_______ 。
(2)实验③和实验④是探究________ 对化学反应速率的影响,实验⑥和实验⑦是探究_____ 对化学反应速率的影响。
(3)实验②中金属消失的时间比实验①短,原因是_______ ,实验②反应后温度较高的原因是________ 。
| 实验序号 | 金属质量/g | 金属 状态 | c(H2SO4)/ mol·L-1 | V(H2SO4)/ mL | 溶液温度/℃ | 金属消失所需时间/s | |
| 反应前 | 反应后 | ||||||
| ① | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| ② | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| ③ | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| ④ | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| ⑤ | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| ⑥ | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| ⑦ | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| ⑧ | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| ⑨ | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
(1)反应速率最大的是实验
(2)实验③和实验④是探究
(3)实验②中金属消失的时间比实验①短,原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某学习小组用酸性KMnO4溶液和H2C2O4(草酸)溶液之间的反应来研究“影响反应速率的因素”,设计实验方案如下:(假设溶液混合时体积可以加和)
(1)该实验探究的是_______ 因素对化学反应速率的影响,上述实验设计表: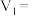
______ ,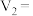
_______ 。
(2)利用实验1中数据计算,平均反应速率: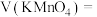
______  。
。
(3)该小组同学查阅已有的实验资料发现,该实验过程中Mn2+对反应有催化作用,并继续进行实验探究。请你帮助该小组同学完成实验方案。所加试剂X最好选用___________
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 溶液褪色至无色所需时间/min | |||
0.6mol/L  溶液 溶液 |  | 0.1mol/L  溶液 溶液 | 3mol/L  溶液 溶液 | ||
| 1 | 3.0 | 13.0 | 2.0 | 2.0 | 10.0 |
| 2 | 1.0 |  |  | 2.0 | 12.8 |
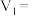
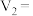
(2)利用实验1中数据计算,平均反应速率:
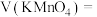
 。
。(3)该小组同学查阅已有的实验资料发现,该实验过程中Mn2+对反应有催化作用,并继续进行实验探究。请你帮助该小组同学完成实验方案。所加试剂X最好选用___________
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 少量 | 溶液褪色至无色所需时间/min | |||
0.6mol/L  溶液 溶液 |  | 0.1mol/L  溶液 溶液 | 3mol/L  溶液 溶液 | |||
| 3 | 3.0 | 13.0 | 2.0 | 2.0 | X | t |
A.0.1mol/L  | B.0.1mol/L  |
C. 粉末 粉末 | D. 粉末 粉末 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】含氮物质是一类常见物质,在人们的生产、生活活动中有重要作用。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。
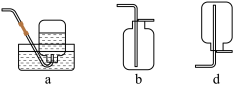
①该反应的化学方程式是_______ ,收集N2的方法是_______ (填标号)。
②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
i. V1=_______ ,V3=_______ 。
ii. 已知该反应的速率方程为 ,k为反应速率常数。根据上述实验数据,
,k为反应速率常数。根据上述实验数据,
_______ (填整数)。
(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:
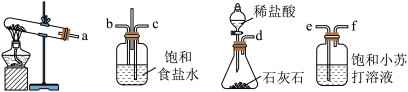
装置接口正确的连接顺序为_______ (填接口序号);由该装置可知,该实验中制备NH3需用到的试剂是_______ (填化学式)。
(3)实验小组在实验中,将1.0 mol·L-1 NaNO2溶液滴入pH=0.5的1.0 mol·L-1 FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料 常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想 溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
④实验现象及分析
i. 实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是_______ (写出离子方程式);
ii. 实验6观察到_______ (填实验现象),证明溶液呈棕色是因为存在[Fe(NO)]2+,且其颜色掩盖了Fe3+的黄色。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。

①该反应的化学方程式是
②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
| 实验编号 | 溶液体积/mL | 收集1.0mLN2所用时间/s | |||
| NaNO2溶液 | NH4Cl溶液 | 醋酸 | 水 | ||
| 1 | 4.0 | 4.0 | 4.0 | 8.0 | 334 |
| 2 | V1 | 4.0 | 4.0 | V3 | 150 |
| 3 | 8.0 | 4.0 | 4.0 | 4.0 | 83 |
| 4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |
ii. 已知该反应的速率方程为
 ,k为反应速率常数。根据上述实验数据,
,k为反应速率常数。根据上述实验数据,
(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:

装置接口正确的连接顺序为
(3)实验小组在实验中,将1.0 mol·L-1 NaNO2溶液滴入pH=0.5的1.0 mol·L-1 FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料 常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想 溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
| 实验编号 | 5 | 6 |
| 操作方法 | 取上述滴有NaNO2溶液的棕色混合液,向其中滴加稀KSCN溶液 | 取上述棕色混合液,按下图所示加热 |
i. 实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是
ii. 实验6观察到
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有________ ,____________ 。
(2)加入少量硫酸铜溶液可以加快氢气生成速率的原因是___________ 。
(3)要加快上述实验中气体产生速率,还可以采取的措施有___________ ,___________ (答两种)
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=______ ,V6=______ ,V7=_______ 。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_____ 。
(1)上述实验中发生反应的化学方程式有
(2)加入少量硫酸铜溶液可以加快氢气生成速率的原因是
(3)要加快上述实验中气体产生速率,还可以采取的措施有
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验混合溶液 | A | B | C | D | E | F |
| 4 mol/L H2SO4(mL) | 50 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液(mL) | 0 | 5 | 15 | 25 | V6 | 50 |
| H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某小组利用H2C2O4溶液与用硫酸酸化的KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时。该小组设计了如下的方案。
(1)a= _______ ,该实验是通过____________________ 来判断反应的快慢。
(2)已知H2C2O4被KMnO4(H+)氧化为CO2逸出,该反应的化学方程式为________ ,为了观察到实验现象从而判断反应的快慢,H2C2O4与KMnO4初始的物质的量需要满足的关系为:___ 。
(3)探究温度对化学反应速率影响的实验编号是_______ 和_______ (填编号,下同),可探究H2C2O4浓度对化学反应速率影响的实验编号是_______ 和_______ 。
(4)实验①测得反应所用的时间为20s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______ 。
(5)该小组发现室温下反应速率走势如图,其中t1~t2时间内速率变快的主要原因可能是:_______ ,若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是_______ (填序号)
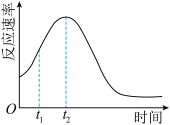
A.硫酸钾 B.硫酸锰 C.稀硫酸 D.氯化锰
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 蒸馏水 体积/ml | 温度/℃ | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | |||
| ① | 0.50 | 6.0 | 0.010 | 4.0 | 0 | 25 |
| ② | 0.50 | 3.0 | 0.010 | 4.0 | a | 25 |
| ③ | 0.50 | 6.0 | 0.010 | 4.0 | 0 | 50 |
(2)已知H2C2O4被KMnO4(H+)氧化为CO2逸出,该反应的化学方程式为
(3)探究温度对化学反应速率影响的实验编号是
(4)实验①测得反应所用的时间为20s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=
(5)该小组发现室温下反应速率走势如图,其中t1~t2时间内速率变快的主要原因可能是:

A.硫酸钾 B.硫酸锰 C.稀硫酸 D.氯化锰
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】同学们已经学习了同位素、同系物、同素异形体、同分异构体,你能区别这些概念吗?请将下面列出了几组物质进行分类。
①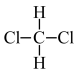 和
和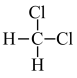 ②C(CH3)4和CH3CH(CH3)CH2CH3③CH4和C4H10④金刚石与石墨 ⑤氕、氘与氚 ⑥16O、17O和18O ⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3) ⑧氧气与臭氧 ⑨CH3Cl和CH3CH2Cl
②C(CH3)4和CH3CH(CH3)CH2CH3③CH4和C4H10④金刚石与石墨 ⑤氕、氘与氚 ⑥16O、17O和18O ⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3) ⑧氧气与臭氧 ⑨CH3Cl和CH3CH2Cl
(1)属于同位素的是_______ 。
(2)属于同系物的是_______ 。
(3)属于同素异形体的是_______ 。
(4)属于同分异构体的是_______ (以上填空均填写序号)。
(5)C4H10的一氯代物有_______ 种;CH3CH(CH3)CH2CH3的一氯代物有_______ 种。
(6)甲烷既是一种清洁能源,也是一种重要的化工原料。用TiO2/Cu2Al2O4为催化剂可以将CO2和CH4直接转化成乙酸(CH3COOH)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。

①250~300℃时,温度升高而乙酸的生成速率降低的原因是_______ 。
②当温度的取值范围在_______ 时,温度是影响乙酸的生成速率的主要因素。
①
 和
和 ②C(CH3)4和CH3CH(CH3)CH2CH3③CH4和C4H10④金刚石与石墨 ⑤氕、氘与氚 ⑥16O、17O和18O ⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3) ⑧氧气与臭氧 ⑨CH3Cl和CH3CH2Cl
②C(CH3)4和CH3CH(CH3)CH2CH3③CH4和C4H10④金刚石与石墨 ⑤氕、氘与氚 ⑥16O、17O和18O ⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3) ⑧氧气与臭氧 ⑨CH3Cl和CH3CH2Cl(1)属于同位素的是
(2)属于同系物的是
(3)属于同素异形体的是
(4)属于同分异构体的是
(5)C4H10的一氯代物有
(6)甲烷既是一种清洁能源,也是一种重要的化工原料。用TiO2/Cu2Al2O4为催化剂可以将CO2和CH4直接转化成乙酸(CH3COOH)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。

①250~300℃时,温度升高而乙酸的生成速率降低的原因是
②当温度的取值范围在
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】一定温度下,向容积为2L的恒容密闭容器中加入等物质的量的H2和I2,发生反应H2(g)+I2(g)  2HI(g)ΔH<0。测得不同反应时间容器内H2的物质的量如表;
2HI(g)ΔH<0。测得不同反应时间容器内H2的物质的量如表;
回答下列问题:
(1)0~20min内HI的平均反应速率为___ 。
(2)反应达到化学平衡状态时,I2的转化率为___ 。
(3)该条件下,能说明上述反应达到化学平衡状态的是__ 。(填标号)
A.混合气体颜色不再改变
B.容器内压强不再改变
C.H2、I2、HI三种气体体积分数不再改变
D.混合气体密度不再改变
E.c(H2)︰c(I2)=1︰1
F.n(H2)︰n(HI)不变
G.1molH—H键断裂的同时,生成2molH—I键
(4)该反应在三种不同情况下的化学反应速率分别为:①v(H2)=0.02mol·L-1·s-1,②v(I2)=0.32mol·L-1·min-1,③v(HI)=0.84mol·L-1·min-1。则反应进行的速率由快到慢的顺序为__ 。(用序号回答)
 2HI(g)ΔH<0。测得不同反应时间容器内H2的物质的量如表;
2HI(g)ΔH<0。测得不同反应时间容器内H2的物质的量如表;| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(H2)/mol | 1 | 0.75 | 0.65 | 0.6 | 0.6 |
回答下列问题:
(1)0~20min内HI的平均反应速率为
(2)反应达到化学平衡状态时,I2的转化率为
(3)该条件下,能说明上述反应达到化学平衡状态的是
A.混合气体颜色不再改变
B.容器内压强不再改变
C.H2、I2、HI三种气体体积分数不再改变
D.混合气体密度不再改变
E.c(H2)︰c(I2)=1︰1
F.n(H2)︰n(HI)不变
G.1molH—H键断裂的同时,生成2molH—I键
(4)该反应在三种不同情况下的化学反应速率分别为:①v(H2)=0.02mol·L-1·s-1,②v(I2)=0.32mol·L-1·min-1,③v(HI)=0.84mol·L-1·min-1。则反应进行的速率由快到慢的顺序为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】Ⅰ.一定条件下,在容积为5L的密闭容器中,A、B、C三种气体的物质的量n随时间t的变化如图甲所示。已知达平衡后,降低温度,A的体积分数减小。
(1)该反应的化学方程式为___________ 。
(2)该反应的反应速率v随时间t的关系如图乙所示。
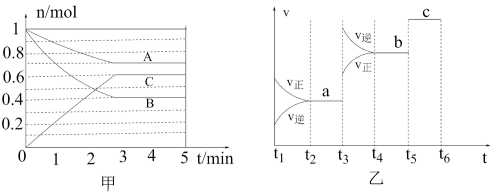
①根据图乙判断,在t3时刻改变的外界条件是___________ 。
②a、b、c对应的平衡状态中,C的体积分数最大的是状态___________ 。
③各阶段的平衡常数如下表所示:
K1、K2、K3之间的大小关系为___________ (用“ ”“
”“ ”或“
”或“ ”连接)。
”连接)。
Ⅱ.高温下,CO2与足量的碳在密闭容器中实现反应: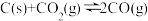 。
。
(3)向压强为p,体积可变的恒压容器中充入一定量CO2,650℃时反应达平衡,CO的体积分数为40.0%,则CO2的转化率为___________ 。气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=___________ (用含p的代数式表示),若向平衡体系中再充入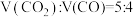 的混合气体,平衡
的混合气体,平衡___________ (填“正向”、“逆向”或“不”)移动。
(1)该反应的化学方程式为
(2)该反应的反应速率v随时间t的关系如图乙所示。

①根据图乙判断,在t3时刻改变的外界条件是
②a、b、c对应的平衡状态中,C的体积分数最大的是状态
③各阶段的平衡常数如下表所示:
 |  |  |
| K1 | K2 | K3 |
 ”“
”“ ”或“
”或“ ”连接)。
”连接)。Ⅱ.高温下,CO2与足量的碳在密闭容器中实现反应:
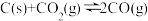 。
。(3)向压强为p,体积可变的恒压容器中充入一定量CO2,650℃时反应达平衡,CO的体积分数为40.0%,则CO2的转化率为
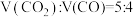 的混合气体,平衡
的混合气体,平衡
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】工业上通过丁烷裂解可以获得乙烯和丙烯等化工原料:
①C4H10(丁烷,g) CH4(g)+C3H6(丙烯,g);
CH4(g)+C3H6(丙烯,g);
②C4H10(丁烷,g) C2H6(g)+C2H4(g)。
C2H6(g)+C2H4(g)。
(1)丙烯和乙烯均能与Br2发生加反应,标准状况下,33.6L由丙烯和乙烯组成的混合气体与足量的溴水反应,最多消耗
(2)向一体积为2L的恒容密团容器中充入2 mol丁烷,在一定温度和催化剂作用下发生上述2个反应,测得丁烷、丙烯的物质的量与时间关系如图所示。

①下列情况表明上述反应达到平衡状态的是
A.混合气体密度不随时间变化 B.混合气体平均摩尔质量不随时间变化
C.混合气体总压强不随时间变化 D.混合气体中碳原子总数不随时间变化
E.体系中各物质的浓度相等
②0 -4 min内,乙烷的平均反应速率为
③在该条件下,丁烷的平衡转化率为
④平衡体系中,n(乙烯):n(丙烯)=
您最近一年使用:0次



