物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中,可以使0.10mol/LCH3COOH溶液中 值增大的措施是
值增大的措施是_______ (填序号)。
a.加水稀释 b.加入少量CH3COONa固体 c.加入少量冰醋酸 d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(2)t℃时,水的离子积常数Kw=1×10-12
①该温度下,若pH=3的H2SO4溶液中,由水电离出来的氢离子浓度为:_______
②该温度下,若10ml pH=2的HCl溶液加水稀释到1000ml,则该溶液的pH=_______
③该温度下,若100ml pH=a的H2SO4溶液与1ml pH=b的NaOH溶液混合后溶液呈中性,则a+b=_______
(3)25℃下,有浓度均为0.1mol/L的三种溶液:a.H2CO3;b.HClO;c.CH3COOH。(已知25℃时电离常数:H2CO3 K1=4.4×10-7,K2=4.7×10-11;HClO K=3.0×10-8;CH3COOH K=1.8×10-5)
①三种酸由强到弱的顺序为:_______ (填序号)。
②足量的次氯酸与碳酸钠的反应离子方程式为:_______
③碳酸氢钠是一种酸式盐,其水溶液显弱碱性,请结合方程式进行解释_______
(1)下列方法中,可以使0.10mol/LCH3COOH溶液中
 值增大的措施是
值增大的措施是a.加水稀释 b.加入少量CH3COONa固体 c.加入少量冰醋酸 d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(2)t℃时,水的离子积常数Kw=1×10-12
①该温度下,若pH=3的H2SO4溶液中,由水电离出来的氢离子浓度为:
②该温度下,若10ml pH=2的HCl溶液加水稀释到1000ml,则该溶液的pH=
③该温度下,若100ml pH=a的H2SO4溶液与1ml pH=b的NaOH溶液混合后溶液呈中性,则a+b=
(3)25℃下,有浓度均为0.1mol/L的三种溶液:a.H2CO3;b.HClO;c.CH3COOH。(已知25℃时电离常数:H2CO3 K1=4.4×10-7,K2=4.7×10-11;HClO K=3.0×10-8;CH3COOH K=1.8×10-5)
①三种酸由强到弱的顺序为:
②足量的次氯酸与碳酸钠的反应离子方程式为:
③碳酸氢钠是一种酸式盐,其水溶液显弱碱性,请结合方程式进行解释
更新时间:2022-09-19 11:10:44
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】电解质水溶液中存在电离平衡、水解平衡、沉淀溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①0.1 mol/LNaCN溶液和0.1mol/LNaHCO3溶液中,c(CN-) _______ c( )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
②将少量CO2通入NaCN溶液,反应的离子方程式是_______ 。
③25℃时,测得一定浓度 的CH3COONa溶液pH=8,用离子方程式表示溶液呈碱性的原因是_______ ,溶液中 =
=_______ 。
(2)pH=10 氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为_______ 。
(3)已知Ksp(BaCO3)=2.6×10-9 mol/L,现将浓度为2×10-4 mol/L Na2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为_______ mol/L。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka=1.75×10-6 | Ka=6.2×10-10 | Ka1=4.5×10-7 Ka2=4.7×10-11 |
 )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。②将少量CO2通入NaCN溶液,反应的离子方程式是
③25℃时,测得一定浓度 的CH3COONa溶液pH=8,用离子方程式表示溶液呈碱性的原因是
 =
=(2)pH=10 氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为
(3)已知Ksp(BaCO3)=2.6×10-9 mol/L,现将浓度为2×10-4 mol/L Na2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】甲醇既是重要的化工原料,又是一种可再生的清洁能源,具有广泛的应用前景。工业上可以采用如下反应合成甲醇:CO2(g) +3H2(g)⇌CH3OH(g)+H2O(g)
(1)上述反应在一密闭容器中进行,下列条件的改变会使反应的速率增大的是_______。
(2)常温下,有下列五种溶液:① 、②
、② 、③HCl、④
、③HCl、④ 、⑤NaOH
、⑤NaOH
① pH相等的④和⑤溶液,稀释相同的倍数,稀释之后pH较大的是_______ (填序号)
② 等浓度的上述溶液中,水电离的程度由大到小的顺序_______ (填序号,用>、<、=连接)
③ 若将等浓度的③和④的溶液混合后溶液恰好呈中性,则混合前③的体积_______ ④的体积(填“大于”、“小于”或“等于”)。
④ 取10mL0.1 mol∙L−1的③溶液,加水稀释到1000mL,则此时溶液中由水电离出的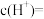
_______ 。
(3)某甲烷—氧气燃料电池的工作原理如下图所示。
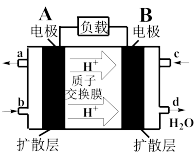
①c处通入的是_______ ,负极发生的电极反应式为_______ 。
②工作一段时间后,当3.2 g甲烷完全反应生成CO2时,有_______ mol H+通过质子交换膜。
(1)上述反应在一密闭容器中进行,下列条件的改变会使反应的速率增大的是_______。
| A.将容器体积缩小一半 |
| B.保持压强不变,充入Ne气使容器体积增大 |
| C.保持容器体积不变,向反应容器中充入CO2 |
| D.保持容器体积不变,将反应生成的甲醇及时液化并分离出去 |
 、②
、② 、③HCl、④
、③HCl、④ 、⑤NaOH
、⑤NaOH① pH相等的④和⑤溶液,稀释相同的倍数,稀释之后pH较大的是
② 等浓度的上述溶液中,水电离的程度由大到小的顺序
③ 若将等浓度的③和④的溶液混合后溶液恰好呈中性,则混合前③的体积
④ 取10mL0.1 mol∙L−1的③溶液,加水稀释到1000mL,则此时溶液中由水电离出的
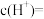
(3)某甲烷—氧气燃料电池的工作原理如下图所示。

①c处通入的是
②工作一段时间后,当3.2 g甲烷完全反应生成CO2时,有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】下表是不同温度下水的离子积常数:
试回答以下问题:
(1)若25℃<T1<T2,则a__________ 1×10-14(填“>”、“<”或“=”),做此判断的理由是______________________________________ 。
(2)25℃时,某Na2SO4溶液中c(SO42—)=5×10-4mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=__________ 。
(3)T2℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__________ 。此溶液中各种离子的浓度由大到小的顺序是____________________________ 。
(4)常温下,设某pH值的硫酸中水电离出的c(H+)=1.0×10-amol/L,设相同pH值的硫酸铝中水电离出的c(H+)=1.0×10-bmol/L,(a、b都是小于14的正数),那么a、b之间满足的关系式是________________ 。
| 温度/℃ | 25 | T1 | T2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25℃<T1<T2,则a
(2)25℃时,某Na2SO4溶液中c(SO42—)=5×10-4mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=
(3)T2℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=
(4)常温下,设某pH值的硫酸中水电离出的c(H+)=1.0×10-amol/L,设相同pH值的硫酸铝中水电离出的c(H+)=1.0×10-bmol/L,(a、b都是小于14的正数),那么a、b之间满足的关系式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】雾霾严重危害人类健康和生态环境,开发稳定高效的脱硫脱硝工艺技术是国内外研究的热点。研究表明,氮氧化物 和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如图所示。
和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如图所示。 溶液中的离子浓度由大到小顺序是
溶液中的离子浓度由大到小顺序是___________ 。
(2)①已知: 生成
生成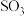 总反应的化学方程式是
总反应的化学方程式是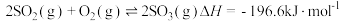 ,此反应可通过如下两步完成:
,此反应可通过如下两步完成: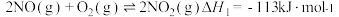 ;
;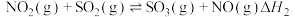 。则
。则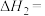
___________ 。
②一定温度下,向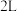 恒容密闭容器中充入
恒容密闭容器中充入 和
和 各
各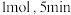 达到平衡,此时容器中
达到平衡,此时容器中 和
和 的浓度之比为
的浓度之比为 ,则
,则 的平衡转化率是
的平衡转化率是___________ 。
(3) 属于酸性氧化物,将其通入
属于酸性氧化物,将其通入 溶液中,得到
溶液中,得到 溶液。
溶液。
① 溶液呈酸性,其原因是
溶液呈酸性,其原因是___________ 。
②向 的
的 溶液中滴加一定浓度的
溶液中滴加一定浓度的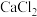 溶液,溶液中出现浑浊,
溶液,溶液中出现浑浊, 降为2,用化学平衡移动原理解释溶液
降为2,用化学平衡移动原理解释溶液 降低的原因:
降低的原因:___________ 。
(4)通过 传感器可监测
传感器可监测 的含量,其工作原理示意图如图。
的含量,其工作原理示意图如图。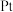 电极上发生的是
电极上发生的是___________ (填“氧化”或“还原”)反应。
②写出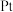 电极的电极反应式:
电极的电极反应式:___________ 。
③写出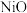 电极的电极反应式:
电极的电极反应式:___________ 。
 和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如图所示。
和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如图所示。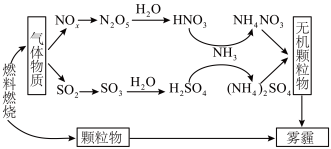
 溶液中的离子浓度由大到小顺序是
溶液中的离子浓度由大到小顺序是(2)①已知:
 生成
生成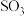 总反应的化学方程式是
总反应的化学方程式是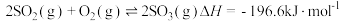 ,此反应可通过如下两步完成:
,此反应可通过如下两步完成: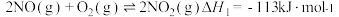 ;
;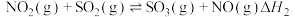 。则
。则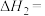
②一定温度下,向
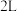 恒容密闭容器中充入
恒容密闭容器中充入 和
和 各
各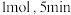 达到平衡,此时容器中
达到平衡,此时容器中 和
和 的浓度之比为
的浓度之比为 ,则
,则 的平衡转化率是
的平衡转化率是(3)
 属于酸性氧化物,将其通入
属于酸性氧化物,将其通入 溶液中,得到
溶液中,得到 溶液。
溶液。①
 溶液呈酸性,其原因是
溶液呈酸性,其原因是②向
 的
的 溶液中滴加一定浓度的
溶液中滴加一定浓度的 溶液,溶液中出现浑浊,
溶液,溶液中出现浑浊, 降为2,用化学平衡移动原理解释溶液
降为2,用化学平衡移动原理解释溶液 降低的原因:
降低的原因:(4)通过
 传感器可监测
传感器可监测 的含量,其工作原理示意图如图。
的含量,其工作原理示意图如图。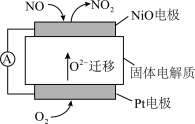
 电极上发生的是
电极上发生的是②写出
 电极的电极反应式:
电极的电极反应式:③写出
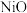 电极的电极反应式:
电极的电极反应式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液。试回答下列问题:
(1)甲溶液的pH=________ 。
(2)乙溶液中由水电离出的H+浓度为________ mol·L-1。
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是________ (填序号)。
①n(H+) ②c(H+) ③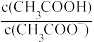 ④c(OH-)
④c(OH-)
(4)某同学用甲溶液做标准溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:
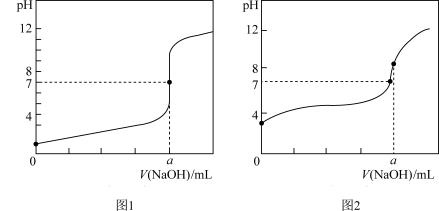
①甲溶液滴定丙溶液的曲线是_______ (填“图1”或“图2”)曲线。
②用甲溶液滴定乙溶液实验中,指示剂应选用________ ,滴定达到终点的现象为:____________ ,滴定前未用标准液润洗滴定管,则会造成滴定结果______ (填偏高、偏低或无影响)。
(1)甲溶液的pH=
(2)乙溶液中由水电离出的H+浓度为
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是
①n(H+) ②c(H+) ③
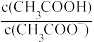 ④c(OH-)
④c(OH-)(4)某同学用甲溶液做标准溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:

①甲溶液滴定丙溶液的曲线是
②用甲溶液滴定乙溶液实验中,指示剂应选用
您最近一年使用:0次
【推荐3】二甲醚(CH3OCH3)有优良的燃烧性能,被称为21世纪的“清洁能源”,一步法合成二甲醚是以合成气(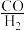 )为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应:
)为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应:
Ⅰ:CO(g)+2H2(g) CH3OH (g) △H1=-90 kJ/mol
CH3OH (g) △H1=-90 kJ/mol
Ⅱ:2CH3OH(g) CH3OCH3(g)+H2O (g) △H2=-23 kJ/mol
CH3OCH3(g)+H2O (g) △H2=-23 kJ/mol
Ⅲ:CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41 kJ/mol
CO2(g)+H2(g) △H3=-41 kJ/mol
(1)一种新合成二甲醚的方法为一定条件下:2CO2(g)+6H2(g)=CH3OCH3(g) +3H2O(g),该反应的△H=_______ kJ/mol;判断该反应在一定温度下、体积恒定的密闭容器中,下列不能 作为达到化学平衡状态的依据是_______ 。
A.平均摩尔质量保持不变 B.容器内气体的密度不变
C.容器内压强保持不变 D.单位时间内消耗2 mol CO2,同时消耗1 mol二甲醚
(2)可采用CO和二甲醚催化合成乙醇。
反应Ⅰ: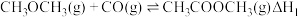
反应Ⅱ: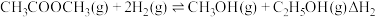
①压强为p kPa时,温度对二甲醚和乙酸甲酯平衡转化率的影响如图甲所示,则△H1_______ (填“>”或“<”)0。

②温度对平衡体系中乙酸甲酯的含量和乙醇的影响如图乙所示,在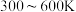 范围内,乙酸甲酯的含量逐渐增大,而乙醇的百分含量逐渐减小的原因是:
范围内,乙酸甲酯的含量逐渐增大,而乙醇的百分含量逐渐减小的原因是:_______ 。

(3)25℃时,以二甲醚燃料电池(电解质溶液为稀硫酸)为电源,电解 一定浓度的NaCl溶液.写出通入二甲醚一极的电极反应式
一定浓度的NaCl溶液.写出通入二甲醚一极的电极反应式_______ 。电解一段时间后,NaCl溶液的pH变为12(假设电解前后NaCl溶液的体积不变),则理论上消耗二甲醚的物质的量为_______ mol,若向U形管内电解后的溶液中通入CO2气体,使所得溶液c(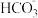 ):c(
):c( )=2:1,则此时溶液中的c(H+)=
)=2:1,则此时溶液中的c(H+)=_______ mol/L(室温下,H2CO3的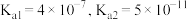 )。
)。

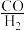 )为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应:
)为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应:Ⅰ:CO(g)+2H2(g)
 CH3OH (g) △H1=-90 kJ/mol
CH3OH (g) △H1=-90 kJ/molⅡ:2CH3OH(g)
 CH3OCH3(g)+H2O (g) △H2=-23 kJ/mol
CH3OCH3(g)+H2O (g) △H2=-23 kJ/molⅢ:CO(g)+H2O(g)
 CO2(g)+H2(g) △H3=-41 kJ/mol
CO2(g)+H2(g) △H3=-41 kJ/mol(1)一种新合成二甲醚的方法为一定条件下:2CO2(g)+6H2(g)=CH3OCH3(g) +3H2O(g),该反应的△H=
A.平均摩尔质量保持不变 B.容器内气体的密度不变
C.容器内压强保持不变 D.单位时间内消耗2 mol CO2,同时消耗1 mol二甲醚
(2)可采用CO和二甲醚催化合成乙醇。
反应Ⅰ:
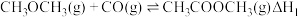
反应Ⅱ:
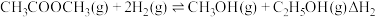
①压强为p kPa时,温度对二甲醚和乙酸甲酯平衡转化率的影响如图甲所示,则△H1

②温度对平衡体系中乙酸甲酯的含量和乙醇的影响如图乙所示,在
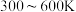 范围内,乙酸甲酯的含量逐渐增大,而乙醇的百分含量逐渐减小的原因是:
范围内,乙酸甲酯的含量逐渐增大,而乙醇的百分含量逐渐减小的原因是:
(3)25℃时,以二甲醚燃料电池(电解质溶液为稀硫酸)为电源,电解
 一定浓度的NaCl溶液.写出通入二甲醚一极的电极反应式
一定浓度的NaCl溶液.写出通入二甲醚一极的电极反应式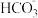 ):c(
):c( )=2:1,则此时溶液中的c(H+)=
)=2:1,则此时溶液中的c(H+)=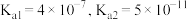 )。
)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】废水中的重金属离子通常用沉淀法除去。已知常温下各物质的溶度积或电离平衡常数如下表所示,请回答下列问题:
(1) 溶液中加入一定量的
溶液中加入一定量的 反应后溶液呈中性,该溶液中
反应后溶液呈中性,该溶液中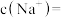
___________ (用 ,
, 、
、 等物质的浓度来表示)
等物质的浓度来表示)
(2) 溶液中
溶液中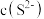
___________  (填“>”、“<”、“=”),若向此溶液中加入
(填“>”、“<”、“=”),若向此溶液中加入 溶液,恰好完全反应,所得溶液的
溶液,恰好完全反应,所得溶液的
___________ 7(填“>”、“<”、“=”)。
(3)向浓度均为0.1 的
的 和
和 的混合溶液中加
的混合溶液中加 溶液,当加入
溶液,当加入 溶液至出现两种沉淀时,则溶液中
溶液至出现两种沉淀时,则溶液中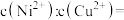
___________ 。
(4)向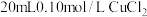 溶液中滴加
溶液中滴加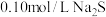 溶液,滴加过程中
溶液,滴加过程中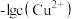 与
与 溶液体积(V)的关系如图所示。
溶液体积(V)的关系如图所示。
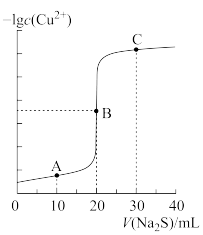
A、B、C三点溶液中,水的电离程度最小的是___________ 点;溶液碱性最强的是___________ 点; 和
和 的乘积最小的是
的乘积最小的是___________ 点。
 | 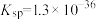 |
 | 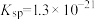 |
 | 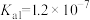 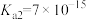 |
(1)
 溶液中加入一定量的
溶液中加入一定量的 反应后溶液呈中性,该溶液中
反应后溶液呈中性,该溶液中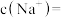
 ,
, 、
、 等物质的浓度来表示)
等物质的浓度来表示)(2)
 溶液中
溶液中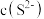
 (填“>”、“<”、“=”),若向此溶液中加入
(填“>”、“<”、“=”),若向此溶液中加入 溶液,恰好完全反应,所得溶液的
溶液,恰好完全反应,所得溶液的
(3)向浓度均为0.1
 的
的 和
和 的混合溶液中加
的混合溶液中加 溶液,当加入
溶液,当加入 溶液至出现两种沉淀时,则溶液中
溶液至出现两种沉淀时,则溶液中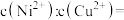
(4)向
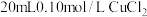 溶液中滴加
溶液中滴加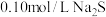 溶液,滴加过程中
溶液,滴加过程中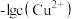 与
与 溶液体积(V)的关系如图所示。
溶液体积(V)的关系如图所示。
A、B、C三点溶液中,水的电离程度最小的是
 和
和 的乘积最小的是
的乘积最小的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】已知常温下部分弱电解质的电离平衡常数如表:
(1)25℃时,用离子方程式说明 溶液呈酸性的原因:
溶液呈酸性的原因:_____ , 的
的 溶液中各离子浓度的大小关系为
溶液中各离子浓度的大小关系为_____ 。
(2)向足量的次氯酸钠中通入少量的二氧化碳的离子方程式_____ 。
(3)室温下,经测定0.1mol⋅L
 溶液
溶液 ,则
,则
_____  (填“>”、“=”、“<”)。
(填“>”、“=”、“<”)。
(4)25℃时,若氨水的浓度为2.0mol⋅L ,将
,将 通入该氨水中,当
通入该氨水中,当 降至
降至 mol⋅L
mol⋅L 时,溶液中
时,溶液中
_____ 。
| 化学式 | HF | HClO |  |  |  |
| 电离常数 | 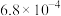 | 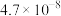 | 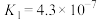 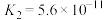 | 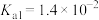  | 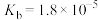 |
 溶液呈酸性的原因:
溶液呈酸性的原因: 的
的 溶液中各离子浓度的大小关系为
溶液中各离子浓度的大小关系为(2)向足量的次氯酸钠中通入少量的二氧化碳的离子方程式
(3)室温下,经测定0.1mol⋅L

 溶液
溶液 ,则
,则
 (填“>”、“=”、“<”)。
(填“>”、“=”、“<”)。(4)25℃时,若氨水的浓度为2.0mol⋅L
 ,将
,将 通入该氨水中,当
通入该氨水中,当 降至
降至 mol⋅L
mol⋅L 时,溶液中
时,溶液中
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
①常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最大的是____ 。
②将过量H2S通入Na2CO3溶液,反应的离子方程式是____ 。
(2)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X) 随pH的变化如图所示。则H2A的电离平衡常数K2=____ 。

(3)常温下,用0.100mol·L-1的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图2所示,滴加20.00mL盐酸时所得溶液中,c(Cl-)=c(NH ) +c(NH3·H2O)+c(NH3)(忽略溶液体积的变化)。
) +c(NH3·H2O)+c(NH3)(忽略溶液体积的变化)。

①该氨水物质的量浓度为____ 。
②a、b、c、d四个点,水的电离程度最大的是____ 。
③b点所示的溶液中c(NH3·H2O)____ c(Cl-)(填“大于”“等于”或“小于”)
④若所得溶液中的c(NH )>c(OH—),则下列说法正确的是
)>c(OH—),则下列说法正确的是____ ;
A.溶液一定呈酸性 B.溶液一定呈碱性
C.溶液一定呈中性 D.溶液可能呈酸性、中性或碱性
(1)已知部分弱酸的电离常数如下表:
化学式 | HF | H2CO3 | H2S |
电离平衡常数K (25℃) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
①常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最大的是
②将过量H2S通入Na2CO3溶液,反应的离子方程式是
(2)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X) 随pH的变化如图所示。则H2A的电离平衡常数K2=

(3)常温下,用0.100mol·L-1的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图2所示,滴加20.00mL盐酸时所得溶液中,c(Cl-)=c(NH
 ) +c(NH3·H2O)+c(NH3)(忽略溶液体积的变化)。
) +c(NH3·H2O)+c(NH3)(忽略溶液体积的变化)。
①该氨水物质的量浓度为
②a、b、c、d四个点,水的电离程度最大的是
③b点所示的溶液中c(NH3·H2O)
④若所得溶液中的c(NH
 )>c(OH—),则下列说法正确的是
)>c(OH—),则下列说法正确的是A.溶液一定呈酸性 B.溶液一定呈碱性
C.溶液一定呈中性 D.溶液可能呈酸性、中性或碱性
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】碳的化合物在工业上应用广泛,下面有几种碳的化合物的具体应用:
(1)已知下列热化学方程式:
i.
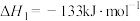
ii.
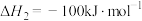
又已知在相同条件下,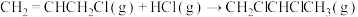 的正反应的活化能
的正反应的活化能 为
为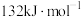 ,则逆反应的活化能
,则逆反应的活化能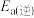 为
为___________  。
。
(2)查阅资料得知,反应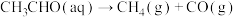 在含有少量
在含有少量 的溶液中分两步进行:
的溶液中分两步进行:
第Ⅰ步反应为 (慢反应);
(慢反应);
第Ⅱ步为快反应。
增大 的浓度
的浓度_____ (填“能”或“不能”)明显增大总反应的平均速率,理由为___________ 。
(3)一种以 和
和 为原料,利用
为原料,利用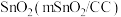 和CuO纳米片(CuONS/CF)作催化电极,制备甲酸和甲酸盐的电化学装置的工作原理如图所示。
和CuO纳米片(CuONS/CF)作催化电极,制备甲酸和甲酸盐的电化学装置的工作原理如图所示。
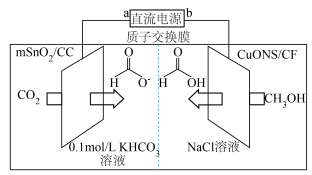
①基态C原子的价电子的轨道表示式为___________ 。
②电解过程中阳极电极反应式为___________ 。
③当有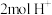 通过质子交换膜时,装置中生成
通过质子交换膜时,装置中生成 和HCOOH总共
和HCOOH总共___________ mol。
(4)PT(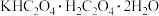 ,名称:四草酸钾)是一种分析试剂。室温时,
,名称:四草酸钾)是一种分析试剂。室温时, 的
的 、
、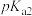 分别为1.23、4.19(
分别为1.23、4.19( ),向
),向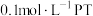 中滴加NaOH至溶液呈中性,则
中滴加NaOH至溶液呈中性,则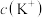
______  ,
,
______ 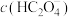 (填写“<”“>”或“=”)。
(填写“<”“>”或“=”)。
(1)已知下列热化学方程式:
i.

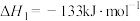
ii.

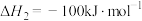
又已知在相同条件下,
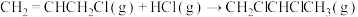 的正反应的活化能
的正反应的活化能 为
为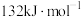 ,则逆反应的活化能
,则逆反应的活化能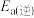 为
为 。
。(2)查阅资料得知,反应
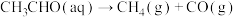 在含有少量
在含有少量 的溶液中分两步进行:
的溶液中分两步进行:第Ⅰ步反应为
 (慢反应);
(慢反应);第Ⅱ步为快反应。
增大
 的浓度
的浓度(3)一种以
 和
和 为原料,利用
为原料,利用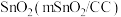 和CuO纳米片(CuONS/CF)作催化电极,制备甲酸和甲酸盐的电化学装置的工作原理如图所示。
和CuO纳米片(CuONS/CF)作催化电极,制备甲酸和甲酸盐的电化学装置的工作原理如图所示。
①基态C原子的价电子的轨道表示式为
②电解过程中阳极电极反应式为
③当有
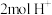 通过质子交换膜时,装置中生成
通过质子交换膜时,装置中生成 和HCOOH总共
和HCOOH总共(4)PT(
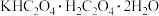 ,名称:四草酸钾)是一种分析试剂。室温时,
,名称:四草酸钾)是一种分析试剂。室温时, 的
的 、
、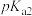 分别为1.23、4.19(
分别为1.23、4.19( ),向
),向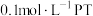 中滴加NaOH至溶液呈中性,则
中滴加NaOH至溶液呈中性,则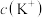
 ,
,
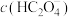 (填写“<”“>”或“=”)。
(填写“<”“>”或“=”)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】化学上把外加少量酸、碱而 基本不变的溶液称为缓冲溶液。回答下列问题:
基本不变的溶液称为缓冲溶液。回答下列问题:
I.25℃时,浓度均为 的
的 和
和 的缓冲溶液的
的缓冲溶液的 。
。
(1)改变下列条件,能使 稀溶液中
稀溶液中 的值增大的是
的值增大的是___________ (填字母)。
a.加入 固体 b.升温 c.稀释 d.加入
固体 b.升温 c.稀释 d.加入 固体
固体
(2)该缓冲溶液中各离子浓度由大到小的顺序为___________ 。
Ⅱ.人体血液里主要通过碳酸氢盐缓冲体系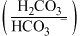 维持
维持 稳定。
稳定。
(3)已知正常人体血液在正常体温时, 的一级电离常数
的一级电离常数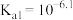 ,
, ,
, ,此时溶液的
,此时溶液的
___________ ,当过量的酸进入血液中时,血液缓冲体系中 的值将
的值将___________ (填“变大”、“变小”或“不变”)。
(4)某同学分别用 和
和 溶液进行如图所示的实验。充分反应后a试管中大量存在的离子是
溶液进行如图所示的实验。充分反应后a试管中大量存在的离子是___________ 。用离子方程式表示b试管中发生的反应:___________ 。

 基本不变的溶液称为缓冲溶液。回答下列问题:
基本不变的溶液称为缓冲溶液。回答下列问题:I.25℃时,浓度均为
 的
的 和
和 的缓冲溶液的
的缓冲溶液的 。
。(1)改变下列条件,能使
 稀溶液中
稀溶液中 的值增大的是
的值增大的是a.加入
 固体 b.升温 c.稀释 d.加入
固体 b.升温 c.稀释 d.加入 固体
固体(2)该缓冲溶液中各离子浓度由大到小的顺序为
Ⅱ.人体血液里主要通过碳酸氢盐缓冲体系
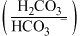 维持
维持 稳定。
稳定。(3)已知正常人体血液在正常体温时,
 的一级电离常数
的一级电离常数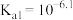 ,
, ,
, ,此时溶液的
,此时溶液的
 的值将
的值将(4)某同学分别用
 和
和 溶液进行如图所示的实验。充分反应后a试管中大量存在的离子是
溶液进行如图所示的实验。充分反应后a试管中大量存在的离子是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)①氯胺(NH2Cl)的电子式为_______ 。
②工业上可利用Cl2和NH3反应制备氯胺,该反应的化学方程式为_______ 。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0 mol·L-1 NaOH溶液充分反应放出的热量如下表所示:
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为__________ 。
(3)用焦炭还原NO的反应为:2NO(g) + C(s) N2(g) + CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为400 ℃、T ℃、400 ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为400 ℃、T ℃、400 ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_________ 。
②该反应的ΔH___ 0 (填“>”或“<”)。
③丙容器达到平衡时,NO的转化率为___________ 。
(4)常温下,在NH4HCO3溶液中,c(NH4+)________ c(HCO3-) (填“>”、“<”或“=”);反应NH4++HCO3-+H2O  NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=__________ 。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
(1)①氯胺(NH2Cl)的电子式为
②工业上可利用Cl2和NH3反应制备氯胺,该反应的化学方程式为
(2)一定条件下,不同物质的量的CO2与不同体积的1.0 mol·L-1 NaOH溶液充分反应放出的热量如下表所示:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | x |
2 | 1.0 | 2.00 | y |
(3)用焦炭还原NO的反应为:2NO(g) + C(s)
 N2(g) + CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为400 ℃、T ℃、400 ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为400 ℃、T ℃、400 ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
②该反应的ΔH
③丙容器达到平衡时,NO的转化率为
(4)常温下,在NH4HCO3溶液中,c(NH4+)
 NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=
您最近一年使用:0次



