硫酸铈铵[(NH4)4Ce(SO4)4]是分析化学常用的滴定剂。以氯化铈(CeCl3)为主要原料合成硫酸铈铵的微型流程如下:
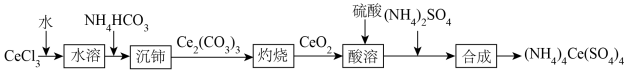
回答下列问题:
(1)基态Ce原子价层电子排布式为4f15d16s2,它有
(2)(NH4)2SO4中阴离子的空间结构是
(3)已知常温下,NH3·H2O的电离常数为Kb=1.8×10-5,H2CO3的电离常数:Ka1=4.5×10-7、Ka2=4.7×10-12.NH4HCO3溶液显
(4)写出“沉铈”的离子方程式为
(5)“灼烧”发生反应为2Ce2(CO3)(s)+O2(g)
 4CeO2(s)+6CO2(g)。某温度下,在体积可变的密闭反应器中充入足量的O2和Ce2(CO3)3(s),发生上述反应。测得平衡时CeO2的质量变化如图所示。
4CeO2(s)+6CO2(g)。某温度下,在体积可变的密闭反应器中充入足量的O2和Ce2(CO3)3(s),发生上述反应。测得平衡时CeO2的质量变化如图所示。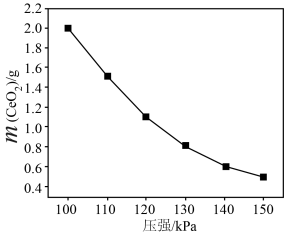
随着压强增大,CeO2质量逐渐
(6)CeO2的立方晶胞如图所示。NA为阿伏加德罗常数的值,两个铈离子最近距离为a nm。
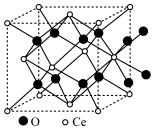
①该晶胞中,氧离子与
a.正四边形 b.正八面体 c.正四面体 d.三角锥形
②晶体密度为
更新时间:2023-10-27 21:16:34
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】磷的含氧酸有次磷酸(H3PO2)、亚磷酸(H3PO3)、磷酸(H3PO4)等多种,都是重要的化工原料。
(1)已知次磷酸(H3PO2)的水溶液中存在H3PO2分子,H3PO2与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,反应的离子方程式为____ ,生成的盐属于____ (填“正盐”或“酸式盐”)。
(2)查阅资料知25℃时,亚磷酸(H3PO3)的Ka1=5×10-2,Ka2=2.5×10-7。25℃时,Na2HPO3水解反应的Kh=____ (填数值)。
(3)若用甲基橙做指示剂,用NaOH溶液滴定某浓度的H3PO3溶液,达到滴定终点时所得溶液中c(Na+)____ c(H2PO )+2c(HPO
)+2c(HPO )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。
(4)磷酸(H3PO4)在水溶液中各种微粒的物质的量分数δ随pH的变化曲线如图所示:
①向某浓度的磷酸溶液中滴加NaOH溶液,以酚酞为指示剂,当溶液由无色变为浅红色时,发生的主要反应的离子方程式是____ 。
②从图中推断下列说法正确的是___ 。
A.25℃时,H3PO4的第三步电离常数为10-12.3
B.Na2HPO4溶液中:c(Na+)>c(H2PO )>c(H3PO4)>c(HPO
)>c(H3PO4)>c(HPO )
)
C.Na2HPO4溶液中:c(Na+)>c(H2PO )>c(PO
)>c(PO )>c(HPO
)>c(HPO )
)
D.pH=7.2时,溶液中c(Na+)+c(H+)=3c(H2PO )+3c(PO
)+3c(PO )+c(OH-)
)+c(OH-)
(1)已知次磷酸(H3PO2)的水溶液中存在H3PO2分子,H3PO2与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,反应的离子方程式为
(2)查阅资料知25℃时,亚磷酸(H3PO3)的Ka1=5×10-2,Ka2=2.5×10-7。25℃时,Na2HPO3水解反应的Kh=
(3)若用甲基橙做指示剂,用NaOH溶液滴定某浓度的H3PO3溶液,达到滴定终点时所得溶液中c(Na+)
 )+2c(HPO
)+2c(HPO )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。(4)磷酸(H3PO4)在水溶液中各种微粒的物质的量分数δ随pH的变化曲线如图所示:

①向某浓度的磷酸溶液中滴加NaOH溶液,以酚酞为指示剂,当溶液由无色变为浅红色时,发生的主要反应的离子方程式是
②从图中推断下列说法正确的是
A.25℃时,H3PO4的第三步电离常数为10-12.3
B.Na2HPO4溶液中:c(Na+)>c(H2PO
 )>c(H3PO4)>c(HPO
)>c(H3PO4)>c(HPO )
)C.Na2HPO4溶液中:c(Na+)>c(H2PO
 )>c(PO
)>c(PO )>c(HPO
)>c(HPO )
)D.pH=7.2时,溶液中c(Na+)+c(H+)=3c(H2PO
 )+3c(PO
)+3c(PO )+c(OH-)
)+c(OH-)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】自然界是各类物质相互依存、各种变化相互制约的复杂平衡体系,而水溶液中的离子平衡是其中一个重要方面。请根据所学知识,回答下列问题。
(1)查阅资料获得25℃时部分弱酸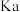 的数据:
的数据: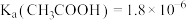 、
、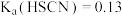 、
、 。
。
①已知 溶液呈弱碱性,试用离子反应方程式解释原因
溶液呈弱碱性,试用离子反应方程式解释原因_______ 。
②常温下,氢氟酸溶液加水稀释过程中,下列表达式的数据变大的是_______ (填序号)。
A. B.
B.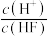 C.
C.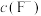
③25℃时,将浓度相等的 与
与 溶液等体积混合,溶液呈
溶液等体积混合,溶液呈_______ 性,结合有关数据和文字解释原因:_______ 。
④同浓度的 溶液和
溶液和 溶液相比,后者溶液中
溶液相比,后者溶液中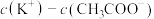
_______ 前者溶液中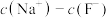 (填“<”、“=”或“>”)。
(填“<”、“=”或“>”)。
⑤已加 溶液为中性,又知
溶液为中性,又知 溶液加到
溶液加到 溶液中有无色无味气体放出,试推断
溶液中有无色无味气体放出,试推断 溶液的
溶液的
_______ 7(填“>”、“<”或“”)。
(2)已知常温下,相同物质的量浓度的 溶液和
溶液和 溶液相比,
溶液相比, 溶液的
溶液的 较小。现将
较小。现将 溶液和
溶液和 溶液等体积混合,各离子浓度关系正确的是___________(填序号)。
溶液等体积混合,各离子浓度关系正确的是___________(填序号)。
(3)25℃时,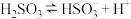 的电离常数
的电离常数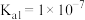 、
、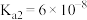 ,则该温度下
,则该温度下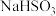 水解反应的平衡常数
水解反应的平衡常数
___________ ,若向 溶液中加入少量的
溶液中加入少量的 ,则溶液中
,则溶液中 将
将_______ (填“增大”“减小”或“不变”)
(1)查阅资料获得25℃时部分弱酸
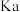 的数据:
的数据: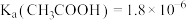 、
、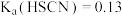 、
、 。
。①已知
 溶液呈弱碱性,试用离子反应方程式解释原因
溶液呈弱碱性,试用离子反应方程式解释原因②常温下,氢氟酸溶液加水稀释过程中,下列表达式的数据变大的是
A.
 B.
B.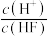 C.
C.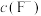
③25℃时,将浓度相等的
 与
与 溶液等体积混合,溶液呈
溶液等体积混合,溶液呈④同浓度的
 溶液和
溶液和 溶液相比,后者溶液中
溶液相比,后者溶液中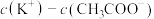
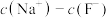 (填“<”、“=”或“>”)。
(填“<”、“=”或“>”)。⑤已加
 溶液为中性,又知
溶液为中性,又知 溶液加到
溶液加到 溶液中有无色无味气体放出,试推断
溶液中有无色无味气体放出,试推断 溶液的
溶液的
(2)已知常温下,相同物质的量浓度的
 溶液和
溶液和 溶液相比,
溶液相比, 溶液的
溶液的 较小。现将
较小。现将 溶液和
溶液和 溶液等体积混合,各离子浓度关系正确的是___________(填序号)。
溶液等体积混合,各离子浓度关系正确的是___________(填序号)。A.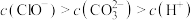 |
B.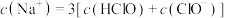 |
C.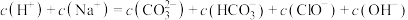 |
D. |
(3)25℃时,
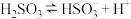 的电离常数
的电离常数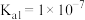 、
、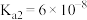 ,则该温度下
,则该温度下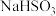 水解反应的平衡常数
水解反应的平衡常数
 溶液中加入少量的
溶液中加入少量的 ,则溶液中
,则溶液中 将
将
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】回答下列问题
(1)已知:2Cu2S(s) +3O2(g)= 2Cu2O(s)+2SO2(g) △H1=—768.2 kJ·mol-1;
2Cu2O(s) +Cu2S(s)=6Cu(s)+SO2(g) △H2=+116.0kJ ·mol-1。
则Cu2S(s) +O2(g)=2Cu(s)+ SO2(g) △H=___________ 。
(2)某兴趣小组同学如图装置进行实验,观察到两极均有气体产生,Y极溶液逐渐变成紫红色,停止实验后观察到铁电极明显变细,电解液仍澄清。查阅资料知,高铁酸根离子(FeO )在溶液中呈紫红色。
)在溶液中呈紫红色。

①电解过程中,X极溶液的pH___________ (填“增大”“减小”或“不变”)。
②电解过程中,Y极发生的电极反应为4OH—-4e—=2H2O+O2↑和___________ 。
(3)已知常温下:
①浓度均为0.1mol·L-1的Na2S溶液、NaHCO3和Na2CO3溶液,碱性由强到弱的顺序是___________ (用“>”连接,下同)。
②S2-、HS-、CO 、HCO
、HCO 四种离子结合H+能力由大到小的顺序是
四种离子结合H+能力由大到小的顺序是___________ 。
③NaHSO3的水解常数Kh=___________ (保留 2位有效数字)。
④CH3COONH4溶液显___________ 性;NH4HCO3溶液显___________ 性。
(1)已知:2Cu2S(s) +3O2(g)= 2Cu2O(s)+2SO2(g) △H1=—768.2 kJ·mol-1;
2Cu2O(s) +Cu2S(s)=6Cu(s)+SO2(g) △H2=+116.0kJ ·mol-1。
则Cu2S(s) +O2(g)=2Cu(s)+ SO2(g) △H=
(2)某兴趣小组同学如图装置进行实验,观察到两极均有气体产生,Y极溶液逐渐变成紫红色,停止实验后观察到铁电极明显变细,电解液仍澄清。查阅资料知,高铁酸根离子(FeO
 )在溶液中呈紫红色。
)在溶液中呈紫红色。
①电解过程中,X极溶液的pH
②电解过程中,Y极发生的电极反应为4OH—-4e—=2H2O+O2↑和
(3)已知常温下:
| 弱电解质 | H2S | H2CO3 | H2SO3 | CH3COOH | NH3· H2O |
| 电离常数 | Ka1=1.1 ×10 -7 Ka2=1.3 ×10-13 | Ka1=4.5 ×10-7 Ka2=4.7 ×10-11 | Ka1=1.4 ×10-2 Ka2=6.0 ×10-8 | Ka=1.8 ×10-5 | Kb=1.8 ×10-5 |
①浓度均为0.1mol·L-1的Na2S溶液、NaHCO3和Na2CO3溶液,碱性由强到弱的顺序是
②S2-、HS-、CO
 、HCO
、HCO 四种离子结合H+能力由大到小的顺序是
四种离子结合H+能力由大到小的顺序是③NaHSO3的水解常数Kh=
④CH3COONH4溶液显
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中___________ 区元素,其基态原子的价电子排布式为___________ 。
(2)基态Na原子中,核外电子占据的原子轨道总数为___________ ,最高能层电子云轮廓图形状为___________ 。
(3)C、O、Cl的电负性由大到小的顺序为___________ (用元素符号表示)。
(4)CO 的几何构型为
的几何构型为___________ ;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为___________ ,1mol碳酸丙烯酯中σ键的数目为___________ 。
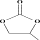
回答下列问题:
(1)Te属于元素周期表中
(2)基态Na原子中,核外电子占据的原子轨道总数为
(3)C、O、Cl的电负性由大到小的顺序为
(4)CO
 的几何构型为
的几何构型为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐2】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________ ,基态S原子电子占据最高能级的电子云轮廓图为_________ 形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________ 。
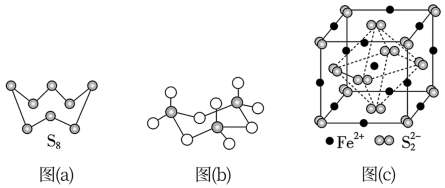
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________ 。
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____ 形,其中共价键的类型有______ 种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________ 。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏伽德罗常数的值为NA,其晶体密度的计算表达式为___________ g·cm−3;晶胞中Fe2+位于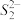 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为______ nm。
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | −85.5 | 115.2 | >600(分解) | −75.5 | 16.8 | 10.3 |
| 沸点/℃ | −60.3 | 444.6 | −10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏伽德罗常数的值为NA,其晶体密度的计算表达式为
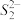 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2 MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示。
(1)基态Ti原子的价电子排布式为___________ 。
(2)NaH的熔点为800℃,不溶于有机溶剂。NaH属于_____ 晶体,其电子式为______ 。
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为____ (标明配位键)。
(4)AlH4-中,Al的轨道杂化方式为_____ ;列举与AlH4-空间构型相同的两种离子:_____ (填化学式)。
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有_____ 个;NaAlH4晶体的密度为____ g/cm3(用含a 的代数式表示)。
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为___________ 。

(1)基态Ti原子的价电子排布式为
(2)NaH的熔点为800℃,不溶于有机溶剂。NaH属于
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为
(4)AlH4-中,Al的轨道杂化方式为
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】砷及其化合物有着广泛的用途,但也会严重危害环境安全和人体健康。
(1)雌黄(As2S3)和雄黄(As4S4)都是提取砷的主要矿物原料。砷元素有+2、+3、+5等常见价态。
①如图1为As4S4分子的空间结构模型。已知As2S3分子中没有π键,其结构式可表示为_____________ 。
②将含砷废渣(主要成分是As2S3)制成浆料再通入O2氧化,转化为H3AsO4和单质硫,是工业提取砷元素的途径之一,写出As2S3转化为H3AsO4的化学方程式____________ ;该反应需要在加压下进行,原因是____________ 。
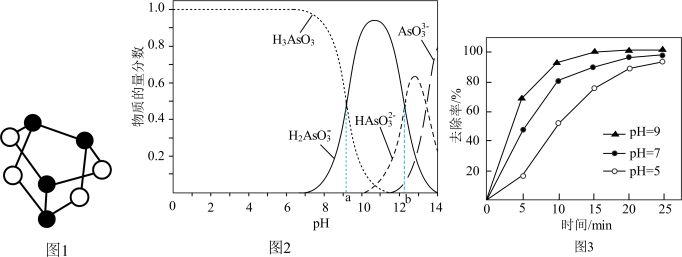
(2)As2S3可转化为用于治疗白血病的亚砷酸(H3AsO3)。H3AsO3在水溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如图2所示。
①H3AsO3的电离常数分别为Ka1=10-9.2、K a2=10-12.1、K a3=10-13.4,则b点pH=_______________ 。
②工业含As(Ⅲ)废水具有剧毒,常用铁盐处理后排放。其原理是:铁盐混凝剂在溶液中产生Fe(OH)3胶粒,其表面带有正电荷,可吸附含砷化合物。不同pH条件下铁盐对水中As(Ⅲ)的去除率如图3所示。在pH=5~9溶液中,pH越大,铁盐混凝剂去除水中As(Ⅲ)的速率越快,原因是____________ 。
(3)水体中As(Ⅲ)的毒性远高于As(V)且As(Ⅴ)更易除去,常用的处理方法是先将废水中的As(Ⅲ)氧化为As(V),再通过一定方法除去As(V)。
①H3AsO3可被H2O2进一步氧化为H3AsO4。H3AsO3的酸性____________ H3AsO4的酸性(填“>”或“<”)。
②在pH=7的水溶液中,以足量的FeCl3为沉淀剂,可将HAsO4-转化为FeAsO4沉淀除去,其离子方程式为____________ 。【已知: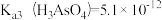 ,
,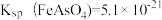 】
】
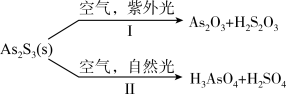
(4)油画创作通带需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3)褪色的主要原因是发生了以下两种化学反应:
下列说法正确的是____________。

(1)雌黄(As2S3)和雄黄(As4S4)都是提取砷的主要矿物原料。砷元素有+2、+3、+5等常见价态。
①如图1为As4S4分子的空间结构模型。已知As2S3分子中没有π键,其结构式可表示为
②将含砷废渣(主要成分是As2S3)制成浆料再通入O2氧化,转化为H3AsO4和单质硫,是工业提取砷元素的途径之一,写出As2S3转化为H3AsO4的化学方程式
(2)As2S3可转化为用于治疗白血病的亚砷酸(H3AsO3)。H3AsO3在水溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如图2所示。
①H3AsO3的电离常数分别为Ka1=10-9.2、K a2=10-12.1、K a3=10-13.4,则b点pH=
②工业含As(Ⅲ)废水具有剧毒,常用铁盐处理后排放。其原理是:铁盐混凝剂在溶液中产生Fe(OH)3胶粒,其表面带有正电荷,可吸附含砷化合物。不同pH条件下铁盐对水中As(Ⅲ)的去除率如图3所示。在pH=5~9溶液中,pH越大,铁盐混凝剂去除水中As(Ⅲ)的速率越快,原因是
(3)水体中As(Ⅲ)的毒性远高于As(V)且As(Ⅴ)更易除去,常用的处理方法是先将废水中的As(Ⅲ)氧化为As(V),再通过一定方法除去As(V)。
①H3AsO3可被H2O2进一步氧化为H3AsO4。H3AsO3的酸性
②在pH=7的水溶液中,以足量的FeCl3为沉淀剂,可将HAsO4-转化为FeAsO4沉淀除去,其离子方程式为
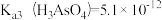 ,
,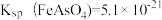 】
】(4)油画创作通带需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3)褪色的主要原因是发生了以下两种化学反应:

下列说法正确的是____________。
A.S2O 和SO 和SO 的空间结构都是正四面体形 的空间结构都是正四面体形 |
| B.反应I和Ⅱ中,元素As和S都被氧化 |
| C.反应I和Ⅱ中,氧化1 mol As2S3转移的电子数之比为3:7 |
D.反应I和Ⅱ中,参加反应的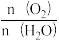 :I<Ⅱ :I<Ⅱ |
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】Na2FeO4、Li4YiO12和 LiFePO4均可用作电极材料。请回答下列问题:
(1)基态 Fe3+的价层电子轨道表达式为_______ ;同周期元素中,基态原子的未成对电子数与基态 Fe3+相同的元素为_______ 。
(2)PO 的空间构型为
的空间构型为_______ ,其中 P 原子的杂化方式为_______ ;写出一种与 PO 互为等电子体且中心原子与 P 不同主族的阴离子:
互为等电子体且中心原子与 P 不同主族的阴离子:_______ (填离子符号)。
(3)[Ti(H2O)6]Cl3为紫色晶体,其中 1mol 阳离子中所含 σ键的数目为_______ ;
(4)已知物质间的转化关系如图甲所示,其中 a、c 均大于 0。
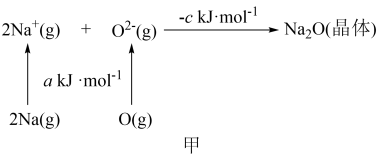
①基态钠原子的第一电离能为_______ kJ∙mol-1
②相同条件下,Li2O 的晶格能_______ (填“>”“<”或“=”)c kJ∙mol-1,原因为_______ 。
③Na2O 的立方晶胞结构如图乙所示。若紧邻的两个 Na+之间的距离为 d pm,阿伏加德罗常数的值为 NA,晶体的密度为 ρ g∙cm-3,则 Na 的摩尔质量可表示为_______ g∙mol-1(用含有 d、ρ、NA的代数式表示)。

(1)基态 Fe3+的价层电子轨道表达式为
(2)PO
 的空间构型为
的空间构型为 互为等电子体且中心原子与 P 不同主族的阴离子:
互为等电子体且中心原子与 P 不同主族的阴离子:(3)[Ti(H2O)6]Cl3为紫色晶体,其中 1mol 阳离子中所含 σ键的数目为
(4)已知物质间的转化关系如图甲所示,其中 a、c 均大于 0。

①基态钠原子的第一电离能为
②相同条件下,Li2O 的晶格能
③Na2O 的立方晶胞结构如图乙所示。若紧邻的两个 Na+之间的距离为 d pm,阿伏加德罗常数的值为 NA,晶体的密度为 ρ g∙cm-3,则 Na 的摩尔质量可表示为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】工业上以制作印刷电路的废液(含 、
、 、
、 、
、 )生产
)生产 和蚀刻液重新生成的流程如下:
和蚀刻液重新生成的流程如下: 是一种白色粉末,微溶于水、不溶于乙醇。
是一种白色粉末,微溶于水、不溶于乙醇。
请回答下列问题:
(1)Y中所含溶质的化学式为___________ 。
(2)下列说法正确的是___________ 。
A. 微溶于水、不溶于乙醇是因为水的极性比乙醇小
微溶于水、不溶于乙醇是因为水的极性比乙醇小
B.相同条件下,滤渣1和X分别与等浓度的盐酸反应,滤渣①的反应速率快
C. 分子的VSEPR模型为平面三角形
分子的VSEPR模型为平面三角形
D.基态亚铜的价层电子排布式为 ,故
,故 与稀硫酸不反应
与稀硫酸不反应
E.工业上对滤渣2用浓硫酸进行了处理,符合绿色化学的原则
(3)写出上述流程中生成 的化学方程式
的化学方程式___________ 。
(4)浓硫酸是一种高沸点的酸,溶于水放出大量的热,请从物质结构与微粒之间作用力的角度解释上述硫酸的两点性质___________ 。
(5)滤液1需要加过量Z,检验Z过量的方法是___________ 。
 、
、 、
、 、
、 )生产
)生产 和蚀刻液重新生成的流程如下:
和蚀刻液重新生成的流程如下: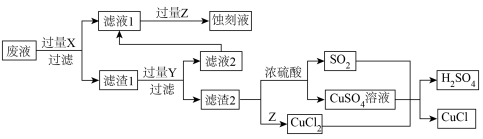
 是一种白色粉末,微溶于水、不溶于乙醇。
是一种白色粉末,微溶于水、不溶于乙醇。请回答下列问题:
(1)Y中所含溶质的化学式为
(2)下列说法正确的是
A.
 微溶于水、不溶于乙醇是因为水的极性比乙醇小
微溶于水、不溶于乙醇是因为水的极性比乙醇小B.相同条件下,滤渣1和X分别与等浓度的盐酸反应,滤渣①的反应速率快
C.
 分子的VSEPR模型为平面三角形
分子的VSEPR模型为平面三角形D.基态亚铜的价层电子排布式为
 ,故
,故 与稀硫酸不反应
与稀硫酸不反应E.工业上对滤渣2用浓硫酸进行了处理,符合绿色化学的原则
(3)写出上述流程中生成
 的化学方程式
的化学方程式(4)浓硫酸是一种高沸点的酸,溶于水放出大量的热,请从物质结构与微粒之间作用力的角度解释上述硫酸的两点性质
(5)滤液1需要加过量Z,检验Z过量的方法是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】填空
(1)某化合物的晶胞如图,其化学式是___________ ,晶体类型是___________ 。 大
大 键。
键。
①产物中___________ (填“ ”或“
”或“ ”)位置的N原子更容易形成配位键。
”)位置的N原子更容易形成配位键。
②反应物中氮氮键键长___________ 产物中氮氮键键长(填“>”“<”或“=”),原因是_________ 。
(3)①已知 中含有大
中含有大 键
键 则
则 、
、 与
与 的键角由小到大的顺序为
的键角由小到大的顺序为_______ 。
②氮的某种氧化物晶胞结构如图所示,由两种离子构成。阴阳离子中N原子的杂化类型分别为___________ ,晶体密度为___________ 。
(1)某化合物的晶胞如图,其化学式是
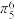 大
大 键。
键。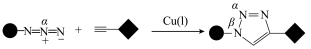
①产物中
 ”或“
”或“ ”)位置的N原子更容易形成配位键。
”)位置的N原子更容易形成配位键。②反应物中氮氮键键长
(3)①已知
 中含有大
中含有大 键
键 则
则 、
、 与
与 的键角由小到大的顺序为
的键角由小到大的顺序为②氮的某种氧化物晶胞结构如图所示,由两种离子构成。阴阳离子中N原子的杂化类型分别为
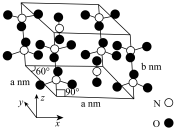
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】(1)氯化铁溶液用于检验食用香精乙酰乙酯时,会生成紫色配合物,其配离子结构如图所示。
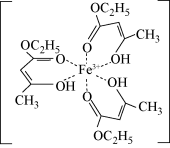
①此配合物中,基态铁离子的价电子排布式为________________ 。
②此配合物中碳原子的杂化轨道类型有________________ 。
③此配离子中含有的化学键有____________ (填字母)。
A. 离子键 B. 金属键 C. 极性键 D. 非极性键 E. 配位键 F. 氢键 G.σ键 H. π键
④氯化铁在常温下是固体,熔点为 306℃,沸点为 315℃,在 300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断氯化铁的晶体类型为_________ 。
(2)基态 A 原子的价电子排布式为 3s23p5,铜与A 形成化合物的晶胞如图所示(黑球代表铜原子)。
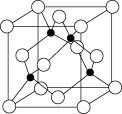
①该化合物的化学式为____________ ,A原子的配位数是______________ 。
②已知该化合物晶体的密度为ρg·cm-3,阿伏加 德罗常数的值为 NA,则该晶体中 Cu 原子和A 原子之间的最短距离为________ pm(列出计算表达式即可)。

①此配合物中,基态铁离子的价电子排布式为
②此配合物中碳原子的杂化轨道类型有
③此配离子中含有的化学键有
A. 离子键 B. 金属键 C. 极性键 D. 非极性键 E. 配位键 F. 氢键 G.σ键 H. π键
④氯化铁在常温下是固体,熔点为 306℃,沸点为 315℃,在 300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断氯化铁的晶体类型为
(2)基态 A 原子的价电子排布式为 3s23p5,铜与A 形成化合物的晶胞如图所示(黑球代表铜原子)。

①该化合物的化学式为
②已知该化合物晶体的密度为ρg·cm-3,阿伏加 德罗常数的值为 NA,则该晶体中 Cu 原子和A 原子之间的最短距离为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】锰及其化合物用途非常广泛,也是人体的重要微量元素。请回答下列问题:
(1)锰在元素周期表中的位置为___________
(2)下列状态的锰原子或离子中,能用原子发射光谱捕捉以鉴别锰元素的是___________(填序号)。
(3)锰能形成多种化合物如 、
、 、
、 、
、 ,其中磁矩μ最大的是
,其中磁矩μ最大的是___________ 。(已知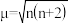 ,其中n为金属离子核外的单电子数)
,其中n为金属离子核外的单电子数)
(4)锰的一种配合物的化学式为[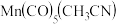 ]。配体
]。配体 与中心原子形成配位键时,提供孤对电子的原子是
与中心原子形成配位键时,提供孤对电子的原子是___________ 原子;该配合物中除氢以外的元素,第一电离能从小到大的顺序为___________ (用元素符号表示)。
(5)水杨醛缩邻氨基苯酚(A)又被称为“锰试剂”,可与 形成黄色的配合物,其同分异构体水杨醛缩邻氨基苯酚(B),沸点较高的是
形成黄色的配合物,其同分异构体水杨醛缩邻氨基苯酚(B),沸点较高的是___________ (填“A”或“B”),原因是___________ 。

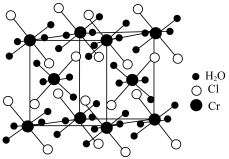
(6)阿拉班达石(alabandite)是了种属于立方晶系的硫锰矿,其晶胞如图,硫原子的堆积方式为___________ 。通过晶体衍射测得阿拉班达石晶胞中,最近两个硫原子之间的距离为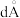 (
(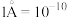 m),若晶体密度为
m),若晶体密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
___________ (写计算表达式,不要求化简)。

(1)锰在元素周期表中的位置为
(2)下列状态的锰原子或离子中,能用原子发射光谱捕捉以鉴别锰元素的是___________(填序号)。
A. | B. | C.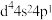 | D.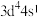 |
 、
、 、
、 、
、 ,其中磁矩μ最大的是
,其中磁矩μ最大的是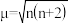 ,其中n为金属离子核外的单电子数)
,其中n为金属离子核外的单电子数)(4)锰的一种配合物的化学式为[
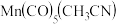 ]。配体
]。配体 与中心原子形成配位键时,提供孤对电子的原子是
与中心原子形成配位键时,提供孤对电子的原子是(5)水杨醛缩邻氨基苯酚(A)又被称为“锰试剂”,可与
 形成黄色的配合物,其同分异构体水杨醛缩邻氨基苯酚(B),沸点较高的是
形成黄色的配合物,其同分异构体水杨醛缩邻氨基苯酚(B),沸点较高的是
(6)阿拉班达石(alabandite)是了种属于立方晶系的硫锰矿,其晶胞如图,硫原子的堆积方式为
 (
(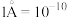 m),若晶体密度为
m),若晶体密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值

您最近一年使用:0次



